凡纳滨对虾(Litopenaeus vannamei)消化性蛋白酶的分布及种类
■ 曹启猛 于跃芹 王 雷 王宝杰
(1.青岛科技大学化学与分子工程学院,山东青岛 266042;2.中国科学院实验海洋生物学重点实验室,山东青岛 266071;3.青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室,山东青岛 266071)
(参考文献21篇,刊略,需者可函索)
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,以其肉质鲜嫩、营养价值高的特点深受广大消费者喜爱,是我国水产养殖的主要品种之一。近几年,随着对虾养殖规模的迅速增长,养殖环境的不断恶化,对虾养殖中逐渐出现饵料利用率低、增长速度慢、生长周期长等问题,增加了养殖成本,降低了对虾的品质。全面了解凡纳滨对虾消化酶(尤其是蛋白酶)的特点及组成,为凡纳滨对虾合理养殖提供科学依据是解决该问题的方法之一。
酶谱法(Zymography)是一种常用的酶检测技术,利用染色方法来标记酶的位置或通过恢复酶的活性使之与特异性底物反应来对其染色,即可在凝胶看到酶迁移到达的位置出现特异的色带。通过观察色带的位置和数量,即可推断样品中的酶的种类。酶谱分析法能够在相对较短的时间内分离复杂的蛋白酶样品,并得到近似分子量,因此在科学研究领域和实践中均有广泛的应用。Hosseininaveh等对谷斑皮蠹(一种小麦害虫)消化蛋白酶研究发现,凝胶电泳图显示在谷斑皮蠹幼虫的中肠位置至少有六条蛋白酶条带,以丝氨酸蛋白酶为主,并未发现半胱氨酸蛋白酶;Liu等对海洋细菌蛋白酶特点分析得到,弧菌的细胞外蛋白酶的分子量约为35 kDa;Al-Sweed等利用酶谱分析法对眼镜蛇毒素中金属蛋白酶活力的调查发现,在55 kDa处有蛋白条带,推断该毒素中金属蛋白酶的分子量为55 kDa或分子量为110 kDa的二聚体。
为了解凡纳滨对虾消化性蛋白酶的种类和分布,并对凡纳滨对虾消化生理学的研究和科学合理养殖提供一定的理论基础,本文采用偶氮酪蛋白(Azocasein)水解法对凡纳滨对虾中肝胰腺、胃和肠道中总蛋白酶活力和蛋白酶分布进行探究,并利用酶抑制剂实验和含底物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(substrate-SDS-PAGE)法对消化蛋白酶的种类进行对比分析。
1 材料与方法
1.1 实验材料
实验虾于2015年9月由中国科学院海洋所胶南养殖基地提供,随机选取10尾进行体长和体重的测量,取平均值,平均体长(8.12±0.79)cm,平均体重为(7.15±0.84)g。该养殖基地采用大棚养殖模式,海水经过蓄水沉淀池的消毒、沉淀和净化处理后引入对虾养殖池使用。全程使用优质人工饵料,水温控制在27.5~30.0 ℃。
1.2 粗酶液的制备
凡纳滨对虾饥饿24 h,在冰板上解剖,取出肝胰腺、胃和肠并称重,按1∶4(w/v)的比例加入4℃预冷的50 mmol/l Tris-HCl(pH值7.4)缓冲液,将取出的消化腺分别剪碎后在玻璃匀浆器中匀浆,匀浆液4℃下静置过夜,在4℃、10 000×g条件下离心30 min。收集上清液作为消化酶粗提液,置于-80℃下保存备用。
1.3 蛋白酶活力的检测
1.3.1 pH值对总蛋白酶活力的影响
参照Bezerra等的方法,采用Azocasein(偶氮酪蛋白)水解法检测不同pH值下总蛋白酶活力,略有修改。具体操作为:50 μl 1%(w/v)Azocasein(不同pH值的缓冲液)溶液中,加入30μl的粗酶液,混合均匀后,25℃下恒温孵育60 min,加入240μl 20%的三氯乙酸(TCA)溶液终止反应,15 min后,8 000×g离心5 min,取70μl的上清液与130μl 1 M NaOH 于96孔板中混合均匀(注意不要产生气泡),用酶标仪在450 nm处测吸光度。蛋白酶活力单位:相应pH值下,温度25℃时,对虾蛋白酶每分钟水解1%Azocation吸光度变化0.001的量,单位为U。比活力定义为每毫克蛋白中所含有的酶活力单位数,单位为U/mg。消化蛋白酶中蛋白含量的检测采用Bradford法,实验步骤参考蛋白浓度测定试剂盒检测(Tiangen公司)。
不同pH值缓冲液的配制:不同的pH值缓冲液的配制参考Riseh等方法,略有改动。pH值3~12采用40 mM glycine-phosphate-acetic-citric缓冲体系。pH值1~2采用不同浓度的盐酸溶液配制。
1.3.2 温度对总蛋白酶的影响
将 50 μl 1%(w/v)Azocasein(pH 值 7.0,40 mM glycine-phosphate-acetic-citric)和30 μl的粗酶液混合均匀后,分别置于 10、20、30、40、50、60、70、80、90℃下反应60 min,其余操作与1.3.1相同。蛋白酶活力单位:相应温度下,pH值7.0时,对虾蛋白酶每分钟水解1%Azocation吸光度变化0.001的量,单位为U。比活力定义为每毫克蛋白中所含有的酶活力单位数,单位为U/mg。
1.3.3 蛋白酶水解活力的分布
在最适pH值(pH值8.5)和30℃下,采用Azocasein水解法,对三种消化酶粗提液进行蛋白酶活力的检测。蛋白酶活力单位:pH值8.5,温度30℃下,对虾蛋白酶每分钟水解1%Azocation吸光度变化0.001的量,单位为U。比活力定义为每毫克蛋白中所含有的酶活力单位数,单位为U/mg。
1.4 蛋白酶抑制剂对消化性蛋白酶的影响
选取碘乙酰胺(IAM)、胃蛋白酶抑制剂(Pepstatin A)、苯甲基磺酰氟(PMSF)、甲苯磺酰-苯丙氨酸氯甲基酮(TPCK)、乙二胺四乙酸(EDTA)、大豆胰蛋白酶抑制剂(SBTI)等六种不同类型特异性蛋白酶分别处理蛋白酶样品,不同蛋白酶抑制剂的相应的溶剂、浓度和对应的靶蛋白酶见表1。样品处理参照Darvishzadeh等操作如下:蛋白酶和不同蛋白酶抑制按1∶1的(v/v)混合并在25℃恒温箱内恒温孵育60 h后,取30μl的混合液并50μl 1%Azocasein溶液混合均匀,30℃恒温箱中反应60 h,参照Azocasein水解法检测不同蛋白酶抑制剂作用下的蛋白酶酶活。根据不同抑制剂作用下的蛋白酶剩余活力初步判断蛋白酶的种类(见表1)。

表1 不同蛋白酶抑制剂对应的溶剂和靶蛋白酶
1.5 电泳酶谱分析
碱性蛋白酶电泳酶谱分析参照Zibaee等的方法,采用底物-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(substrate-SDS-PAGE)对粗酶液中碱性蛋白酶进行分离,略有改动。具体操作为:10μl的粗酶液与10μl抑制剂溶液混合,在30℃恒温箱中孵育60 min后,加入5 μl 5×样品缓冲液(不含DTT),离心,取15 μl的上清液加入胶孔(分离胶浓度为12%(w/v),浓缩胶浓度为3.9%(w/v)),利用垂直电泳仪对样品进行电泳,初始电压为100 V,待样品迁移至分离胶界面时,将电压调整至150 V,直至电泳结束(约120 min);将胶从胶板上小心取下,放入胶盘中,用纯净水冲洗两次(每次5 min),将胶置于100 ml 3%casein(pH值8.5,50 mM Tris-HCl)中,4 ℃孵育30 min,用纯净水代替casein溶液,并置于37℃孵育30 min,然后依次用考马斯亮蓝R-250染液染色60 min,脱色液脱色60 min。待条带清晰时,凝胶成像仪拍照。
1.6 数据处理与分析
本实验采用Excel对实验数据进行处理,并用统计分析软件SPSS17.0进行单因素方差分析(One way ANOVA),结果采用“平均值±标准差(mean±SD)”表示,显著性水平设为0.05。采用绘图软件Origin8.5进行绘图。
2 实验结果
2.1 总蛋白酶活力和碱性蛋白酶活力
采用Azocasein水解法检测三种消化腺(肝胰腺、胃和肠道)总蛋白酶粗提液在不同pH值下的蛋白水解活性,结果见图1。由图1可以看出,肝胰腺和肠道总蛋白酶活力与pH值关系呈现典型的单峰型曲线,在pH值8.5时蛋白酶比活力最高,当pH值小于8.5时,蛋白酶比活力随着pH值的增加而增加,pH值大于8.5时,蛋白酶比活力随着pH值的增大而减小。胃蛋白酶粗提液蛋白酶活力呈现双峰型曲线,在pH值3.0和pH值8.5时分别有一条比活力不同的蛋白水解峰,pH值3.0时蛋白水解峰活力较低,其比活力显著低于pH值为8.5时蛋白水解峰。另外,三种消化腺中的消化蛋白酶在碱性条件(pH值7~12)下的蛋白酶比活力显著大于酸性条件(pH值1~7)下蛋白酶比活力。由此可见,凡纳滨对虾消化蛋白酶以碱性蛋白酶为主,只有在胃中含有少量酸性蛋白酶,且活性较低。温度对不同消化腺蛋白酶比活力的影响见图2。由图2可以看出,三种消化腺(肝胰腺、胃和肠道)总蛋白酶均只有一个蛋白水解峰,在50℃时蛋白酶比活力最高。当温度低于50℃时,蛋白酶比活力随着温度的升高而增加,温度高于50℃时,蛋白酶比活力随着温度的降低而减小。

图1 pH值对凡纳滨对虾消化性蛋白酶比活力的影响

图2 温度对凡纳滨对虾消化性蛋白酶比活力的影响
在最适pH值(pH值8.5)、温度30℃时不同消化腺消化蛋白酶比活力对比如图3所示,其中肝胰腺、胃和肠道碱性蛋白酶比活力分别为(98.74±3.95)、(89.34±2.75)U/mg和(66.00±2.07)U/mg,显著性分析表明三组有显著性差异(P<0.05)。实验说明,在三种消化腺中均含有消化性蛋白酶,其中肝胰腺中含量最多,其次是胃,肠道中含量最低。

图3 不同消化腺中碱性蛋白酶的比活力
2.2 蛋白酶种类的探究
2.2.1 酶抑制剂实验
为探究不同蛋白酶抑制剂对凡纳滨对虾消化腺中消化性蛋白酶的抑制效果,本文用不同特异性蛋白酶抑制剂分别处理蛋白酶粗提液并检测酶的剩余活力,结果见表2。由表2可知,在肝胰腺、胃和肠道的消化腺蛋白酶中,苯甲基磺酰氟(PMSF)对三种消化蛋白酶的抑制率最高,分别为(79.43±0.58)%、(71.18±0.18)%和(71.72±1.37)%,其次为大豆胰蛋白酶抑制剂(SBTI)和胃蛋白酶抑制剂(PepstainA),抑制率最低的为碘乙酰胺(IAM),基本没有抑制效果或抑制效果很微弱。对比表1中各特异性蛋白酶抑制剂的靶蛋白酶发现,PMSF、SBTI的靶蛋白酶是丝氨酸蛋白酶,且对消化酶的抑制率最高,说明丝氨酸类蛋白酶是三种消化腺中主要消化蛋白酶,Pepstatin A的抑制率仅次于PMSF、SBTI,其靶蛋白酶为天门冬氨酸蛋白酶,故消化酶中同样含有天门冬氨酸类蛋白酶,IAM对蛋白酶基本无抑制作用,故消化酶中基本不含有半胱氨酸类蛋白酶。另外,甲苯磺酰-苯丙氨酸氯甲基酮(TPCK)和金属蛋白酶抑制剂(EDTA)同样表现出了不同程度的抑制效果,因此消化蛋白酶中可能含有胰凝乳蛋白类酶和金属蛋白类酶。
2.2.2 酶谱分析(zymogram analysis)
为进一步了解凡纳滨对虾消化腺消化性蛋白酶的种类和特性,分别对凡纳滨对虾肝胰腺、胃和肠道的粗酶液进行了底物-SDS-PAGE电泳实验,结果如图4(A、B、C)所示。从酶谱图中清晰显示出肝胰腺、胃和肠道中至少有8条(泳道1)蛋白水解带,且不同消化腺中的8条蛋白水解带的具有相似的分子量,分别为~48.4、~32.5、~26.9、~25.2、~21.6、~19.8、~15.4、~13.6 kDa。对比8种碱性蛋白酶水解带的亮度发现,8种消化蛋白酶均是分子量最小的两种蛋白酶(~15.4、~13.6 kDa)蛋白水解带最亮,说明这两种蛋白酶活性最强,这种现象在胃中表现的最为显著。
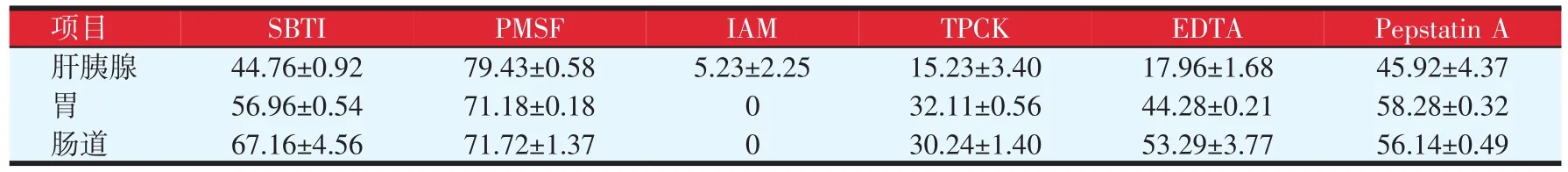
表2 不同蛋白酶抑制剂对凡纳滨对虾消化腺中蛋白酶的抑制率(%)
分别用六种不同类型特异性蛋白酶抑制剂(SBTI、PMSF、IAM、TPCK、EDTA和Pepstain A)分别处理蛋白酶粗酶液后,进行底物-SDS-PAGE电泳实验,结果见图4(泳道2~7)。蛋白酶水解条带的亮度与蛋白酶活力在一定程度上呈正相关,水解条带越亮说明蛋白酶活力越强;若在某种蛋白酶抑制剂的作用下,水解条带变暗,说明蛋白酶被该蛋白酶抑制剂所抑制,是该蛋白酶抑制剂的靶蛋白酶,进而可判断该蛋白酶的种类。通过与空白样品(泳道1)对比发现,在肝胰腺(图A)、胃(图B)和肠道(图 C)蛋白酶的谱图中,分子量为~48.4 kDa的蛋白酶,对六种蛋白酶抑制剂均不敏感(水解带的亮度没有明显变弱或消失);分子量最小(~15.4 kDa和~13.6 kDa)的两条水解带完全消失,说明这两种蛋白酶对SBTI和PepstainA表现出较强的敏感性,同时这两条水解带在PMSF、EDTA作用下,两条水解带均亮度减弱,说明对PMSF、EDTA表现出弱敏感性,这两种蛋白酶活性可以同时被这三种蛋白酶抑制剂抑制,说明这两种蛋白酶含有多种蛋白酶抑制剂的活性中心,其蛋白酶种类有待进一步研究。胰凝乳蛋白酶和胰蛋白酶均属于丝氨酸蛋白酶,因TPCK是一种特异性很强的胰凝乳蛋白酶抑制剂,能够被TPCK抑制的丝氨酸蛋白酶则为胰凝乳蛋白酶,不能被TPCK抑制的丝氨酸蛋白酶则为胰蛋白酶。肝胰腺中四种蛋白酶(~26.9、~25.2、~21.6、~19.8 kDa)对PMSF和TPCK均敏感,四种酶的水解条带的亮度均有明显变弱或消失,但对IMA、EDTA和Pepstain A不敏感,表明这四种蛋白酶是丝氨酸类蛋白酶,因为TPCK是一种特异性很强的胰凝乳蛋白酶抑制剂,故它们是凝乳蛋白类酶;蛋白酶(~32.5 kDa)对 SBTI和 PMSF 均有较强的敏感性,但对TPCK未表现出敏感性,可能为胰蛋白类酶。胃中蛋白酶粗提液中水解带的位置分别为~32.5 kDa和~19.8 kDa的两种蛋白酶被SBTI或PMSF抑制,但未被TPCK抑制,可能为胰蛋白类酶;分子量为~26.9、~25.2、~21.6 kDa的三种蛋白酶酶活在肠道中被PMSF和TPCK抑制,说明这三种蛋白酶为胰凝乳类蛋白酶。在肠道中,分子量为~26.9、~25.2、~21.6、~19.8 kDa四种蛋白酶的活性均被PMSF和TPCK抑制,说明这四种蛋白酶均为胰凝乳蛋白酶。

图4 凡纳滨对虾不同消化腺消化性蛋白酶的底物-SDS-PAGE
3 讨论
消化性蛋白酶是蛋白质消化的主要参与者和执行者,在动物的不同消化腺中广泛存在。因此,消化性蛋白酶的活力和种类的研究对凡纳滨对虾的科学养殖有着重要意义。凡纳滨对虾不同消化腺蛋白酶活力的最适pH值有所不同,酸性条件时,只有胃蛋白酶在pH值3.0时有一定的蛋白酶水解活性,说明酸性蛋白酶只在胃中少量存在;在碱性条件时,肝胰腺、胃和肠道消化蛋白酶均在pH值8.5时蛋白水解活力出现最高峰(见图1),说明碱性蛋白酶普遍存在于凡纳滨对虾的肝胰腺、胃和肠道。沈文英等对南美白对虾消化酶活力的研究发现碱性条件下蛋白酶的活力明显大于酸性条件下蛋白酶的活力。Maugle等发现中国对虾在偏碱性环境下有比较稳定的蛋白酶活力,因此,凡纳滨对虾消化性蛋白酶以碱性蛋白酶为主,且最适pH值为8.5,该结论与王兴强等凡纳滨对虾生长环境的最适pH值为7.5~8.5的观点相符。另外,肝胰腺、胃和肠道消化蛋白酶在温度50℃时表现出最高的蛋白水解活性(见图2),略低于沈文英等对肝脏(50~65℃)、肠道(55~65℃)、胃(60℃)蛋白酶的最适温度的研究结果。本文对三种消化腺在pH值8.5、30℃时蛋白酶活力分布进行探究,对比三种消化腺中蛋白酶活力发现(见图3),肝胰腺>胃>肠道,且差异性显著(P<0.05)。刘玉梅等对中国对虾不同消化腺在碱性条件下蛋白酶酶活进行检测,得到类似的结果。说明凡纳滨对虾三种消化腺中均含有消化性蛋白酶,肝胰腺中含量最多,其次是胃,肠道中含量最少。
肝胰腺、胃和肠道是对虾最重要的消化器官,胃主要体现在胃磨和腺滤器中,起机械研磨的作用,肝胰腺是消化酶分泌的主要场所,肠道主要用于营养物质的消化吸收和残留物的处理。不同消化器官之间并不是完全隔离,相互封闭的,而是通过各个消化器官之间的协同作用共同完成对营养物质的消化吸收。蛋白酶抑制剂可以与蛋白酶的中心的活性基团特异性结合,降低或抑制某种蛋白酶活性的表达,降低其活性,通过检测蛋白酶的剩余活力评价特异性蛋白酶的抑制效果。不同特异性蛋白酶抑制剂对凡纳滨对虾肝胰腺、胃和肠道中消化性蛋白酶表现出相似的抑制规律(见图3),丝氨酸蛋白酶抑制剂PMSF抑制效果最强,其次为大豆胰蛋白酶抑制剂(SBTI)、胃蛋白酶抑制剂(PepstainA)和甲苯磺酰-苯丙氨酸氯甲基酮(TPCK)、金属蛋白酶抑制剂(EDTA),碘乙酰胺(IAM)抑制率最低,另外三种消化腺中均含有八种蛋白酶且有着相似的分子量(见图4),说明三种消化腺中有着相同或相似的蛋白酶。结合各特异性蛋白酶抑制剂所对应的靶蛋白酶得到,三种消化腺中碱性蛋白酶以丝氨酸蛋白酶含量最多,其次为天门冬氨酸类蛋白酶、凝乳蛋白酶和金属蛋白酶,不含半胱氨酸类蛋白酶。
酶谱分析是目前常用的一种蛋白酶分析分离方法,通过蛋白质或多肽在电场中的迁移率不同反映酶蛋白的大小构形以及肽链氨基酸的序列变化。为进一步了解凡纳滨对虾碱性蛋白酶的酶学特性,本文分别对三种消化腺的碱性蛋白酶进行酶谱分析,肝胰腺、胃和肠道碱性蛋白酶粗提液中均至少有八条蛋白水解带(见图4),说明三种粗酶液中均至少有八种分子量不同的碱性蛋白酶。分子量最大的蛋白酶(~48.4 kDa)对六种特异性蛋白酶抑制剂均无敏感性,说明该蛋白酶不是六种蛋白酶抑制剂的靶蛋白酶,或是六种蛋白酶抑制剂对该蛋白酶的抑制效果不在其最适浓度。Madathiparambil等发现,蛋白酶抑制剂对不同蛋白酶的抑制效果与蛋白酶抑制剂的浓度有关。因此,可以尝试这六种蛋白酶抑制剂的其他浓度或其它类型的特异性蛋白酶抑制剂对该蛋白酶作进一步分析,以确定其蛋白酶种类。除分子量~48.4 kDa的蛋白酶外,其它七种蛋白酶均对丝氨酸蛋白酶PMSF表现出不同程度的敏感性,因此凡纳滨对虾碱性蛋白酶以丝氨酸类蛋白酶为主,该研究结果与Omondi等对印度白对虾及Muhlia-Almazan等对南美白对虾的检测结果相似。三种不同消化腺的七种消化性蛋白酶中,分子量最小的两种蛋白酶(~15.4 kDa和~13.6 kDa)对丝氨酸蛋白酶抑制剂PMSF表现出部分抑制以外,还对金属蛋白酶及胃蛋白酶表现出一定的敏感性,因此,这两种蛋白酶不仅含有丝氨酸蛋白酶的活性中心,还可能含有胃蛋白酶、金属蛋白酶等多种蛋白酶的活性中心,其蛋白酶种类仍需进一步探究;肝胰腺消化性蛋白酶中有4种胰凝乳蛋白类酶(~26.9、~25.2、~21.6、~19.8 kDa),一种可能为胰蛋白类酶(~32.5 kDa);胃中碱性蛋白酶中有三种胰凝乳蛋白类酶(~25.2、~21.6、~19.8 kDa),二种可能为胰蛋白类酶(~32.5 kDa和~19.8 kDa);肠道中的五种蛋白酶均为胰凝乳蛋白类酶(~32.5,~26.9、~25.2、~21.6、~19.8 kDa)。Muhlia-Almazan 等对南美白对虾中肠提取液研究发现,中肠提取液中以丝氨酸蛋白酶为主,与本研究结果相一致,其中含有分子量约为22.0、20.7 kDa和19.4 kDa的三种胰蛋白酶和分子量为30.0 kDa和24.0 kDa的两种胰凝乳蛋白酶。对比肝胰腺、胃和肠道消化性蛋白酶中的几种胰凝乳蛋白酶中发现:肝胰腺粗酶液中的四种胰凝乳蛋白酶中均对SBTI没有敏感性,胃粗酶液中的三种胰凝乳蛋白酶中分子量为~32.5 kDa的蛋白酶被SBTI抑制,其余两种蛋白酶没有被抑制,肠道蛋白酶粗酶液中的五种胰凝乳蛋白酶对SBTI均表现出强烈的敏感性,不同消化腺中的胰凝乳蛋白酶对SBTI表现出不同的敏感性。因此,虽然在不同消化腺中具有相同或相似的分子量,甚至最适pH值和温度也相同,但并不能完全作为判断它们是同一种酶的依据,其它一些酶学性质(氨基酸序列、等电点特异性底物等)仍需进一步探究。另外,通过对不同蛋白酶种类的研究发现,三种消化腺中均含有多种消化蛋白酶,因此,在凡纳滨对虾养殖过程中除了考虑环境因素外,还需注意饵料种类的多样化,避免出现因食物种类的单一化可能导致的消化酶分泌异常和消化能力减弱等问题。

