绿原酸对高脂饲粮诱导非酒精性脂肪肝大鼠细胞凋亡相关基因表达的影响
刘云龙 宋 卓 彭冰洁 许诗豪 朱 琪 王 征(湖南农业大学生物科学技术学院,长沙410128)
绿原酸对高脂饲粮诱导非酒精性脂肪肝大鼠细胞凋亡相关基因表达的影响
刘云龙 宋 卓 彭冰洁 许诗豪 朱 琪 王 征∗
(湖南农业大学生物科学技术学院,长沙410128)
摘 要:本试验旨在研究绿原酸(CGA)对高脂饲粮所导致的非酒精性脂肪肝(NAFLD)大鼠细胞凋亡相关基因表达的影响。将40只雄性SD大鼠随机分成对照组(NC组)、高脂饲粮模型组(HFD组)、高脂饲粮+低剂量绿原酸组[20 mg/(kg·d),HFD⁃LC组]和高脂饲粮+高剂量绿原酸组[90 mg/(kg·d),HFD⁃HC组],每组10只。每天称量体重,12周后处死。取血清检测谷丙转氨酶(ALT)、总胆固醇(TC)、甘油三酯(TG)、游离脂肪酸(FFA)和高密度脂蛋白胆固醇(HDL⁃c)、低密度脂蛋白胆固醇(LDL⁃c)含量;取新鲜肝脏组织制备苏木精-伊红(HE)染色切片观察病理变化情况;称量肝脏湿重,计算肝脏指数;采用半定量逆转录PCR(RT⁃PCR)法测定肝脏组织肿瘤坏死因子-α(TNF⁃α)、肿瘤坏死因子受体-1(TNFR⁃1)、半胱氨酸天冬氨酸蛋白酶-8(caspase⁃8)、半胱氨酸天冬氨酸蛋白酶-3(caspase⁃3)、B-细胞淋巴瘤/白血病-2原癌基因(Bcl⁃2)、Bcl⁃2相关基因(Bax)、核转录因子-κB(NF⁃κB)、白细胞介素-6(IL⁃6)的mRNA表达量。结果表明:与NC组对比,HFD组大鼠最终体重(P>0.05)、肝脏湿重(P<0.01)、肝脏指数(P<0.01)、凋亡相关因子mRNA表达量均有上升。与HFD组相比,低剂量绿原酸能够降低最终体重(P>0.05)、肝脏湿重(P<0.05)、肝脏指数(P>0.05),降低凋亡相关因子mRNA表达量;高剂量绿原酸能够降低最终体重(P<0.05)、肝脏湿重(P<0.05)、肝脏指数(P>0.05),降低凋亡相关因子mRNA表达量。切片结果显示HFD组细胞出现大量脂肪空泡,大量细胞出现凋亡形态,绿原酸能够降低脂肪性空泡的数量,改善肝细胞的生理状态,并且高剂量绿原酸作用效果更加明显。由此可见,绿原酸能够缓解高脂饮食所导致的肝细胞凋亡,改善体内的脂肪代谢,对肝脏具有保护作用。
关键词:肥胖;非酒精性脂肪肝;绿原酸;细胞凋亡
非酒精性脂肪肝(NAFLD)是人在未饮酒的情况下出现了和酒精性脂肪肝一样的症状[1],主要病理特征为肝细胞的脂肪性变,脂肪空泡在肝细胞的细胞质中积累,肝细胞内甘油三酯(TG)过度堆积[2]。Grattagliano等[3]研究发现游离脂肪酸(FFA)及其代谢产物是导致脂肪肝的主要原因,特别是FFA介导的肝细胞过度脂性凋亡是NAFLD发生发展的关键。即使在不同性别和年龄的个体内,NAFLD均会出现个体的氧化应激现象[4]。氧化应激将导致机体损伤,蛋白质表达异常,同时DNA受到损伤,它不仅与糖尿病、高血压和癌症等有关,也与细胞凋亡(apoptosis)有着十分密切的联系[5-6]。Maliken等[7]的研究进一步发现氧化应激是导致细胞凋亡的重要环节。
绿原酸(chlorogenic acid,CGA),又称3-咖啡酰奎尼酸,是由1分子咖啡酸和1分子奎尼酸缩合脱水而成[8]。研究表明,绿原酸能够调节糖代谢,显著降低血浆葡萄糖峰值,明显改善小鼠糖耐量[9-10];绿原酸还能改善脂类代谢,显著降低肥胖个体血液中TG、FFA、高密度脂蛋白胆固醇(HDL⁃c)以及低密度脂蛋白胆固醇(LDL⁃c)的含量,同时也可降低肝脏中TG和FFA的含量[11-12];此外,绿原酸具有很强的抗氧化性能,还能够抑制低密度脂蛋白的氧化,从而使得组织免受氧化应激损害[13]。绿原酸具有调节糖脂代谢、抗氧化和清除自由基等生物活性。但绿原酸能否保护肝细胞由于高糖高脂饮食造成肝细胞氧化应激所导致的细胞凋亡[14-15]及所需的剂量目前还不清楚。
绿原酸广泛存在于药膳、茶饮及果蔬中[16]。有学者指出每人每天可通过食物摄入25~800 mg的绿原酸,特别喜爱喝咖啡的人每天摄入的绿原酸可达到1 g[17]。依据这一数据,本试验以绿原酸为材料,设置20和90 mg/(kg·d)灌胃量(分别等效于体重为70 kg正常人每天摄入约300和1 000 mg绿原酸[18])。本试验拟研究高脂饮食条件下,通过绿原酸干预对SD大鼠肝细胞凋亡相关基因表达的影响,探讨绿原酸在肥胖所导致的肝细胞凋亡中的作用。
1 材料与方法
1.1 试验材料
40只体重210~230 g的雄性SD大鼠,从湖南斯莱克景达实验动物有限公司购买,SPF级,合格证编号为43004700000100。
绿原酸:成都普瑞法科技开发有限公司;Trizol:美国Invirtrogen公司;逆转录试剂盒:美国Fermentas公司;PCR Mix:天根生化科技有限公司;MarkerⅢ:天根生化科技有限公司;谷丙转氨酶(ALT)检测试剂盒:南京建成生物工程研究所;总胆固醇(TC)试剂盒:深圳迈瑞生物医疗电子股份有限公司;TG试剂盒:深圳迈瑞生物医疗电子股份有限公司;FFA试剂盒:南京建成生物工程研究所;HDL⁃c标准品:深圳迈瑞生物医疗电子股份有限公司;LDL⁃c测定试剂盒:深圳迈瑞生物医疗电子股份有限公司。
饲粮:基础饲粮组成及营养水平见表1,能量密度为3 520 MJ/kg;高脂饲粮由65%基础饲粮、15%猪油、13%鸡蛋黄粉、5%全脂奶粉和2%白砂糖组成,能量密度为4 976.51 MJ/kg。本试验所使用的饲粮均由湖南斯莱克景达实验动物有限公司生产。
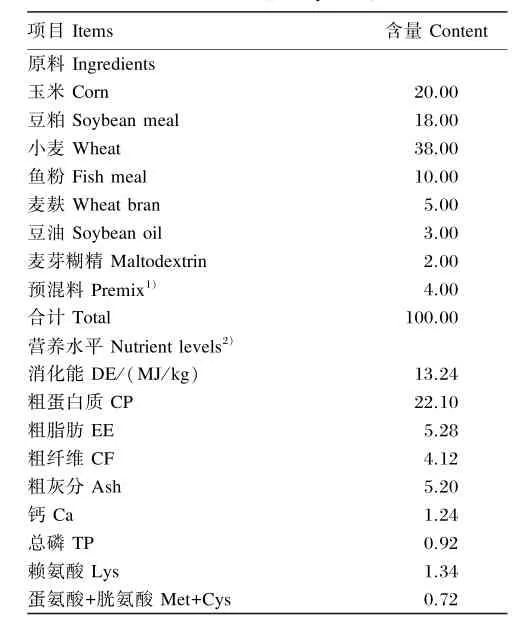
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.2 方法
1.2.1 分组和建模
经过7 d适应期喂养后,将40只雄性SD大鼠随机分成对照组(NC组,基础饲粮)、高脂饲粮模型组(HFD组)、高脂饲粮+低剂量绿原酸组(HFD⁃LC组)和高脂饲粮+高剂量绿原酸组(HFD⁃HC组),每组10只。自由饮水摄食。其中,根据个体的体重,HFD⁃LC和HFD⁃HC组分别按照绿原酸20和90 mg/(kg·d)剂量进行灌胃;NC和HFD组则每天灌胃等体积超纯水。每天09:30测定大鼠体重,12周后处死。
1.2.2 血清脂代谢指标
采用眼球取血法采血,血清经过2 h静置,2 000 r/min,离心15 min,分离血清,按照试剂盒说明书操作,检测TG、TC、LDL⁃c、HDL⁃c、FFA、ALT含量。
1.2.3 肝脏凋亡相关因子mRNA表达量
逆转录PCR(RT⁃PCR)法检测肝脏凋亡相关因子mRNA表达量。Trizol法提取肝脏组织总RNA,用微量光度计检测纯度和含量;取1 mg总RNA,按照试剂盒步骤反转成cDNA;以cDNA为模板进行PCR。采用Primer Premier 5.0设计引物,以甘油醛-3-磷酸脱氢酶(GAPDH)基因作为管家基因。RT⁃PCR反应体系:cDNA 1 μL,上、下游引物各1 μL,PCR Mix 12.5 μL,ddH2O 9.5 μL,总计25 μL。反应条件:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,扩增29个循环;最后再在72℃保持5 min。PCR扩增产物用1%琼脂糖凝胶电泳30~40 min,使用凝胶自动成像系统扫描拍照,并用Quantity One软件进行相对定量分析。
1.2.4 肝脏组织切片
取大鼠肝脏组织,用10%甲醛溶液固定24 h,常规石蜡包埋,切成3~5 μm的厚切片,脱蜡,先后用苏木精-伊红(HE)染色,脱水,透明,封片,电镜下观察肝细胞形态学变化。
1.3 数据分析
应用SPSS 17.0软件进行统计学分析,采用单因素方差分析(one⁃way ANOVA)进行统计,组间差异比较采用LSD法,所有数据均以平均值±标准误表示,P<0.05时,认为具有显著差异,P<0.01时,认为存在极显著差异。
2 结 果
2.1 绿原酸对高脂饲粮饲喂大鼠体重的影响
由表2可知,饲喂12周后,相比于HFD组,HFD⁃HC组大鼠最终体重及增重显著降低(P<0.05)。

表2 绿原酸对高脂饲粮饲喂大鼠体重的影响Table 2 Effects of CGA on BW of rats fed high⁃fat diet g
同列数据肩标∗和∗∗分别表示与NC组相比差异显著(P<0.05)和极显著(P<0.01),#和##分别表示与HFD组相比差异显著(P<0.05)和极显著(P<0.01)。下表同。
In the same column,values with∗and∗∗superscripts were significantly(P<0.05)and extremely significantly(P<0.01)different from NC group,respectively,and with#and##superscripts were significantly(P<0.05)and extremely significantly (P<0.01)different from HFD group,respectively.The same as below.
2.2 绿原酸对高脂饲粮饲喂大鼠肝脏湿重和肝脏指数的影响
由表3可见,相比于NC组,HFD组大鼠肝脏湿重和肝脏指数极显著增加(P<0.01)。相比于HFD组,HFD⁃LC和HFD⁃HC组的肝脏湿重显著降低(P<0.05)。

表3 绿原酸对高脂饲粮饲喂大鼠肝脏湿重和肝脏指数的影响Table 3 Effects of CGA on liver wet weight and hepatic index of rats fed high⁃fat diet
2.3 绿原酸对高脂饲粮饲喂大鼠血清脂代谢指标的影响
由表4可知,与NC组相比,HFD组血清HDL⁃c和FFA含量显著增加(P<0.05),血清TC 和LDL⁃c含量极显著增加(P<0.01)。与HFD组相比,HFD⁃LC组的血清TC和FFA含量显著下降(P<0.05);HFD⁃HC组血清HDL⁃c和FFA含量显著下降(P<0.05),血清TC和LDL⁃c含量极显著下降(P<0.01),血清HDL⁃c/LDL⁃c显著升高(P<0.05)。

表4 绿原酸对高脂饲粮饲喂大鼠血清脂代谢指标的影响Table 4 Effects of CGA on serum fat metabolism indexes of rats fed high⁃fat diet
2.4 绿原酸对高脂饲粮饲喂大鼠肝细胞死亡受体通路相关因子mRNA表达量的影响
由图1可知,与NC组相比,HFD组肝脏组织中肿瘤坏死因子-α(TNF⁃α)和肿瘤坏死因子受体-1(TNFR⁃1)mRNA表达量极显著升高(P<0.01),半胱氨酸天冬氨酸蛋白酶-8(caspase⁃8) mRNA表达量显著升高(P<0.05);与HFD组相比,HFD⁃LC组TNF⁃α mRNA表达量显著降低(P<0.05),TNFR⁃1和caspase⁃8 mRNA表达量差异不显著(P>0.05),HFD⁃HC组TNF⁃α和TNFR⁃1 mRNA表达量分别极显著(P<0.01)和显著降低(P<0.05),caspase⁃8 mRNA表达量差异不显著(P>0.05)。
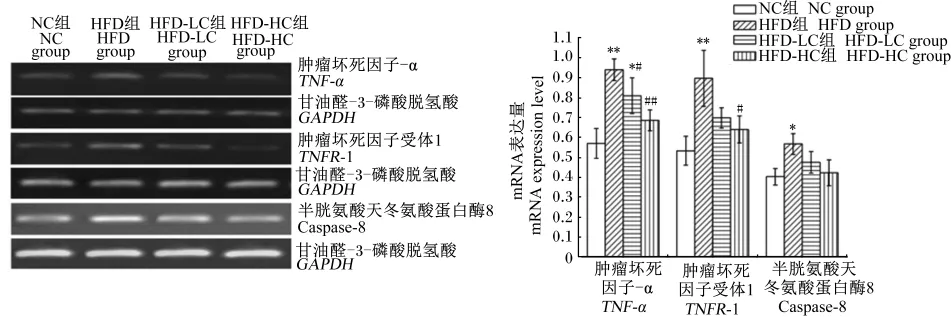
图1 绿原酸对大鼠肝脏组织TNF⁃α、TNFR⁃1和caspase⁃8 mRNA表达量的影响Fig.1 Effects of CGA on mRNA expression levels of TNF⁃α,TNFR⁃1 and caspase⁃8 in liver of rats
数据柱形标注∗和∗∗分别表示与NC组相比差异显著(P<0.05)和极显著(P<0.01),#和##分别表示与HFD组相比差异显著(P<0.05)和极显著(P<0.01)。下图同。
Data columns with∗and∗∗were significantly(P<0.05)and extremely significantly(P<0.01)different from NC group,respectively,and with#and##were significantly(P<0.05)and extremely significantly(P<0.01)different from HFD group,respectively.The same as below.
2.5 绿原酸对高脂饲粮饲喂大鼠肝细胞线粒体依赖性通路相关因子mRNA表达量的影响
由图2可知,与NC组相比,HFD组的肝脏组织中B-细胞淋巴瘤/白血病-2(Bcl⁃2)相关基因(Bax)和半胱氨酸天冬氨酸蛋白酶-3(caspase⁃3)mRNA表达量分别显著(P<0.05)和极显著升高(P<0.01),Bcl⁃2 mRNA表达量显著降低(P<0.01);与HFD组相比,HFD⁃LC组中Bax mRNA表达量显著下降(P<0.05),Bcl⁃2和caspase⁃3 mRNA表达量差异不显著(P>0.05),HFD⁃HC组中Bax和caspase⁃3 mRNA表达量显著下降(P<0.05),Bcl⁃2 mRNA表达量差异不显著(P>0.05)。

图2 绿原酸对大鼠肝脏组织Bax、Bcl⁃2和caspase⁃3 mRNA表达量的影响Fig.2 Effects of CGA on mRNA expression levels of Bax,Bcl⁃2 and caspase⁃3 in liver of rats
由图3可知,与NC组相比,HFD组的肝脏组织中Bcl⁃2和Bax mRNA表达量比值(Bcl⁃2/Bax)极显著降低(P<0.01);与HFD组相比,HFD⁃HC组肝脏组织中Bcl⁃2/Bax显著上升(P<0.05)。
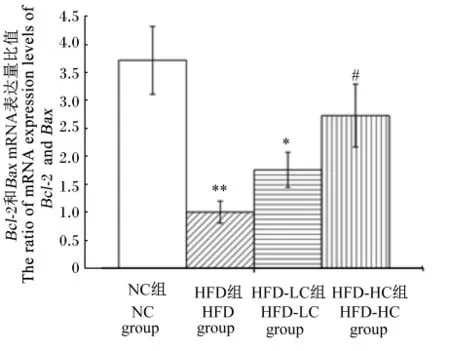
图3 绿原酸对大鼠肝脏组织Bcl⁃2和Bax mRNA表达量比值的影响Fig.3 Effects of CGA on the ratio of mRNA expression levels of Bcl⁃2 and Bax in liver of rats
2.6 绿原酸对高脂饲粮饲喂大鼠肝脏组织转录因子-κB(NF⁃κB)、白细胞介素-6(IL⁃6)mRNA表达量的影响
由图4可知,与NC组相比,HFD组的肝脏组织中NF⁃κB和IL⁃6 mRNA表达量极显著升高(P<0.01);与HFD组相比,HFD⁃LC组肝脏组织中NF⁃κB mRNA表达量显著下降(P<0.05),IL⁃6 mRNA表达量差异不显著(P>0.05),HFD⁃HC组肝脏组织中NF⁃κB和IL⁃6 mRNA表达量均极显著下降(P<0.01)。
2.7 绿原酸对高脂饲粮饲喂大鼠肝脏组织病理形态学变化的影响
由图5可知,NC组细胞呈梭形,细胞排列致密,细胞之间空隙少,细胞质分布均匀,无空泡,胞核染色明显,形态正常。与NC组相比,HFD组细胞呈圆形,胞核深染皱缩,并有核分裂现象,胞核中可见多个核仁,胞质浓缩,出现大量的脂肪性空泡,细胞出现凋亡小体等典型的凋亡形态现象。HFD⁃LC组中空泡数量、细胞核碎片数有所减少,较HFD组有所改善。HFD⁃HC组细胞形态则更接近于NC组,几乎没有大型空泡出现,细胞核结构也更加完整。

图4 绿原酸对大鼠肝脏组织NF⁃κB和IL⁃6 mRNA表达量的影响Fig.4 Effects of CGA on mRNA expression levels of NF⁃κB and IL⁃6 in liver of rats
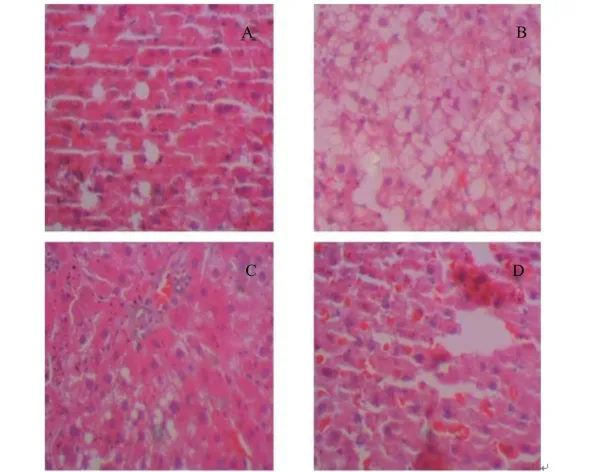
图5 绿原酸对高脂饲粮饲喂大鼠肝脏组织病理形态学变化的影响(HE染色)Fig.5 Effects of CGA on pathological changes of liver in rats fed high⁃fat diet(HE staining,400×)
3 讨 论
NAFLD是以肝细胞脂肪变性为主要特征的临床病理综合征。高脂饲粮导致氧化应激损伤,破坏膜性结构,导致线粒体膜和细胞膜的破坏,进而引起细胞凋亡[19]。肝细胞的凋亡是NAFLD发展的中间状态之一。Feldstein等[20]的研究就发现脂肪肝与肝细胞凋亡有着密切联系,肝细胞脂肪病变越严重,肝细胞凋亡的越多。本试验HFD组大鼠肝脏颜色变暗,体积偏大,质地较硬,表面颗粒感明显。HFD组大鼠肝脏湿重和肝脏指数也极显著高于NC组;从切片观察,肝细胞内部存在大量空泡,细胞体积明显大于NC组细胞,部分肝细胞细胞核碎裂。说明长期高脂饮食会导致脂肪在肝细胞的大量堆积,而绿原酸能够减少高糖高脂饮食所导致的脂肪在肝脏的堆积。
HFD组血清ALT含量升高说明肝脏损伤。TG、FFA含量提高可通过细胞色素P450 2E1表达的增强,导致脂肪酸β氧化过程中产生大量的活性氧,引起脂肪过氧化,造成氧化应激,最终导致肝细胞凋亡[21]。引起肝细胞线粒体代谢紊乱,线粒体膜流动性降低,造成线粒体受损,进而导致肝细胞凋亡[22]。本研究中,HFD组大鼠体内TNFR⁃1与其配体TNF⁃α mRNA表达量与NC组相比均有提高,凋亡相关因子caspase⁃3和caspase⁃8 mRNA表达量也有所上升。在死亡受体通路中,TNFR⁃1为死亡受体,属于肿瘤坏死因子受体超家族成员、与其相应的配体TNF⁃α结合时通过其下游的接头蛋白Fas相关死亡域蛋白(FADD)或TNFR⁃1相关的死亡结构域蛋白(TRADD)激活caspase⁃8,进而激活其下游的效应蛋白酶caspase⁃3而使细胞凋亡[23]。Hui等[24]研究证实TNF⁃α mR⁃NA参与NAFLD的发生与发展,TNF⁃α mRNA表达量上升是在NAFLD患者中普遍存在的现象。Daugherity等[25]也发现在NAFLD中,均有明显的肝细胞凋亡现象发生,并且与caspase⁃3 mRNA表达量有关。表明高脂饮食下试验大鼠肝细胞凋亡信号传导加强,在HFD⁃LC和HFD⁃HC组,通过绿原酸的干预,发现这些因子的表达量较HFD组有了下降,并且高剂量作用效果更好,绿原酸能够降低TNF⁃α mRNA表达量,减少细胞膜上TNF⁃α与TNFR⁃1的结合,减缓半胱氨酸天冬氨酸蛋白酶(caspase)所激发的“死亡级联反应”,说明绿原酸能够缓解因高脂饲粮诱导的非酒精性脂肪所导致的细胞凋亡,对肝细胞具有保护作用。
在线粒体通路中,Oltval等[26]就曾提出,抗凋亡和促凋亡基因两者的比率是决定细胞存亡的关键因素。Bcl⁃2、Bax分别是主要的抑制凋亡和促进凋亡因子,当Bax mRNA表达量高时细胞凋亡,相反,Bcl⁃2 mRNA表达量高时则细胞存活。NC组大鼠肝细胞内的Bcl⁃2/Bax较高,说明Bcl⁃2 mRNA表达量较高,细胞凋亡率较低。HFD组中Bcl⁃2/Bax显著性降低,说明HFD组肝细胞出现凋亡现象。HFD⁃LC以及HFD⁃HC组Bcl⁃2/Bax有所上升,且随绿原酸剂量的增加Bcl⁃2/Bax进一步上升,说明绿原酸对肝细胞的凋亡具有一定的保护作用。
在肝脏组织中,NF⁃κB与肝脏的炎性反应、氧化应激以及肝细胞凋亡存在十分密切的联系[27]。NF⁃κB能够被多种细胞因子所激活,不同类型的激活因子将会有不同生物学效应[28]。与NC组相比,HFD组中NF⁃κB mRNA表达量显著性上升。Arunkumar等[29]的研究发现NF⁃κB能够激活c⁃myc癌基因和死亡受体通路中FasL的受体Fas蛋白的表达,从而诱导细胞凋亡。IL⁃6在肥胖个体的脂肪组织中过度表达,它还能够诱导肝内脂肪的生成,并且具有促炎症作用,激活Kupffer细胞,导致肝脏纤维化,进而引起细胞的凋亡[30-31]。杨斌等[32]发现绿原酸能够降低TNF⁃α、IL⁃6等炎症因子mRNA表达量的结论与本试验结果一致。绿原酸干预之后,较HFD组有了下降。绿原酸可通过调控NF⁃κB的mRNA表达,对肝细胞凋亡起到调控作用。
HFD组的血清TG、TC、LDL⁃c、HDL⁃c、FFA 和ALT含量显著升高。HFD组大鼠血清TG、TC含量升高,说明体内糖脂代谢紊乱;较NC组的HDL⁃c/LDL⁃c下降,说明胆固醇从肝脏运送到全身组织受阻,从而造成TC含量增加;与NC组相比,FFA含量上升,说明体内脂肪含量增加,本试验发现经过绿原酸干预后,HDL⁃c和LDL⁃c含量均有下降,但是通过对比各组HDL⁃c/LDL⁃c,NC、HFD、HFD⁃LC和HFD⁃HC组的HDL⁃c/LDL⁃c分别为1.82、1.59、1.78、2.02,呈现上升趋势,并且HFD⁃HC与HFD组存在显著性差异,所以经过绿原酸干预后,HDL⁃c含量相对于LDL⁃c含量呈现上升趋势。这与胡健萍[33]代谢综合征小鼠模型及中药复方干预以及Huang等[12]的研究结果类似。
肝脏是新陈代谢的重要器官,在肝脏内进行着糖类代谢、脂类代谢和蛋白质代谢等。当机体摄入能量过多时,将会导致体内脂肪的堆积,造成体内脂代谢的紊乱,进而引起脂肪肝,使得机体产生氧化应激现象,最终导致肝细胞受损,诱发肝细胞凋亡。绿原酸作为一种广泛存在与植物和水果中的天然产物,能抑制高糖高脂饮食造成地脂肪在肝脏内的堆积,减少肝脏的负荷;绿原酸还具有抗氧化,防止机体内氧化应激现象发生等作用。由此可见,绿原酸对肝细胞凋亡具有调控作用。
4 结 论
本试验研究发现一定剂量的绿原酸能够减轻体重,减少肥胖发生率,缓解高脂饮食所导致的NAFLD症状,缓解肝细胞凋亡,对肝细胞具有一定的保护作用。
参考文献:
[1] LUDWIG J,VIGGIANO T R,MCGILL D B,et al.Nonalcoholic steatohepatitis:Mayo clinic experiences with a hitherto unnamed disease[C]//Mayo Clinic Proceedings.1980,55(7):434-438.
[2] PETTA S,MURATORE C,CRAXÌ A.Non⁃alcoholic fatty liver disease pathogenesis:the present and the fu⁃ture[J].Digestive and Liver Disease,2009,41(9):615-625.
[3] GRATTAGLIANO I,DE BARI O,BERNARDO T C,et al.Role of mitochondria in nonalcoholic fatty liv⁃er disease⁃from origin to propagation[J].Clinical Bio⁃chemistry,2012,45(9):610-618.
[4] NARASIMHAN S,GOKULAKRISHNAN K,SAM⁃PATHKUMAR R,et al.Oxidative stress is independ⁃ently associated with non⁃alcoholic fatty liver disease (NAFLD)in subjects with and without type 2 diabe⁃tes[J].Clinical Biochemistry,2010,43(10/11):815-821.
[5] BECK M A.Selenium and host defence towards viru⁃ses[J].Proceedings of the Nutrition Society,1999,58 (3):707-711.
[6] OZAKI M,DESHPANDE S S,ANGKEOW P,et al.Inhibition of the Rac1 GTPase protects against nonle⁃thal ischemia/reperfusion⁃induced necrosis and apop⁃tosis in vivo[J].The FASEB Journal,2000,14(2):418-429.
[7] MALIKEN B D,NELSON J E,KLINTWORTH H M,et al.Hepatic reticuloendothelial system cell iron deposition is associated with increased apoptosis in nonalcoholic fatty liver disease[J].Hepatology,2013,57(5):1806-1813.
[8] CHO A S,JEON S M,KIM M J,et al.Chlorogenic acid exhibits anti⁃obesity property and improves lipid metabolism in high⁃fat diet⁃induced⁃obese mice[J].Food and Chemical Toxicology,2010,48(3):937-943.
[9] BASSOLI B K,CASSOLLA P,BORBA⁃MURAD G R,et al.Chlorogenic acid reduces the plasma glucose peak in the oral glucose tolerance test:effects on he⁃patic glucose release and glycaemia[J].Cell Biochem⁃istry and Function,2008,26(3):320-328.
[10] 梁秀慈,孟文,钟英丽,等.绿原酸对高脂乳诱导小鼠胰岛素抵抗形成的影响[J].中国药理学通报,2013,29(5):654-658.
[11] LI S Y,CHANG C Q,MA F Y,et al.Modulating effects of chlorogenic acid on lipids and glucose me⁃tabolism and expression of hepatic peroxisome prolif⁃erator⁃activated receptor⁃α in golden hamsters fed on high fat diet[J].Biomedical and Environmental Sci⁃ences,2009,22(2):122-129.
[12] HUANG K,LIANG X C,ZHONG Y L,et al.5⁃Caf⁃feoylquinic acid decreases diet⁃induced obesity in rats by modulating PPARα and LXRα transcription[J].Journal of the Science of Food and Agriculture,2015, 95(9):1903-1910.
[13] SATO Y,ITAGAKI S,KUROKAWA T,et al.In vitro and in vivo antioxidant properties of chlorogenic acid and caffeic acid[J].International Journal of Pharma⁃ceutics,2011,403(1/2):136-138.
[14] MUBARAK A,HODGSON J M,CONSIDINE M J,et al.Supplementation of a high⁃fat diet with chloro⁃genic acid is associated with insulin resistance and he⁃patic lipid accumulation in mice[J].Journal of Agri⁃cultural and Food Chemistry,2013,61(18):4371-4378.
[15] BONITA J S,MANDARANO M,SHUTA D,et al.Coffee and cardiovascular disease:in vitro,cellular,animal,and human studies[J].Pharmacological Re⁃search,2007,55(3):187-198.
[16] WANG Z,CLIFFORD M N.Comparison of the pro⁃files of chlorogenic acids and their derivatives from three Chinese traditional herbs by LC⁃MSn[J].Acta Pharmaceutica Sinica,2008,43(2):185-190.
[17] CLIFFORD M N.Chlorogenic acids and other cin⁃namates:nature,occurrence and dietary burden[J].Journal of the Science of Food and Agriculture,1999,79(3):362-372.
[18] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[19] KASS G E N.Mitochondrial involvement in drug⁃in⁃duced hepatic injury[J].Chemico⁃Biological Interac⁃tions,2006,163(1/2):145-159.
[20] FELDSTEIN A E,CANBAY A,GUICCIARDI M E,et al.Diet associated hepatic steatosis sensitizes to Fas mediated liver injury in mice[J].Journal of Hepatolo⁃gy,2003,39(6):978-983.
[21] 梅玫,陆伟.细胞色素P450 2E1在脂肪性肝病中致病作用研究进展[J].实用肝脏病杂志,2007,10 (1):61-64.
[22] LI Z Z,BERK M,MCINTYRE T M,et al.The lysoso⁃mal⁃mitochondrial axis in free fatty acid⁃induced he⁃patic lipotoxicity[J].Hepatology,2008,47(5):1495-1503.
[23] ZHANG W,KUDO H,KAWAI K,et al.Tumor nec⁃rosis factor⁃α accelerates apoptosis of steatotic hepato⁃cytes from a murine model of non⁃alcoholic fatty liver disease[J].Biochemical and Biophysical Research Communications,2010,391(4):1731-1736.
[24] HUI J M,HODGE A,FARRELL G C,et al.Beyond insulin resistance in NASH:TNF⁃α or adiponectin?[J].Hepatology,2004,40(1):46-54.
[25] DAUGHERITY E K,BALMUS G,AL SAEI A,et al.The DNA damage checkpoint protein ATM promotes hepatocellular apoptosis and fibrosis in a mouse model of non⁃alcoholic fatty liver disease[J].Cell Cycle,2012,11(10):1918-1928.
[26] OLTVAL Z N,MILLIMAN C L,KORSMEYER S J.Bcl⁃2 heterodimerizes in vivo with a conserved homo⁃log,Bax,that accelerates programed cell death[J].Cell,1993,74(4):609-619.
[27] RIBEIRO P S,CORTEZ⁃PINTO H,SOLÁ S,et al.Hepatocyte apoptosis,expression of death receptors,and activation of NF⁃κB in the liver of nonalcoholic and alcoholic steatohepatitis patients[J].The Ameri⁃can Journal of Gastroenterology,2004,99(9):1708-1717.
[28] ELSHARKAWY A M,MANN D A.Nuclear factor⁃κB and the hepatic inflammation⁃fibrosis⁃cancer axis [J].Hepatology,2007,46(2):590-597.
[29] ARUNKUMAR N,LIU C H,HANG H Y,et al.Toll⁃ like receptor agonists induce apoptosis in mouse B⁃cell lymphoma cells by altering NF⁃κB activation[J].Cel⁃lular&Molecular Immunology,2013,10(4):360-372.
[30] QURESHI K,ABRAMS G A.Metabolic liver disease of obesity and role of adipose tissue in the pathogene⁃sis of nonalcoholic fatty liver disease[J].World Jour⁃nal of Gastroenterology,2007,13(26):3540-3553.
[31] HONG F,KIM W H,TIAN Z G,et al.Elevated inter⁃leukin⁃6 during ethanol consumption acts as a potential endogenous protective cytokine against ethanol⁃in⁃duced apoptosis in the liver:involvement of induction of Bcl⁃2 and Bcl⁃xL proteins[J].Oncogene,2002,21 (1):32-43.
[32] 杨斌,丘岳,王柳萍,等.广西山银花绿原酸体外抗炎作用及分子机制研究[J].中国药理学通报,2009,25(4):542-545.
[33] 胡健萍.代谢综合征小鼠模型的建立及中药复方干预[D].硕士学位论文.北京:北京协和医学院,2009.
Effects of Chlorogenic Acid on Apoptosis⁃Related Gene Expressions in Rats with Non⁃Alcoholic Fatty Liver Disease Caused by High⁃Fat Diet
LIU Yunlong SONG Zhuo PENG Bingjie XU Shihao ZHU Qi WANG Zheng
∗
(责任编辑 王智航)
(College of Bioscience&Biotechnology,Hunan Agriculture University,Changsha 410128,China)
Abstract:To investigate the effects of chlorogenic acid(CGA)on the expressions of apoptosis⁃related genes in rats with nonalcoholic fatty liver disease(NAFLD)caused by high⁃fat diet.Forty male SD rats were ran⁃domly divided into 5 groups:control group(NC group),high⁃fat diet model group(HFD group),high⁃fat diet+low dose CGA group[(20 mg/(kg·d),HFD⁃LC group],and high⁃fat diet+high dose CGA group[(90 mg/(kg·d),HFD⁃HC group].Each group had 10 rats.All rats were weighed everyday and were kill⁃ed after 12 weeks.Serum contents of alanine transarninase(ALT),total cholesterol(TC),triglyceride (TG),free fatty acid(FFA),high⁃density lipoprotein cholesterol(HDL⁃c)and low⁃density lipoprotein cho⁃lesterol(LDL⁃c)were detected;histological changes of the liver were examined by hematoxylin and eosin staining;liver wet weight and hepatic index were weighed;the mRNA expression levels of tumor necrosis fac⁃tor⁃α(TNF⁃α),tumor necrosis factor receptor⁃1(TNFR⁃1),caspase⁃8,caspase⁃3,B cell lymphoma/leuke⁃mia⁃2(Bcl⁃2),Bcl⁃2 related gene(Bax),nuclear factor⁃κB(NF⁃κB),and interleukin 6(IL⁃6)were as⁃sessed by semi⁃quantification RT⁃PCR.The results showed as follows:compared with NC group,final body weight(P>0.05),liver wet weight(P<0.01),hepatic index(P<0.01),and the mRNA expression levels of apoptosis⁃related genes were much higher in HFD group.Compared with HFD group,final body weight(P>0.05),liver wet weight(P<0.05),hepatic index(P>0.05),and the mRNA expression levels of apoptosis⁃related genes were reduced after the treatment of low dose CGA;and high dose of CGA could induce more on those indices[final body weight(P<0.05),liver wet weight(P<0.05),hepatic index(P>0.05)]than low dose CGA could do.The histological study revealed that there were a lot of fatty vacuoles,a large number of cells with apoptotic morphology.CGA dose dependently reduced the quantity of fatty vacuoles,and improve the physiological state of hepatic cells.It is concluded that CGA can reduce the chance of hepatic apoptosis caused by high⁃fat diet,improve fat metabolism,and has protection effects on rat liver.[Chinese Journal of Animal Nutrition,2015,27(7):2140⁃2149]
Key words:obesity;non⁃alcoholic fatty liver disease;chlorogenic acid;apoptosis
Corresponding author∗,professor,E⁃mail:wz8918@163.com
通信作者:∗王 征,教授,博士生导师,E⁃mail:wz8918@163.com
作者简介:刘云龙(1988—),男,湖南衡阳人,硕士研究生,从事天然产物利用及营养与药理研究。E⁃mail:liuyunlong0527@126.com
基金项目:国家自然科学基金项目(31071531);湖南省教育厅重点项目(14A071)
收稿日期:2015-01-22
doi:10.3969/j.issn.1006⁃267x.2015.07.019
文章编号:1006⁃267X(2015)07⁃2140⁃10
文献标识码:A
中图分类号:S852.2

