AIB1在结直肠癌中的表达特征及其临床意义*
张猛 单宏鹏 陈锋 唐卫中
(广西医科大学第一附属医院 广西南宁 530021)
在正常和癌变的结直肠黏膜上皮组织中ERβ是主要表达的雌激素受体,而ERα则是极少表达或不表达[1、2]。在结直肠组织癌变过程中 ERβ 选择性表达缺失与结直肠癌分化的恶性程度有相关性,因此ERβ可能在大肠癌变过程中起抑癌的保护性作用[3]。许多共调节因子蛋白的表达水平或活性的改变会导致ER信号分子的改变[4、5]。特别是共激活因子的过表达和下调共抑制因子可使内分泌治疗的抑制作用无效,尤其是在应用选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs)例如他莫昔芬(tamoxifen)[6]。因此进一步开展雌激素受体共调节因子在结直肠中的作用的研究对CRC的激素替代治疗和针对ERβ分子的靶向治疗显得至关重要。本实验主要研究雌激素受体共激活因子其中之一AIB1在结直肠癌中的表达以及与临床资料间的关系。
1 材料与方法
1.1 材料 收集广西医科大学第一附属医院2014年03月至2014年11月行结直肠癌切除术的结直肠癌及其配对正常组织标本200例,其中男性119例,女性89例,平均年龄55.6岁。纳入标准:所有术后病理确诊为结直肠癌的病例。排除标准:无足够的标本量,无详细临床资料记录,患有两个及其以上的原发性癌症、患者术前进行抗癌治疗尤其是雌激素替代治疗的病例排除。配对正常组织术后病理证实为正常大肠组织。患者临床资料包括:年龄、性别、民族、肿瘤位置、肿瘤大小、大体病理类型、分化程度、病理分期、有无神经官侵犯、有无血管侵犯、TNM分期。本实验所用标本采集均经过患者本人知情同意且经过广西医科大学伦理委员会批准。本实验所有过程依照赫尔辛基宣言(Helsinki Declaration)进行。120例预备进行免疫组织化学检测的标本按照标准浸泡入10%的福尔马林溶液中。80例预备进行荧光定量PCR的新鲜组织放入液氮中速冻15 min后小心移入-80°C超低温冰箱中暂时储存。
1.2 方法
1.2.1 总RNA的制备和逆转录PCR 根据使用说明书从80例新鲜组织中提取总RNA(total RNA)应用总RNA提取试剂盒 (Cat#12113KD1,AXYGEN,苏州,中国)。随即,应用NANODROP2000型核酸检测仪(Thermo Scientific, CA, USA)通过 A260/A280比值计算total RNA的纯度。根据使用说明书应用逆转录试剂盒 (Roche Diagnostics,Mannhelm,德国)将total RNA逆转录为cDNA(Complementary DNA)。20μL逆转录体系在 ABI GeneAmp PCR System 9700 PCR 仪(Applied Biosystems, 新加坡)的反 应 条 件 如 下 :65°C 10 min、4°C 3 min、25°C 10 min、55°C 30 min、85°C 5 min。 将 cDNA 置于-20°C暂时储存。
1.2.2 荧光定量PCR(RT-qPCR) 根据使用说明应用 Fast Start Universal SYBR Green Master(ROX)(Roche Diagnostics,Mannhelm,德国)进行荧光定量 PCR(RT-qPCR),在 ABI Step-one PlusTM Realtime PCR System型荧光定量 PCR仪 (Applied Biosystems, 新加坡)的反应条件如下:95°C 10 min、95°C 15s、60°C 1 min 40 个循环。荧光定量 PCR 的内参为beta-actin以及阴性反应为排除cDNA的PCR反应。靶基因的引物序列为:AIB15’-GGTGCAGCTGAAAGTAAACAGAATG-3’ (forward) 和5’ -TCGTTTATTAACAGTGTGCCTTGGA-3’ (reverse),beta-actin 5’-TGGCACCCAGCACAATGAA-3’ (forward) 和 5’ -CTAAGTCATAGTCCGCCTAGAAGCA-3’ (reverse),所有引物均合成于Takara大连公司。应用等比例稀释法做标准曲线。每一个样本均重复三次来增加结果的准确性。靶基因的表达量的确定是参照内参表达量应用2-ΔCt公式计算。最后根据ROC曲线的CUTOFF值将靶基因mRNA表达量分为两组:低表达组,高表达组。
1.2.3 免疫组化(IHC) 将80对应用于免疫组化的癌和正常配对组织从福尔马林中拿出后进行脱水、石蜡包埋、切片(4微米厚),然后在按比例稀释的酒精中依次脱蜡,后在柠檬酸修复液(pH=6.0)中高压修复抗原。然后应用免疫组化三步法试剂盒(ZSGB-bio,北京,中国)进行一下实验步骤:3%H2O2室温孵育 10~15 min以消除内源性过氧化物酶活性、1%山羊血清室温孵育15~20 min封闭抗原、一抗(AIB1抗兔多克隆抗体、1:1600, bs-2919R,Bioss,北京,中国)4°C 孵育过夜、抗鼠 /兔二抗 37°C 孵育 15~20 min、辣根酶标记链霉卵白素37°C孵育15~20 min。随即进行DAB染色(ZLI-9017,ZSGB-bio,北京,中国),苏木素复染50s。整个实验中,人类乳腺癌作为阳性标准。一抗稀释液代替一抗蛋白孵育作为阴性对照。
1.2.4 免疫组化结果判断 在单盲情况下每张切片均由两位病理医生独立判片。细胞质和/或细胞核呈棕黄色颗粒样物质判读为阳性表达。着色评分是根据着色深度分为三级:0分无着色、1分为淡黄色或着色模糊、2分为棕黄色、3分为深棕色。在6个不同400倍视野下分别计算总细胞数和阳性细胞数求得阳性率,然后乘以该视野的着色评分,最后求6六个视野平均值为靶蛋白在该切片上的阳性表达 (0~300)以备后续统计分析。根据阳性表达的ROC曲线的cutoff值来确定阴阳性率,高于cutoff值为阳性,反之为阴性。
1.3 统计学分析 所有的统计学分析均完成于SPSS 16.0 software (SPSS, Chicago, IL, 美国)。癌和配对正常组织组间靶基因/蛋白的差异表达用Student’s t test统计。靶基因的mRNA和蛋白水平表达与病例临床资料之间关系用卡方检验或Fisher确切概率法统计。所有统计P值小于0.05的情况下认为有统计学意义。
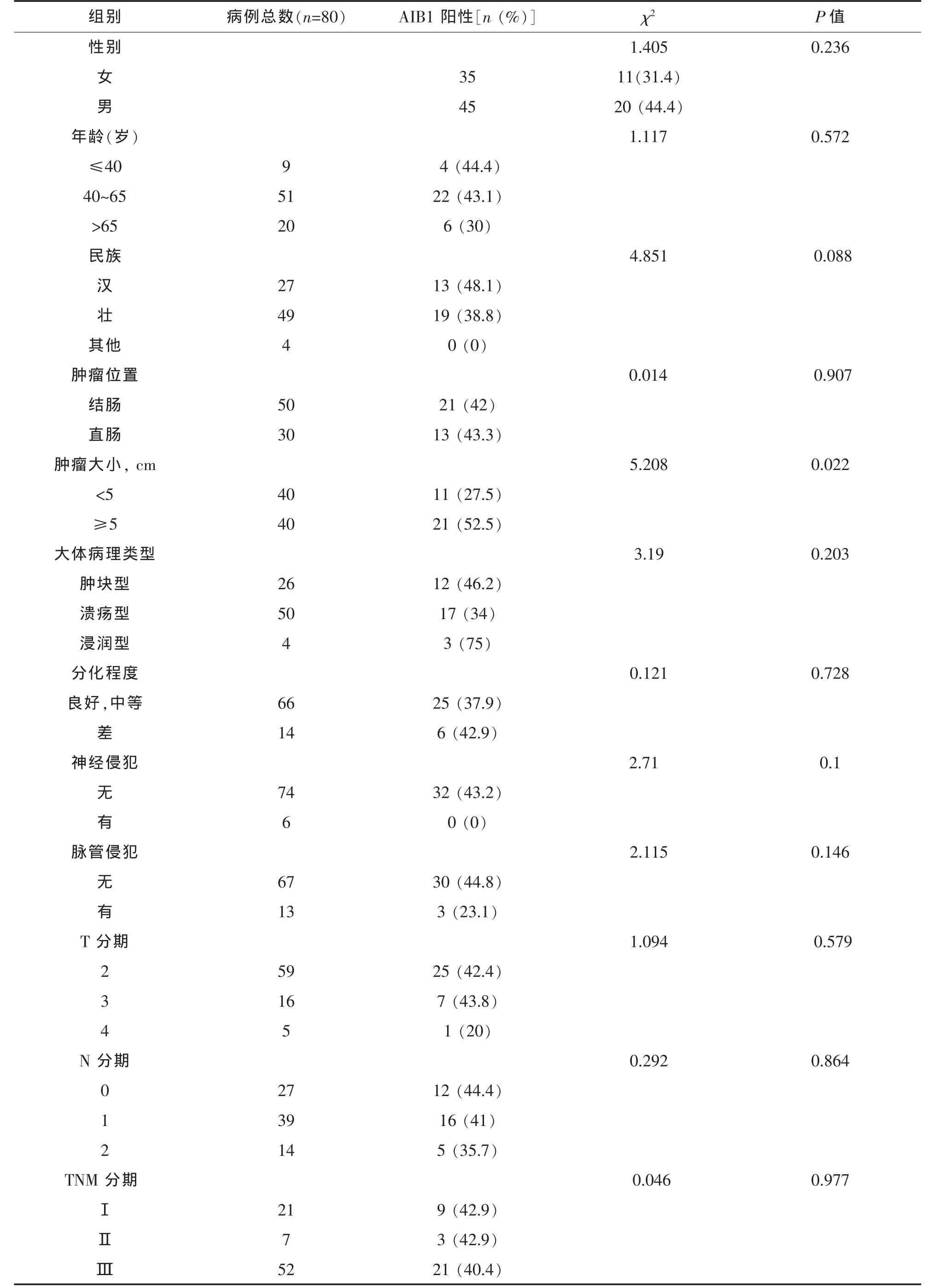
表1 AIB1mRNA的表达量与临床、病例指标之间的关系
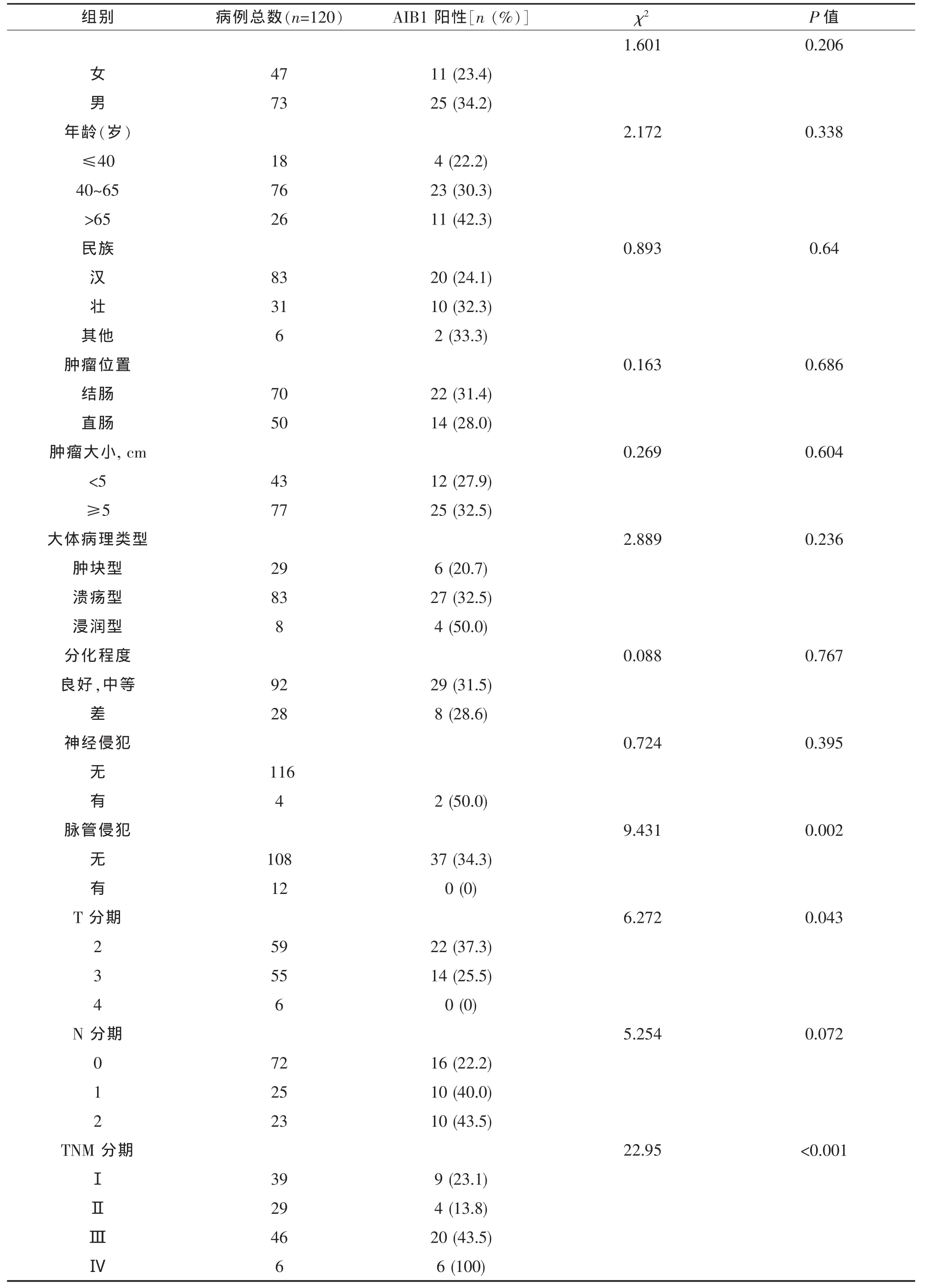
表2 AIB1蛋白表达量与临床、病例指标之间的关系
2结 果
2.1 AIB1 在结直肠癌中的表达 荧光定量PCR确定了AIB1在80例CRC组织和配对正常黏膜上皮组织中的mRNA水平表达。与正常组织相比,AIB1在CRC中表达显著降低且有统计学意义(P<0.001)见图1。根据120对结直肠癌病例的免疫组化
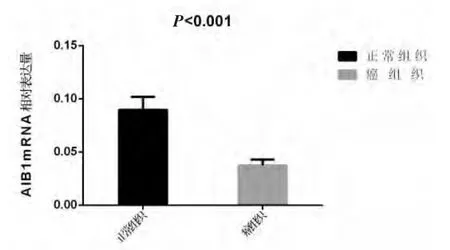
图1 AIB1在结直肠癌组织和配对正常组织中mRNA的相对表达量,柱状图表示的是均数±标准误,相对表达量的参照标准是 β-ACTIN,Student's,检验结果是 t=3.938,P <0.001
结果最终确定了AIB1的蛋白水平表达。免疫组化结果显示在癌和正常组织中AIB1在细胞质和细胞核中均有着色且主要着色于细胞质。此外,阳性表达统计结果与RT-qPCR结果一致。AIB1在癌和正常组织中表达差异有统计学意义(χ2=20.741, P <0.001),其阳性率分别为29.2% 和58.3%,见图2。
2.2 AIB1在CRC中的诊断价值 在检测癌组织中AIB1在mRNA水平和蛋白水平上表达的同时,我们做了ROC曲线判断AIB1在结直肠癌中的诊断价值。结果我们发现AIB1在CRC发生发展过程中有诊 断预测价 值 , 其 AUC 值 为 0.709 (CI:0.620~0.798, P <0.001),cutoff值为 0.379,见图 3。
2.3 AIB1与 CRC临床资料的关系 根据 RT-qPCR的结果,以下结论为AIB1mRNA表达与临床资料的关系。AIB1的相对表达量仅与肿瘤的大小有关(χ2=5.208, P=0.022),与其他的临床资料关系均无统计学意义(P >0.05)。 同时,根据 Spearman相关分析发现两者存在正相关(r=0.255, P=0.022),即
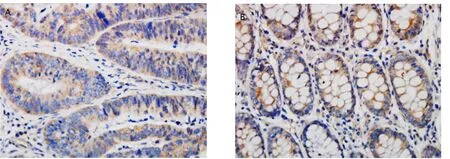
图 2 A在癌组织中的中AIB1主要着色于癌细胞,炎症细胞,平滑肌细胞的细胞质(×400)。B在正常组织中AIB1的主要着色于黏膜上皮细胞、肠腺细胞、炎症细胞、平滑肌细胞(×400)。
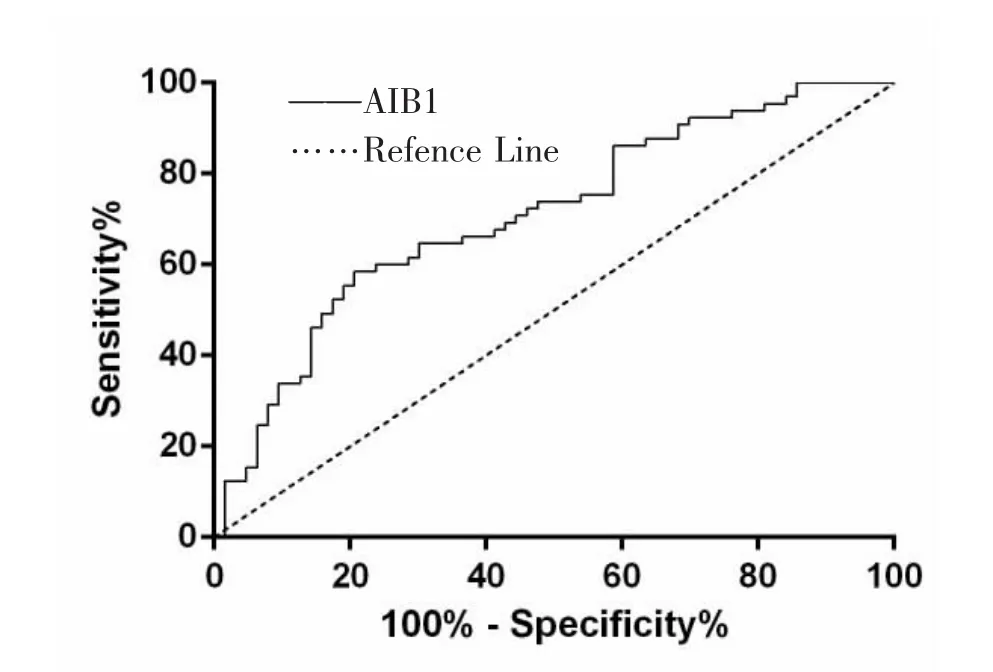
图3 ROC曲线来评价AIB1在结直肠癌中的诊断预测 价 值 ,AIB1 的 AUC 值 是 0.709 (CI:0.620~0.798, P <0.001)。
肿瘤越大AIB1的表达量越高见表1。根据免疫组化的结果我们同样得出蛋白水平的表达量与临床资料的关系。我们发现与无脉管侵犯相比,CRC存在脉管侵犯时 AIB1 表达下降(χ2=9.431, P=0,002),且两者的负相关关系有统计学意义(r=0.223,P=0.015)。同时我们发现AIB1的表达也与T分期有关(χ2=6.272, P=0.043),但两者的线性关系无统计学意义 (r=-0.178, P=0.052)。 与之相反的是AIB1与TNM分期存在正相关关系,即癌症分期越晚 AIB1 表达越高 (χ2=622.95, P <0.001, r=0.31,P=0.001),见表 2。
3讨 论
共激活因子SRC家族是雌激素受体转录共激活因子P160超家族的成员。SRC包括核受体在内的许多转录因子。该家族的成员有共同的结构和功能,同时可能在调控ER活性上有重要作用[7]。在ER依赖的基因转录中SRC共激活因子在细胞中过表达可增强SERMs兴奋活性。当配体高表达时,该家族成员蛋白可明显增加激素诱导的转录且此过程由核受 体 介 导 包 括 ER、PR (progesterone receptor)、TR(thyroid receptor)、GR(glucocorticoid receptor)、RAR(retinoic acid receptor)。
AIB1(amplification in breast cancer1)是 SRC 家族中第三位成员也被称为 SRC-3、PAC3、ACTR、NCoA3,该因子是在乳腺癌中首先被发现。AIB1基因位于染色体20q12,AIB1的活性影响增值过程。在乳腺癌肿瘤细胞中AIB1基因大量扩增和高表达。在其他器官恶性肿瘤中比如卵巢、子宫内膜、胃、肝脏和前列腺中也存在AIB1高表达或扩增的现象。
流行病学、病理学、分子生物学均证实雌激素受体(ER)尤其是ERβ在结直肠组织癌变过程中起抑癌的保护性作用[2、3、8]。 经典雌激素受体一配体依赖性信号转导通路认为,雌激素受体ER和雌激素结合形成激素-受体复合物后随即发生构型的改变活化自身形成二聚体并具有转录因子的功能,之后募集一些共调节因子与雌激素受体反应元件ERE结合形成转录起始复合物。因此AIB1作为雌激素受体转录共激活因子,在结直肠癌中应该具有和ERβ相似的生物学效应,即抑癌的保护性作用。
本实验结果显示无论是mRNA水平还是蛋白水平AIB1在结直肠癌中表达降低。因此,AIB1可能参与结直肠癌的发生发展过程中并在其中起抑制作用,然而这一推论却与先前文献实验结果并不一致。用免疫组化检测110名CRC患者的AIB1的表达发现与正常黏膜相比,AIB1在癌组织中的表达量显著升高[9]。同时发现从正常黏膜组织到腺瘤最后到腺癌这一过程AIB1蛋白表达逐渐升高[10]。从以往的研究可以推测出AIB1在CRC发展过程中起一个促进因子的作用。然而这些研究仅限于蛋白水平的检测,本实验在更多病例数中对同一靶基因同时检测了mRNA和蛋白水平的表达,且两者是一致的结果。关于AIB1在结直肠癌进展过程中的具体作用和通路仍需要更多的实验来证实。
免疫组化中AIB1着色部位的变化反映了特定组织类型对类固醇激素的不同反应。AIB1是核受体的调节因子主要着色部位为细胞核。在乳腺癌中AIB1阳性反应位于细胞核[11]。然而,在甲状腺乳头状癌组织中,AIB1在细胞质和细胞核均有着色[12]。本实验中,AIB1在CRC组织中胞质和胞核均有着色,且主要在胞质中。但是AIB1在结直肠癌中的阳性反应部位仍有争论。Petros D等[9]发现在结直肠癌组织中的中AIB1主要着色于黏膜上皮细胞,内皮细胞,炎症细胞,平滑肌细胞的细胞核。Vassiliki Tzelepi等[10]也得出了类似结论。着色部位在某些程度上也同时受到一抗影响,例如,Nicole N Balmer等[13]发现在免疫组化中用两种不同克隆体系的AIB1得到不同的AIB1蛋白表达类型,将AIB1(BD)一抗应用于子宫内膜癌得到核表达,AIB1(SC)一抗得到胞质阳性。因此不同克隆体系的一抗可能产生不一致的阳性反应。本实验发现的阳性反应主要在胞浆说明与传统的乳腺癌中参与细胞核受体转录调节不同,AIB1在结直肠癌细胞中可能更多地参与细胞质中的信号传导。这至少部分证明了AIB1在不同癌症尤其是乳腺癌和结直肠癌中发挥不同生物学效应。
从以上AIB1在癌与正常组织中的表达类型可以推测出AIB1在CRC发生发展过程中起抑癌作用,分析AIB1与临床资料之间的关系也部分印证了该假设。结直肠癌出现脉管侵犯时AIB1蛋白表达降低,这说明AIB1表达的减少可能使得癌细胞的侵袭力增大。AIB1与T分期的关系也印证了这一点,虽然AIB1与T分期无直接的负性线性关系,但是从阳性率上依然可以看到T2期AIB1蛋白表达最高(37.3%),T4期AIB1阳性率最低(0%)。 T分期反应的是肿瘤侵袭的范围和深度,直接影响到治疗方式和预后情况,AIB1与T分期的关系这说明AIB1表达量可能影响到肿瘤的进展,并起一定的抑制作用。但是在此过程中出现一些不一致的结论,同样在蛋白水平AIB1的表达量与TNM分期程正相关,即临床分期越晚AIB1的表达量越高,这与之前截然相反的结论说明AIB1在结直肠癌中参与的通路非常复杂,而所表现出来的生物学效应也不是简单的单一模式。AIB1在CRC中可能同时参与促癌和抑癌两种通路,在不同个体结直肠癌进展过程中由不同因子激活这两种通路。这一假设也在其他研究中得到佐证。一项对85名结直肠癌患者的研究发现,较晚的临床分期更易出现AIB1的过表达,这表明AIB1的过表达可能在CRC发生发展过程中有选择性促进作用[14]。AIB1可抑制CRC细胞系的细胞周期使其处于G1期,从而抑制其增殖[15]。在mRNA水平上我们发现AIB1仅与肿瘤大小呈正相关,AIB1在mRNA水平和蛋白水平不一致的结果说明AIB1靶基因可能参与在转录翻译过程中尤其是转录后调节通路。但是从总体看mRNA和蛋白表达均在癌中降低,说明转录后调节过程对最终起生物学效应的蛋白质影响不大。
通过本实验的结果我们认为AIB1可能参与结直肠癌的发生发展过程,并在这一过程中起一定的抑癌的保护作用,但是这一过程非常复杂。在结直肠癌变过程中,AIB1可能重新参加了新的分子通路,使得其在细胞质中的表达增高,这些分子通路的综合生物学效应可能促进亦可能抑制癌症的进展。证明AIB1在CRC中的具体作用机制需要更多更深入的研究。
[1] Elbanna HG, Ebrahim MA, Abbas AM, et al.Potential value of estrogen receptor beta expression in colorectal carcinoma: interaction with apoptotic index [J].J Gastrointest Cancer, 2012, 43: 56-62.
[2] Rudolph A, Toth C, Hoffmeister M, et al.Expression of oestrogen receptor beta and prognosis of colorectal cancer[J].Br JCancer, 2012, 107: 831-839.
[3] Barzi A, Lenz AM, Labonte MJ, et al.Molecular pathways: Estrogen pathway in colorectal cancer[J].Clin Cancer Res, 2013, 19: 5842-5848.
[4] Chodankar R, Wu DY, Gerke DS, et al.Selective coregulator function and restriction of steroid receptor chromatin occupancy by hic-5 [J].Mol Endocrinol, 2015,29: 716-729.
[5] Cortez V, Samayoa C, Zamora A, et al.PELP1 overexpression in the mouse mammary gland results in the development of hyperplasia and carcinoma [J].Cancer Res,2014, 74: 7395-7405.
[6] Feng Q, O'Malley BW.Nuclear receptor modulation--role of coregulators in selective estrogen receptor modulator(SERM) actions [J].Steroids, 2014, 90: 39-43.
[7] Stashi E, York B, O'Malley BW.Steroid receptor coactivators: servants and masters for control of systems metabolism [J].Trends Endocrinol Metab, 2014, 25:337-347.
[8] Tu Z, Ma Y, Tian J, et al.Estrogen receptor beta potentiates the antiproliferative effect of raloxifene and affects the cell migration and invasion in HCT-116 colon cancer cells [J].J Cancer Res Clin Oncol, 2012, 138: 1091-1103.
[9] Grivas PD,Tzelepi V,Sotiropoulou-Bonikou G,et al.E-strogen receptor alpha/beta, AIB1, and TIF2 in colorectal carcinogenesis:do coregulators have prognostic significance[J].Int JColorectal Dis, 2009, 24: 613-622.
[10] Tzelepi V, Grivas P, Kefalopoulou Z, et al.Estrogen signaling in colorectal carcinoma microenvironment:expression of ERbeta1, AIB-1, and TIF-2 is upregulated in cancer-associated myofibroblasts and correlates with disease progression [J].Virchows Arch, 2009, 454: 389-399.
[11] Weiner M, Skoog L, Fornander T, et al.Oestrogen receptor co-activator AIB1 is a marker of tamoxifen benefit in postmenopausal breast cancer [J].Ann Oncol, 2013,24: 1994-1999.
[12] Liu MY, Guo HP, Hong CQ, et al.Up-regulation of nuclear receptor coactivator amplified in breast cancer-1 in papillary thyroid carcinoma correlates with lymph node metastasis [J].Clin Transl Oncol, 2013, 15: 947-952.
[13] Balmer NN, Richer JK, Spoelstra NS, et al.Steroid receptor coactivator AIB1 in endometrial carcinoma,hyperplasia and normal endometrium:Correlation with clinicopathologic parameters and biomarkers [J].Mod Pathol,2006, 19: 1593-1605.
[14] Xie D, Sham JS, Zeng WF, et al.Correlation of AIB1 overexpression with advanced clinical stage of human colorectal carcinoma [J].Hum Pathol, 2005, 36: 777-783.
[15] Mo P, Zhou Q, Guan L, et al.Amplified in breast cancer 1 promotes colorectal cancer progression through enhancing notch signaling [J].Oncogene, 2014.

