富硒茶中硒蛋白冻融法辅助提取工艺优化
王 珺 董文宾 杨芙莲 高二东 缑敬轩
(陕西科技大学,陕西西安 710021)
硒是氧族元素,具有金属和非金属特性[1]。硒可以增强自由基的清除能力,提高体内的抗氧化能力,此外硒还有提高免疫能力[2-4]、降血脂、抗肿瘤[5-7]、抗疲劳、解毒、防治心脑血管疾病、提高生殖机能、预防老年性疾病、预防多种地方性疾病等多重功效。茶叶中所含蛋白质的量为茶叶干重的15%~30%。胡秋辉等[8]的研究发现茶叶中的硒大部分都与蛋白质相结合,其蛋白硒的含量占有机硒含量的79.56% ~88.70%。目前中国对茶叶蛋白提取方法研究较多的为碱法提取[9]、酶法提取[10]、盐法提取[11]、超声辅助提取[12]和反复冻融法辅助提取[13],硒蛋白多采用传统碱法进行提取,提取液一般选用NaOH[14-16]。反复冻融法辅助提取是利用低温冰箱把提取液于 -40 ℃冷冻1 h,然后加热溶化,反复 3 次[17,18],在冻融过程中实现细胞壁破碎的目的,使得硒蛋白更容易被提出。
本研究拟通过三冻三融技术辅助传统碱提法提取硒蛋白,研究在辅助手段影响下液固比、提取温度、提取液浓度、提取时间以及提取次数等因素对硒蛋白提取率的影响,进而使富硒茶茶渣中硒蛋白提取率大幅度升高,提高富硒茶利用价值。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
富硒夏秋茶茶粉:陕西安康紫阳富硒绿茶有限责任公司;
乙醇:分析纯,天津市富宇精细化工有限公司;
牛血清蛋白:分析纯,上海励瑞生物科技有限公司;
考马斯亮蓝G-250、磷酸、NaOH:分析纯,天津市富宇精细化工有限公司;
HCl、K2SO4:分析纯,北京化工厂;
H2SO4:分析纯,成都市科龙化学试剂有限责任公司;
CuSO4:分析纯,西安市科洛试剂有限公司。
1.1.2 主要仪器设备
移液枪:DV31142型,大龙医疗设备(上海)总部;
万分之一电子天平:BT354S-XM型,北京赛尔斯精密仪器有限公司;
电热鼓风干燥箱:101-1AB型,天津市泰斯特仪器有限公司;
精密增力电动搅拌器:JJ-1型,常州国华电器有限责任公司;
低速离心机:TM-7706型,上海湘仪科学仪器有限公司;
真空干燥箱:DZ-1BC型,北京博医康实验仪器有限公司;
精密pH计:PHS-3C型,北京赛尔斯精密仪器有限公司;
可见光分光光度计:UV-2800型,上海安亭科学仪器厂。
1.2 方法
1.2.1 硒蛋白含量测定 采用凯氏定氮法。按GB 5009.5—2010执行,蛋白质换算系数为6.32。
1.2.2 硒蛋白的提取 称取5 g茶粉用75 mL 40%乙醇60℃水浴浸提15 min,离心(3 500 r/min,10 min)后去除上清液,重复2次,茶渣干燥至恒重。加一定浓度的NaOH溶液于茶渣中水浴搅拌浸提(200 r/min),然后在-40℃条件下冷冻1 h,水浴加热使其融化,反复3次后以3 600 r/min的转速离心15 min取上清液,此上清液即为硒蛋白提取液,用1 mol/L的盐酸调上清液pH值至等电点,静置15 min后离心(8 000 r/min,15 min),沉淀干燥至恒重即为硒蛋白粗品。用凯氏定氮法(GB 5009.5—2010)测定硒蛋白粗品中的蛋白质含量,以此来计算提取率。每组做3次平行试验,取其平均值。
蛋白质提取率的计算公式见式(1):

1.2.3 硒蛋白等电点的确定 称取去酚后的茶渣4.000 g,在液固比60∶1(V∶m),NaOH浓度为0.1 mol/L,提取温度为60℃的条件下提取2次,离心后合并提取液。取20 mL硒蛋白提取液分别装入8支按顺序编号试管中,依次用0.1 mol/L HCl和0.1 mol/L NaOH溶液调节使得提取液的pH值分别为 5.5,5.0,4.5,4.0,3.5,3.0,2.5,静止 10 min用转速为3 600 r/min的机器离心,以此测定上清液蛋白含量,残留量最低即是硒蛋白质等电点。
1.2.4 硒蛋白提取工艺的优化 本试验在三冻三融技术的辅助下,分别考察了液固比、提取液浓度、提取温度、提取时间以及提取次数对硒蛋白提取率的影响。
(1)液固比的影响:分别称取5 g经去酚后的茶渣,选取10∶1,20∶1,30∶1,40∶1,50∶1,60∶1,70∶1,80∶1(V∶m),提取液为0.1 mol/L NaOH,70℃下水浴搅拌提取3 h,考察液固比对硒蛋白提取率的影响。
(2)碱液浓度的影响:分别称取5 g经去酚后的茶渣,以50∶1(V∶m)的液固比,将其分别溶解于浓度为0.05,0.10,0 .15,0.20,0.25,0.30 mol/L 的 NaOH 溶液中,在 70 ℃下水浴搅拌提取3 h,考察碱液浓度对硒蛋白提取率的影响。
(3)提取温度的影响:分别称取5 g经去酚后的茶渣,以液固比为50∶1(V∶m),提取液为0.1 mol/L NaOH在提取温度分别为 30,40,50,60,70,80,90,100 ℃的条件下水浴搅拌提取3 h,考察提取温度对硒蛋白提取率的影响。
(4)提取时间的影响:分别称取5 g经去酚后的茶渣,以液固比为50∶1(V∶m),提取液为0.1 mol/L NaOH,70℃分别水浴搅拌提取 1,2,3,4,5,6,7,8 h,考察提取时间对硒蛋白提取率的影响。
(5)提取次数的影响:分别称取5 g经去酚后的茶渣,以浓度为0.1 mol/L NaOH按液固比50∶1(V∶m)分别提取1,2,3,4次,温度为70℃,每次提取时间为3 h。首次提取过后把第一次提取后余留残渣用同方法再提取一次,以此类推,测定不同提取次数所得提取物中蛋白含量。考察提取次数对硒蛋白提取率的影响。
1.2.5 硒蛋白粗品的纯化 准确称取4.000 g硒蛋白粗品(硒蛋白粗品由本试验研究所得的最优提取工艺提取),加入40%乙醇溶液60 mL,在60℃下水浴1.5 h,以6 000 r/min的转速离心10 min取其沉淀,60℃下烘至恒重后测定其纯度。其中硒蛋白含量的测定用凯氏定氮法(GB 5009.5—2010)。每组做3次平行试验,取其平均值。
2 结果与分析
2.1 硒蛋白的标准曲线
由图1可知,蛋白质含量在0~100 μg时呈线性良好,其线性方程为 y=0.007 0x+0.008 3,相关系数 R2=0.999 3。
2.2 硒蛋白等电点的确定
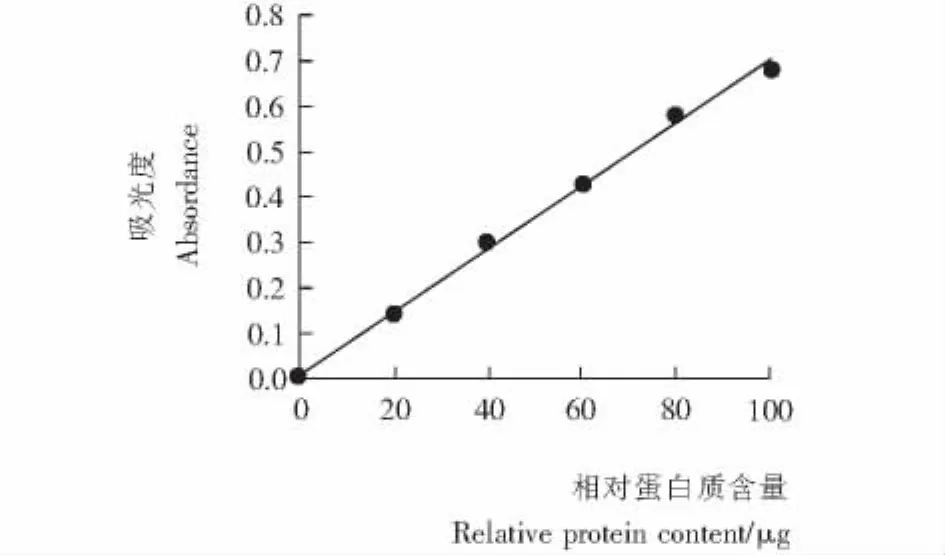
图1 蛋白质标准曲线Figure 1 The standard curve of protein
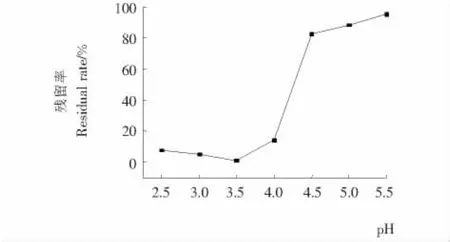
图2 硒蛋白等电点Figure 2 The isoelectric point of selenoproteins
由图2可知,上清液中蛋白质残留率在pH为3.5时最低,即在此pH值下硒蛋白胶体溶液最不稳定,蛋白质沉淀量最多,也最接近等电点。因此,选取pH=3.5为硒蛋白的等电点,用以沉淀硒蛋白。
2.3 硒蛋白提取工艺的优化
2.3.1 液固比对提取率的影响 由图3可知,硒蛋白提取率随液固比增加先增后减,在70∶1(V∶m)时提取率达到最大值40.81%。说明在液固比为70∶1(V∶m)时,硒蛋白在碱液中的溶解度已经饱和,而过量的碱液会破坏氨基酸的结构,然而在液固比50∶1,60∶1(V∶m)时,提取率分别为38.54%和38.61%。综合考虑提取率和耗碱耗水等生产成本,最终确定液固比为50∶1(V∶m)。

图3 液固比对提取率的影响Figure 3 Effect of liquid-solid on the extraction rate for selenoproteins
2.3.2 提取液浓度对提取率的影响 由图4可知,硒蛋白质提取率随NaOH浓度递增而先增后减,在NaOH浓度在0.10 mol/L时,提取率最大达到35.58%。因为随着NaOH浓度的增大,对蛋白质和氨基酸的破坏越大,最终导致提取率降低。而且NaOH浓度过高不仅降低硒蛋白的质量,还对提取设备和环境造成不利影响。因此,选取NaOH浓度0.10 mol/L最佳。
2.3.3 温度对提取率的影响 由图5可知,硒蛋白提取率随温度的增加而降低。在70℃时硒蛋白提取率最大达到41.69%。下降原因可能是温度过高,导致蛋白质和细胞中其他物质结合,从而影响提取效果。而且温度越高,对硒蛋白的结构破坏越大,还造成能耗过高,增加生产成本,所以,提取温度确定为70℃。
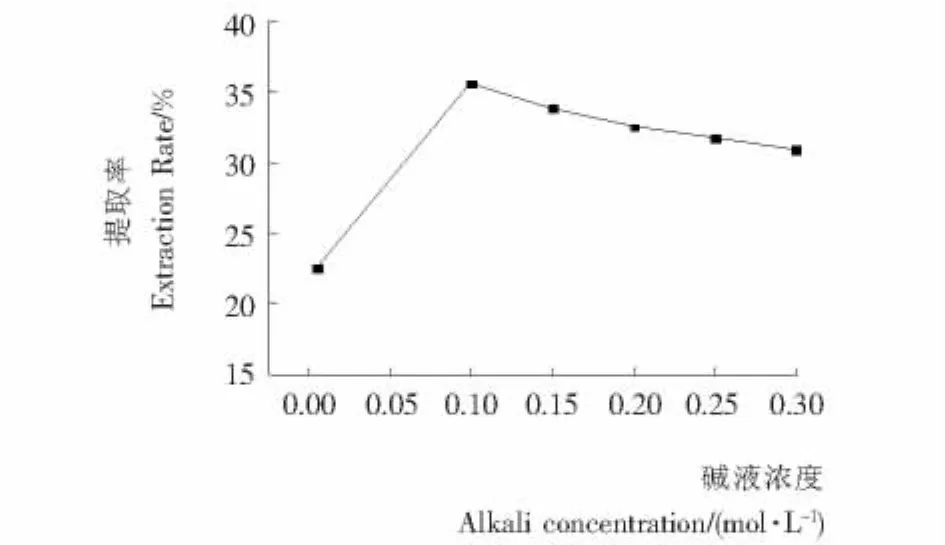
图4 碱液浓度对提取率的影响Figure 4 Effect of Alkali concentration on the extraction rate for selenoproteins
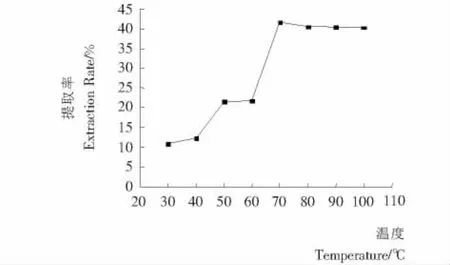
图5 温度对提取率的影响Figure 5 Effect of temperature on the extraction rate for selenoproteins
2.3.4 提取时间的影响 由图6可知,硒蛋白的提取率随着提取时间的增长而先增后减,在提取时间为3.5 h时,提取率最高达到45.05%。这可能是由于时间过长,碱液对蛋白质破坏越大,导致蛋白质损失变大,最终影响蛋白质的提取率。此外,时间过长能耗变大,生产成本增加,因此综合考虑。确定提取时间为3.5 h,提取率可达45.05%。
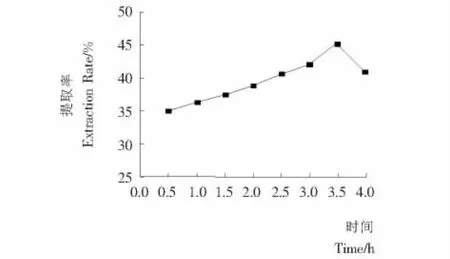
图6 提取时间对提取率的影响Figure 6 Effect of extracting time on the extraction rate for selenoproteins
2.3.5 提取次数对提取率的影响 由图7可知,增加提取次数,提取率逐渐降低。综合考虑提取率和能耗、设备折旧等因素,确定提取次数为2次。
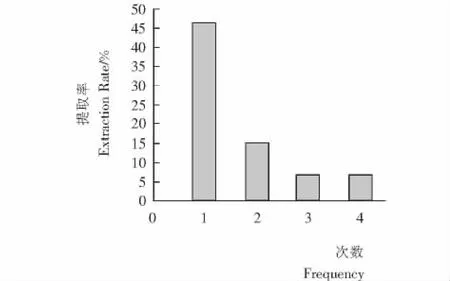
图7 提取次数对提取率的影响Figure 7 Effect of extraction Frequency on the extraction rate
2.3.6 正交优化试验 根据单因素试验结果,设计了以液固比、碱液浓度、提取时间和提取温度的4因素3水平即L9(34),进行正交试验,以此正交试验进一步优化硒蛋白提取的工艺参数。正交试验因素水平见表1,试验结果见表2,方差分析见表3。
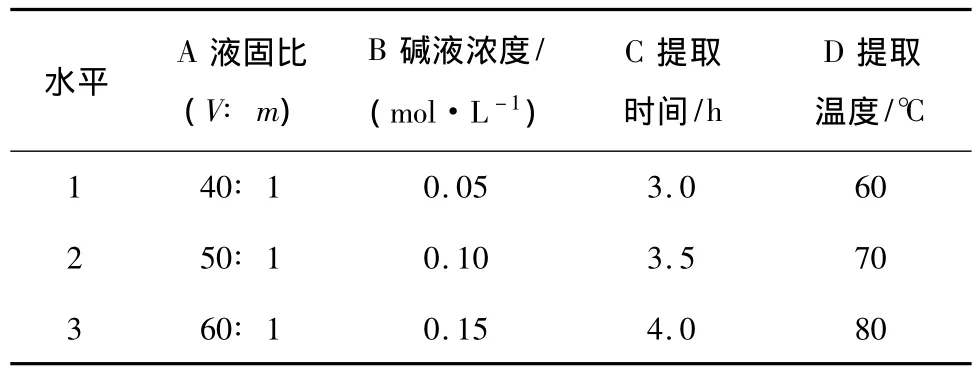
表1 正交试验因素水平表Table 1 Factors and levels in the orthogonal array design
由表2和3可知,4个因素中液固比相对于提取时间有显著差异,碱液浓度和提取温度相对于提取时间都有极显著差异。因此以上4个因素在硒蛋白提取过程中影响大小的先后顺序为:碱液浓度、提取温度、液固比、提取时间。由此得出最宜提取组合为 A3B2C1D2,即采用液固比为60∶1(V∶m),NaOH溶液浓度为0.10 mol/L,在70℃的条件下提取2次,每次提取3 h。
2.3.7 验证实验 验证实验按照最佳组合A3B2C1D2进行,最终测得硒蛋白粗品的提取率为60.93%,与正交所得结果基本一致,证实了提取硒蛋白的最佳工艺条件为:NaOH溶液浓度0.10 mol/L,液固比60∶1(V∶m),提取温度70℃,提取次数2次,每次提取3 h。
2.4 粗蛋白纯化
由表4可知,准确称取4.000 g硒蛋白粗品(硒蛋白粗品为本试验所得最优提取工艺提取),经过乙醇沉淀进行初步纯化,可得到纯度为78.26%的蛋白质,纯化过程中蛋白质的损失率为7.21%。
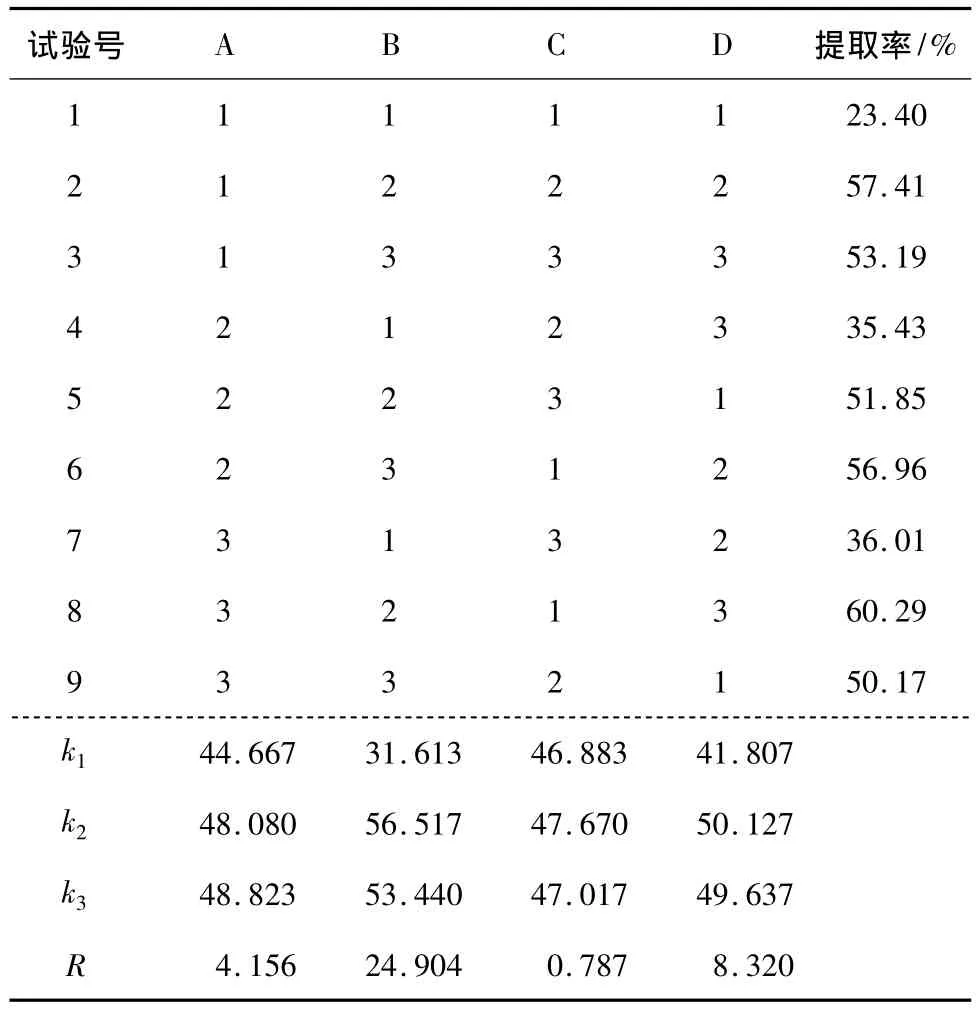
表2 试验结果Table 2 Results of the experiment
表3 方差分析表Table 3 Analysis of variance table of orthogonal
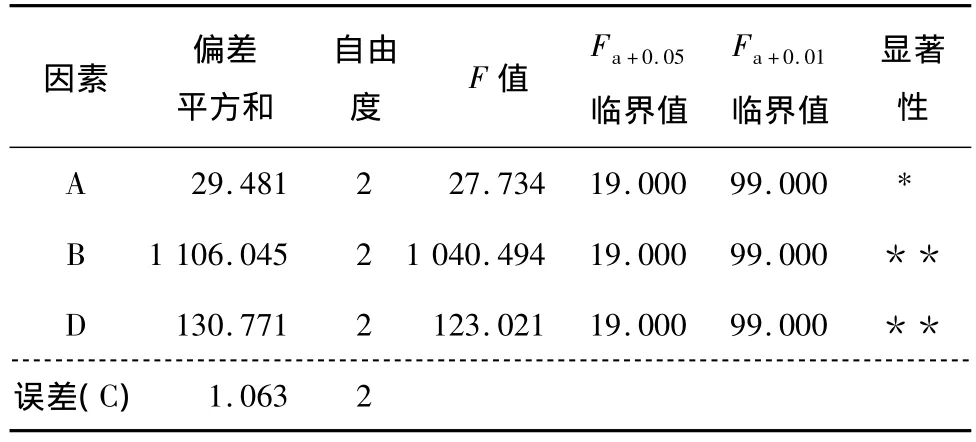
表3 方差分析表Table 3 Analysis of variance table of orthogonal
因正交表的四列已被占满,且C因子的均方较小,所以将C作为误差项进行方差的分析以及F值的检验。
因素 偏差平方和自由度F值Fa+0.05Fa+0.01显著临界值 临界值 性A 29.481 2 27.734 19.000 99.000*1.063 2 B 1 106.045 2 1 040.494 19.000 99.000 **D 130.771 2 123.021 19.000 99.000 **误差(C)
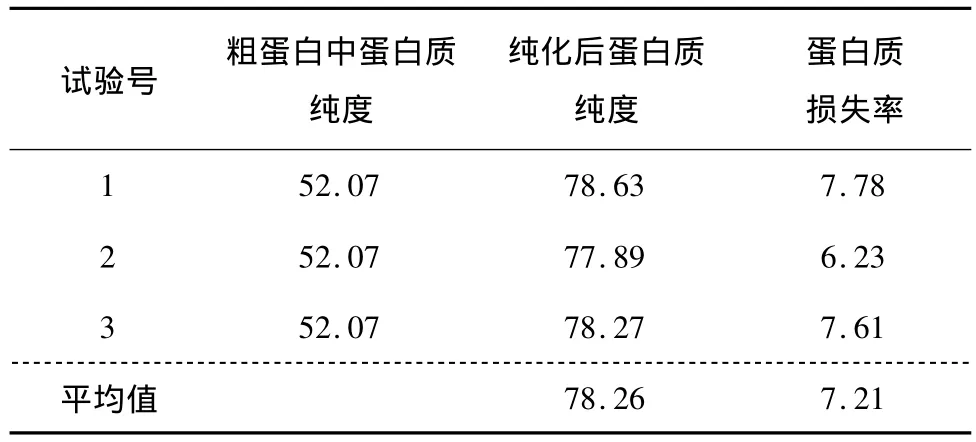
表4 粗蛋白初步纯化结果Table 4 Purification results of the crude protein %
3 结论
本试验结果表明以反复冻融法辅助碱提法提取硒蛋白可有效提高其提取率,较高二东等[19]利用超声辅助浸提硒蛋白的提取率增长了20%,可有效提高其经济效益。利用反复冻融辅助手段使细胞壁破损,硒蛋白更易被提取出来,且提取过程中不加入其他试剂,相较酶提取法试剂更加单一。然而反复冻融辅助提取时间长、步骤繁杂,有待进一步研究。
1 Johansson L,Gafvelin G,Arner E.Selenocysteine in proteins-properties and biotechnological use[J].Biochimica et biophysica acta-general subjects,2005,1 726(1):1 ~13.
2 Kiremidjian-Schumacher L,Roy M,Wishe H,et al.Supplementation with selenium and human immune cell functions:effect on cytotoxic lymphocytes and natural killer cells[J].Biological Trace Element Research,1994,41(4):115~127.
3 Hegazy S M,Adachi Y.Comparion of the effects of dietary selenium,zinc,and selenium and zinc supplemented on growth and immune response between chick groups that were inoculated with salmonella and aflatoxin or salmonella[J].Ponltry Science,2000,79(3):331 ~335.
4 Beck M A.Selemium and host defense towards viruses[J].Proceedings of the Nutrition Society,1999,58(3):707~711.
5 Gairola C,Chow C K.Dietary selenium,hepatic arylhydrocarbon hydroxylase and mutagenic activation of benzo(a)pyrene,2-aminoanthracene and 2-aminofluorene[J].Toxicology Letters,1982,11(3 ~4):281~287.
6 Clenment I,Lisk D.Modulation of phase I and phaseⅡxenobioticmetabolizing enzymes by selenium-enriched garlic in rats[J].Nutrition and Cancer,1997,28(2):184 ~188.
7 Stewart M S,Spallholz J E,Neldner K H,et al.Selenium compounds have disparate abilities to impose oxidative stress and induce apoptosis[J].Free Radical Biology and Medicine,1999,26(1~2):42~48.
8 胡秋辉,潘根兴,丁瑞兴.富硒茶硒的浸出率及其化学性质的研究[J].中国农业科学,1999,32(5):69~72.
9 张杰,李洋,韩小贤,等.燕麦蛋白的碱提取工艺及其提纯研究[J].食品与机械,2012,28(4):121~124.
10 梅鑫东,曾江南,蒋柏泉.酶法提取鱼鳞胶原蛋白的工艺优化[J].食品与机械,2014,30(6):156 ~159.
11 刘凯,梁俊玉,肖引,等.磷酸盐法提取杏仁蛋白的工艺研究[J].武警医学,2013,24(9):783 ~785.
12 马秀婷,肖志刚,孙旭,等.超声波辅助提取豆渣蛋白工艺优化[J].食品与机械,2013,29(1):108 ~112.
13 王洪新,胡昌云.茶叶蛋白质提取及初步纯化研究[J].食品工业科技,2004,25(12):69~73.
14 郭荣荣,潘思轶,王可兴.碱法与酶法提取大米蛋白工艺及功能特性比较研究[J].食品科学,2005,26(3):173~177.
15 Wang M,Hettiarachchy N S,Qi M,et al.Preparation and functional properties of rice bran protein isolate[J].Joumal of Science Food and Agriculture,1999,47(2):411~416.
16 沈莲清,黄光荣,王向阳,等.茶渣中蛋白质的碱法提取工艺研究[J].中国食品学报,2007,7(6):108~112.
17 汪兴平,谢笔钧,程超.反复冻融法在葛仙米破壁技术上的应用[J].食品科学,2005,26(3):139~142.
18 郭卫芸,杜冰,袁根良,等.反复冻融法破壁啤酒废酵母的研究[J].酿酒科技,2009(3):103~105.
19 高二东.紫阳富硒茶中硒形态初步分析与富硒组分的提取[D].西安:陕西科技大学,2012.

