蓝莓多酚提取方法及功能活性研究进展
伍 鹤 王远亮 赵 琳 刘安然 陈绸薇
(湖南农业大学食品科学技术学院,湖南长沙 410128)
蓝莓[1]果实为典型圆形多汁肉质浆果,因富含花色苷类物质而呈现为深蓝色,常伴有一层果粉覆盖在果皮表面,果肉清香爽口、酸甜均衡适度、口感极佳;种子极小,可食率达100%。单果平均重2 g左右,最大为5 g[2,3]。在长期的生产培育当中逐渐发展出以高丛、兔眼、半高丛、矮丛等代表的4个具有典型特征和优良性状的人工栽种蓝莓[4]。蓝莓不仅含有适量的植物多糖、人体必须氨基酸、水溶性维生素和丰富的植物膳食纤维,以及维持细胞渗透压的大量元素钾、半微量元素铁、微量元素锌、锰等常规矿物营养素;花色苷类、单宁类、黄酮类等多酚物质含量也极为丰富[5]。表现为较强的抗氧化、抗炎、抗心血管疾病,抗肿瘤、抗突变能力[6]。
1 蓝莓多酚的类型及结构
多酚物质是普遍存在于植物中,长期摄入能改善身体亚健康的状态,是分子中包含有若干酚性羟基的多元酚类物质的总称。蓝莓多酚以花青素含量最为丰富,酚酸次之,黄酮类化合物的含量也相对较高;蓝莓中以绿原酸(图1)为代表,不同单体之间通过共价结合以及生化反应等方式形成基本的功能活性单元,分散存在于植物内[7,8]。黄酮类化合物的典型构架为C6—C3—C6,是一类苯环上具有羟基的二苯环化合物的总称,同时具有两个官能团的性质。蓝莓中黄酮以花青素为主,除具有典型代表性的5类单体(图1)之外,二氢黄酮(flavonol)、栎精(quercetin)等含量也普遍高于一般功能性植物[9,10]。原花青素则是黄酮类化合物的单聚体或多聚体,并通过黄酮的代谢途径最终转化为花青素,是生物体内最有效的天然抗氧化剂[11]。
2 蓝莓多酚的提取方法
对蓝莓多酚需求的日益增加也在不断促进着蓝莓多酚提取技术的发展与进步。溶剂浸提法从最开始的水,到醇类、酮类、醚类,以及近年发展起来的简单方便、高药物活性保留、快捷、高特异性的物理机械、化学及生物模拟技术,不断推动提取技术向着多酚物质分子结构的本质靠近[12],使蓝莓多酚的提取效率和质量达到一个新的高度。
2.1 溶剂浸提法
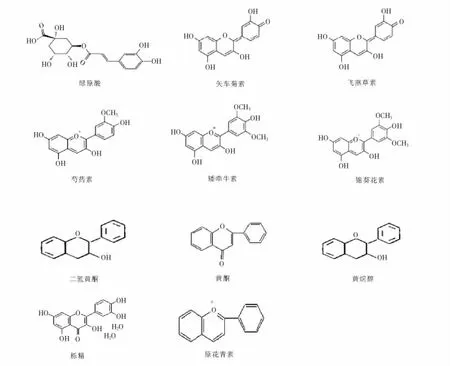
图1 蓝莓多酚的分子结构Figure 1 The molecular structure of blueberry polyphenols
溶剂浸提法是蓝莓多酚提取中出现最早、最常见,也是最经典的方法。一般以酸性甲醇、乙醇或丙酮等常见溶剂为萃取剂,在特定条件下反复萃取;这种方法因简便、低成本,因而应用较为普遍[13]。采用不同比例甲醇、丙酮、乙醇试剂和水的混合试剂于加热条件下浸提蓝莓干果中的多酚混合物,发现用50%的乙醇多酚萃取率最高,得率为10.65 mg/g·干果[14]。安晓婷等[15]采用60%的乙醇溶解蓝莓渣,发现当蓝莓渣浓度为50 g/L时,浸提2 h,未萃取蓝莓多酚仅为2.9%;以甲醇的酸性溶液(pH=3)作为萃取剂,可以在相对比较温和的条件下(40℃),通过较短的时间(40 min),获得蓝莓黄酮提取物2.57 mg/g[16]。Nicoue 等[17]比较了相同条件、相同浓度下不同有机酸和无机酸对蓝莓花色苷提取效果的差异,结果显示10%磷酸处理的乙醇对蓝莓花色苷提取效率最高、活性保存最好。表明醇类物质对蓝莓花色苷的提取效率和质量要优于其他溶剂,并以乙醇最佳。现已证实在花色苷的提取工艺中,影响花色苷提取率的因素依次为醇浓度>温度>时间 >料液比[18]。
溶剂萃取法因操作简便、设备简单、成本低廉、易于实现大规模生产而成为目前主流的萃取方法,但普遍存在试剂耗量大、提取耗时长、提取效率低等缺点,且易受溶剂中本底杂质干扰;在低浓度二氧化硫的水溶液中添加适量的柠檬酸可以提高蓝莓中花青素的萃取率,但是Fe2+、Fe3+以及重金属离子Pb2+等会干扰其稳定性[19],不利于花青素的提取;因而此方法在对样品纯度、活性要求高的医药、精密分析等领域的应用受到限制。
2.2 超声波辅助提取
蓝莓多酚物质主要存在于植物细胞原生质体及液泡内,植物细胞中起支撑和保护作用的细胞壁因为具有较高的机械强度,阻碍多酚物质从细胞内向外扩散。超声波具有良好的方向性和较强的穿透能力,并且其独特的空化作用能使液体分子间发生剧烈的碰撞和交互作用,起到类似于搅拌和加热的作用;使植物细胞壁在短时间内破裂,释放出内容物,加速酚类分子自由运动和扩散,达到快速萃取的效果。同时超声波辅助提取仪器设备廉价易得,操作简便易行、能较好地保护提取多酚类成分的物理结构和生理活性。
超声辅助条件下,采用约52%的乙醇,在37 min内,分2次提取蓝莓冻果,确定冰冻蓝莓中花青素为3.36 mg/g[20]。张玉香等[21]采用类似方法优化蓝莓叶中黄酮的提取,提取量为 4.23%,和程安玮等[22]的结论相符合(3.79% ~ 5.26%);超声波提取1 h后,可使蓝莓冻果中的总酚萃取量约达到20.5 mg/g[23]。超声波辅助萃取不仅具有普通溶剂萃取法设备、操作相对简单的优点,还能节省试剂、节约时间、提高萃取率,是一种安全环保的方法。但超声波和声波一样具有衰减的特性,作用直径过大时,会形成盲区,无法保证输出功率,影响萃取速度和效果,从而难以实现单次大量生产,限制了其工业化应用。
2.3 酶解提取法
高选择性、高效率、特异性是生物酶解提取法的三大特点,选取合适的生物酶,破坏并降解细胞壁中的纤维素和果胶,从而使植物细胞的原生质体、液泡失去细胞壁的保护而吸水胀裂,释放出多酚、花青素等活性物质,达到提取的目的[12]。其处理条件温和,营养素损失小,因而在活性成分的保护上较之于其他方法具有独到的优势[24]。纤维素和果胶均为蓝莓果实细胞细胞壁的组成成分,采用纤维素酶和果胶酶对蓝莓花青素进行酶解辅助萃取;结果表明,前者比后者更适合于蓝莓细胞细胞壁的分解,酶解更彻底,提取率达97%以上,提取量为3.50 mg/g·鲜蓝莓果[25]。采用不同类型的纤维素酶和果胶酶的混合酶解液对蓝莓果浆处理1 h后,可使蓝莓中果汁中的花青素提取率从6.49%提高到14.1%,多酚提取量从0.89 mg/g提高到 1.75 mg/g,分别提高了约 2 倍[26]。
生物酶所具有的高度专一性、高效性和易变性等特点决定了酶解法的效果与使用的酶的种类、酶解时间、酶解pH、酶解温度息息相关。总的来说,选择对纤维素分解能力、细胞壁破坏强的生物酶,并在其最佳pH和最适温度下酶解,防止因时间过长造成的分解,能将蓝莓中多酚类物质的提取量最大化,但缺点是成本过高。
2.4 微波辅助提取
微波辅助提取借助于微波的热特性、波动性、高频性等特点,穿透到植物细胞内部,引起细胞内分子的高频电磁振荡;利用不同物质在细胞中不同的微波吸收能力,针对性使被分离物料受热,达到选择性提取分离的目标。在微波作用下,细胞内有效成分在较低温度下快速向溶剂中分离、扩散;在保证提取物生物活性的同时,极大地提高了效率。Ganzler于1986年首次成功采用微波辅助法提取出具有生理活性的植物天然产物,之后几十年,微波辅助提取技术在食品分析、生物技术方面已取得长足的发展和进步[27]。刘小莉等[28]比较了微波辅助萃取和传统溶剂浸提法对蓝莓叶黄酮量的提取差异,结果显示微波功率500 W下萃取50 s,可比在同等条件下有机溶剂乙醇萃取的黄酮含量高1.25倍,达30.18 mg/g·蓝莓叶。薄艳秋[29]发现微波萃取不但节省了大量时间,也明显提高了蓝莓花色苷的萃取量;许相雯[30]也得到了类似的结论,并确定了最佳提取工艺为萃取温度30~70℃,乙醇浓度40% ~80%,固液比1∶10~1∶50(m∶V)。微波辅助萃取法兼具上述几种方法的优点,在大幅缩短萃取时间的同时,有效地保护了蓝莓多酚的分子结构和生理活性,具有较高的应用价值。但设备成本和使用费用偏高,故大模应用受到限制,在提高萃取率的同时进一步降低成本将是下一步研究的重点之一。
3 蓝莓多酚的功能活性
因多酚类物质易与肠道内的消化酶结合影响蛋白质的吸收,过去人们一直把多酚类物质视为抗营养因子。但随着研究的深入,许多资料都显示蓝莓等浆果富含的多酚类物质具有强抗氧化、预防心血管疾病、抗癌、抑菌消炎、抗病毒、防止脑神经老化、抑制胆固醇上升等保健作用[31];能够通过调剂人体各个脏器的内分泌和机体代谢,有效地预防疾病的发生,并且比普通药物的安全性更好[32]。
3.1 抗氧化能力活性
自由基作为一种能量传递的中间产物,参与人体内各项生理生化反应,其含量的动态平衡对维持人体内环境的稳定和健康具有重要意义。受外部环境因素刺激或年龄增加时,细胞内自由基累积速度大于清除速度,产生氧化应激[33];表现为细胞、组织、器官癌变、功能丧失,染色体变异,甚至是死亡。蓝莓多酚可以通过提供大量电子受体的方式来阻断自由基的链式反应,从而达到消除机体内过剩自由基的目的,并能与Vc、VE产生协同效应。蓝莓多酚对ABTS+·和 DPPH自由基清除一半时的浓度分别为12,45 mg/mL,抑制乙烯生成时(EC50)每克蓝莓多酚提取物相当于100 μmol Vc[34];蓝莓中多酚的含量与抗氧化能力成正比,并具有显著相关性(相关系数 r=0.97)[35]。Joseph 等[36,37]发现,富含多酚的蓝莓提取物可显著减少细胞内钙质的流失和蛋白激酶的表达活性,从而达到保护细胞的目的。于饲料中添加2%蓝莓多酚,连续饲养大鼠12周,可刺激大鼠脑细胞分泌产生脑源性神经因子(BDNF)和活性蛋白质(REB),显著改善大鼠的记忆能力和行为表现[38]。
3.2 预防心血管疾病活性
蓝莓多酚类物质作为一种高活性抗氧化剂,能显著降低血液中血脂、胆固醇以及低密度脂蛋白的含量,提高体内抗氧化酶的水平;清除体内过量游离态自由基、降低氧化应激风险,加强自身免疫系统预防能力,减少相关疾病的患病率[39]。富含多酚的蓝莓提取物能显著降低大鼠脂质过氧化产物,提高其脑抗坏血酸水平和谷胱甘肽水平[40]。同样能显著抑制脂多糖(LPS)的生成与释放,减缓BV2细胞内一氧化氮合酶和环氧化酶相关启动子的活性,减弱NF-κB诱导的核位移的作用[41];前列腺素和人体的炎症息息相关,蓝莓多酚可抑制正常细胞内过量前列腺素的生成,能较好地抑制细胞内过量脂多糖造成的负面影响[42]。高血脂模型大鼠在摄入不同剂量蓝莓花色苷后,其体内三大抗氧化物酶(SOD、GHS-PX、T-AOC)的活性得到了显著提高,细胞毒性物质丙二醛(MDA)的含量显著减少,并表现出了一定的剂量依赖关系[43],显现出蓝莓多酚的强抗应激突变功用。
3.3 抗癌活性
癌症是细胞基因水平调控失效、异常增殖、机体正常生理调节失效的结果。蓝莓多酚能有效阻断致突变剂亚硝酸盐在人体内的合成,减弱外源性致癌物质的诱变作用;抑制癌细胞染色体复制,修复受损DNA,防止DNA链断裂,并杀伤、抑制癌细胞的生长;提高人体抗癌能力,体现出优秀的抗诱变作用。Bornsek等[44]以人结肠癌细胞(Caco-2)、肝癌细胞(HepG2)、血管内皮细胞(EA.hy926)、大鼠血管平滑肌细胞(A7r5)为试样,研究发现蓝莓多酚在极低浓度下仍然能很好地抑制肿瘤细胞的增生和分化。同时,蓝莓中丰富的多酚物质可抑制肝脏细胞受纤维化因素所导致的非正常分裂和增生,干扰其分泌胞外基质,可降低试验模型大鼠肝纤维化风险和患肝癌的几率,并适用于有机有毒化合物CCl[45,46];4对于致突变剂甲磺酸和高活性间接致癌物苯并芘所致的基因、染色体突变也有一定的抑制和保护作用[47];蓝莓中的槲皮素也能防止过氧化氢对人类淋巴细胞DNA的过氧化作用及苯并芘的破坏[48]。骨髓的造血功能与造血干细胞的分化密不可分,蓝莓多酚类物质能与胡萝卜素、番茄红素、香豆素等植物化学物质相互促进,加强造血干细胞的生理活性、分化功能,对血液疾病的预防和治疗具有积极意义[49]。
3.4 抑菌、抑病毒活性
一定浓度的蓝莓多酚,不仅对动植物正常细胞无毒害作用,更能显著抑制多种细菌、酵母和真菌的生长和繁殖[50],而且还能显著降低病原微生物对动物肠道上皮组织的粘附性。近年来研究[33]表明蓝莓多酚通过抑制艾滋病毒基因的复制、转录来延缓艾滋病的发病期,对轮状病毒感染所致的肠胃炎和部分RNA病毒也能起到一定的杀灭作用。蓝莓多酚中高含量的酚酸对于金黄色葡萄球菌也有较强抑制能力,但如果蓝莓中还原糖含量过高则会削弱抑制效果,表现为负相关[51]。同时,蓝莓多酚具有对抗生素抗药性微生物的广谱抑制作用,可以减少特定种类抗生素的使用量,增加病原性细菌对抗生素的敏感程度,提高抗生素的疗效[52]。Anthony等[53]认为,蓝莓多酚通过抑制原生动物滋养体(trophozoite)的生长,达到抑制原生动物繁殖的目的,在隐形孢子虫病等的预防中起到一定作用。Shen等[54]比较了不同品种蓝莓多酚对李斯特菌和肠炎沙门氏菌的抑制能力,发现其最低杀菌浓度分别为450,600 mg/mL。表明蓝莓多酚对常见的食源性致病菌有较强的抑制、杀灭能力,说明多酚类物质不仅在保健、改善亚健康方面具有积极意义,同时在食品的贮藏、保鲜方面也有潜在应用价值。
3.5 其他作用
因蓝莓多酚在200~300 nm波长之间对紫外光有较强的吸收能力[55],因此可以作为防晒剂使用,用以阻止皮肤黑色素的生成。Andress-Lacueva等[56]以成年大鼠为对象,建立老年痴呆模型,每天灌胃3.2 mg/kg剂量的花色苷,发现30 d后大鼠因老年痴呆出现的短期记忆失常有较大改善,表明蓝莓多酚类物质能在一定程度上改善由年龄增加所引起的大脑激素调节失常。另外,蓝莓中所含多酚类物质能促进眼中传导光刺激给大脑的视红素的产生和再合成,从而达到增强人视力的功效[57]。
4 展望
蓝莓多酚的提取和功能活性研究等方面已经取得一些进展和成果,建立了较为成熟的提取方法,验证了其在体内外的各种生理活性功能,但整体而言,对蓝莓多酚的利用尚处于初级阶段。比如多酚的提取绝大多数还是停留在传统粗放的有机溶剂浸提法,虽然成本低廉,但是提取物的质量和纯度往往达不到要求,应用受到限制;虽在超声波、酶提取法的发展方面取得了一些成果,但也仅限于花色苷、黄酮等单一或某一类多酚物质,对于总酚的提取效果有限;同时过高的初始投入和技术难度成为限制其工业化应用的主要制约因素。有效提取当前萃取技术尚不能萃取出的蓝莓多酚也是以后发展的方向之一。蓝莓多酚具有高效的生物活性已经得到公认,但是多酚在体内的作用机制、代谢过程以及与其他营养素之间的有无拮抗关系;花青素在体内的吸收率过低,怎样提高多酚物质在体内的吸收利用率,从而达到高生物药效等都是需要进一步研究的问题。
1 李怡爽,吴林,李亚东,等.中国蓝莓加工品市场营销策略研究[J].吉林农业大学学报,2009(5):675~680.
2 吴大真.蓝莓的生理活性物质及其保健功能[C]//徐怀德.我国芦荟饮料的发展及其市场前景:2005中国国际饮料科技报告会论文集.北京:中国轻工业出版社,2005:29~32.
3 杨喜平,张胜利,王琚钢,等.我国蓝莓研究[J].内蒙古林业科技,2012,38(3):55~58.
4 孙婧超.蓝莓酒酿造过程中花色苷变化规律的研究[D].烟台:烟台大学,2012.
5 陆新龙.蓝莓饮料生产工艺[J].食品与机械,2001(6):33~34.
6 李亚东,吴林,张志东.越橘(蓝莓)栽培与加工利用[M].长春:吉林科学技术出版社,2001.
7 Neto C C.Cranberry and blueberry:evidence for protective effects against cancer and vascular diseases[J].Molecular Nutrition & Food Research,2007,51(6):652~664.
8 Zadernowski R,Naczk M,Nesterowicz J.Phenolic acid profiles in some small berries[J].Journal of Agricultural and Food Chemistry,2005,53(6):2 118~2 124.
9 Prior R L,Cao G,Martin A,et al.Antioxidant capacity as influenced by total phenolic and anthocyanin content,maturity,and variety of Vaccinium species[J].Journal of Agricultural and Food Chemistry,1998,46(7):2 686~2 693.
10 Hosseinian F S,Beta T.Saskatoon and wild blueberries have higher anthocyanin contents than other Manitoba berries[J].Journal of Agricultural and Food Chemistry,2007,55(26):10 832 ~10 838.
11 Takeshita M,Ishida Y,Akamatsu E,et al.Proanthocyanidin from blueberry leaves suppresses expression of subgenomic hepatitis C virus RNA[J].Journal of Biological Chemistry,2009,284(32):21 165~21 176.
12 杨会成.海带(Laminaria japonica Aresch)多酚的提取,分离及其抗肿瘤,抗菌活性研究[D].青岛:中国海洋大学,2008.
13 冯丽,宋曙辉,赵霖,等.植物多酚及其提取方法的研究进展[J].中国食物与营养,2007(10):39~41.
14 程安玮,房凯,王文亮,等.蓝莓多酚的萃取及抗氧化活性研究[J].北京工商大学学报(自然科学版),2012,30(4):37~40.
15 安晓婷,王兴娜,周涛,等.响应曲面法优化蓝莓渣多酚提取工艺[J].食品工业科技,2012,33(15):269~273.
16 解利利.蓝莓浊汁饮料加工技术的研究[D].无锡:江南大学,2011.
17 Eugene Emile Nicoue,Sylvain Savard,Khaled Belkacemi.Anthocyanins in wild blueberries of Quebec:extraction and identification[J].Journal of Agricultural and Food Chemistry,2007,55(14):5 626~5 635.
18 李知敏.蓝莓花色苷的分离纯化及其初步药效学实验研究[D].重庆:重庆大学,2006.
19 J Lee,R E Wrolstad.Extraction of anthocyanins and polyphenolic from blueberry processing waste[J].Journal of Food Science,2004,69(7):564~573.
20 韩彩静,谢春阳,陈相艳,等.蓝莓不可萃取多酚的酸法提取工艺优化[J].食品科学技术学报,2013,31(5):31~36.
21 张玉香,屈慧鸽,杨润亚,等.响应面法优化蓝莓叶黄酮的微波提取工艺[J].食品科学,2010,31(16):33~37.
22 程安玮,杜方岭,王文亮,等.蓝莓叶中可萃取多酚和不可萃取多酚提取的研究[J].南方农业学报,2011,42(11):1 395~1 398.
23 解利利,张慜,孙金才.蓝莓冻果多酚粗提物体外抗氧化活性的研究[J].食品与生物技术学报,2011,30(6):818~821.
24 张卫红,张效林.复合酶解法提取茶叶中有效成分的过程研究[D].西安:西北大学,2005.
25 李颖畅,孟宪军.酶法提取草莓果中花色苷的研究[J].食品工业科技,2008,29(4):215~217.
26 马永强,李安,那治国,等.酶法提高蓝莓果花色苷与总酚溶出率的工艺条件研究[J].农产品加工·学刊,2012(4):48~53.
27 韩彩静,程安玮,陈相艳,等.蓝莓多酚的提取及功效的研究进展[J].中国食物与营养,2013,19(9):54~57.
28 刘小莉,周剑忠,单成俊,等.蓝莓叶总黄酮的微波提取及抗氧化活性研究[J].食品研究与开发,2011,32(3):44~47.
29 薄艳秋.蓝莓花青素的提取和抗氧化活性研究[D].哈尔滨:东北农业大学,2012.
30 许相雯.微波辅助萃取蓝莓中花青素及纯化的研究[D].哈尔滨:东北农业大学,2012.
31 赵慧芳,吴文龙,姚蓓,等.黑莓复合果汁的研制[J].食品与机械,2013,29(5):208~212.
32 倪勤学,霍艳荣,陆国权.花色苷保健功能的研究进展[J].安徽农业科学,2010(35):20 025~20 028.
33 赵扬帆,郑宝东.植物多酚类物质及其功能学研究进展[J].福建轻纺,2006(11):107~110.
34 G Kouakou-Siransy,S Sahpaz,G Irie-Nguessan,et al.Oxygen species scavenger activities and phenolic contents of four West African plants[J].Food Chemistry,2010,118(2):430 ~ 435.
35 樊梓鸾,王振宇,程翠林,等.5种野生浆果的抗氧化和抗细胞增殖活性[J].食品科学,2010(17):148~152.
36 Joseph J A,Fisher D R,Carey A N.Fruit extracts antagonize Aβ-or DA-induced deficits in Ca2+flux in M1-transfected COS-7 cells[J].Journal of Alzheimer's Disease,2004,6(4):403 ~411.
37 Joseph JA,Fisher DR,Bielinski D.Blueberry extract alters oxidative stress-mediated signaling in COS-7 cells transfected with selectively vulnerable muscarinic receptor subtypes[J].J.Alzheimers Dis,2006,9(1):35~42.
38 Williams C M,El Mohsen M A,Vauzour D,et al.Blueberry-induced changes in spatial working memory correlate with changes in hippocampal CREB phosphorylation and brain-derived neurotrophic factor(BDNF)levels[J].Free Radic Biol.Med.,2008,45(3):295~305.
39 Wu Xian-li,Cao Guo-hua,Prior R L.Absorption and metabolism of anthocyanins in elderly women after consumption of elderberry or blueberry[J].The Journal of Nutrition,2002,132(7):1 865 ~ 1 871.
40 Prior R L,Wu Xian-li,Gu Li-wei,et al.Purified berry anthocyanins but not whole berries normalize lipid parameters in mice fed an obesogenic high fat diet[J].Molecular Nutrition & Food Research,2009,53(11):1 406~1 418.
41 Francis C Lau,James A Joseph,Jane E McDonald,et al.Attenuation of iNOS and COX2 by blueberry polyphenols is mediated through the suppression of NF-κB activation[J].Journal of Functional Foods,2009,1(3):274~283.
42 Han Guang-liang,Li Cui-mei,Mazza G,et al.Effect of anthocyanin rich fruit extract on PGE2 produced by endothelia cells[J].Health Research,2005,34(5):581~584.
43 李颖畅,孟宪军,孙靖靖,等.蓝莓花色苷的降血脂和抗氧化作用[J].食品与发酵工业,2008,34(10):44~48.
44 Spela Moze Bornsek,Lovro Ziberna,Tomaz Polak,et al.Bilberry and blueberry anthocyanins act as powerful intracellular antioxidants in mammalian cells[J].Food Chemistry,2012,134(4):1 878 ~1 884.
45 王豫萍,程明亮,吴亚云,等.蓝莓对大鼠肝星状细胞增殖、活化的影响及机制探讨[J].中华医学杂志,2010,90(35):2 504~2 508.
46 王豫萍,程明亮,张宝方,等.蓝莓对肝纤维化大鼠血红素加氧酶-1表达的影响[J].中华肝脏病杂志,2010,18(9):656~660.
47 Hope Smith S,Tate P L,Huang G,et al.Antimutagenic activity of berry extracts[J].J.Med.Food,2004,7(4):450~455.
48 Sellappan S,Akoh C C,Krewer G.Phenolic compounds and antioxidant capacity of Georgia-grown blueberries and blackberries[J].Journal of Agricultural and Food Chemistry,2002,50(8):2 432~2 438.
49 陈介甫,李亚东,徐哲.蓝莓的主要化学成分及生物活性[J].药学学报,2010,45(4):422~429.
50 左丽丽,王振宇,樊梓鸾,等.植物多酚类物质及其功能研究进展[J].中国林副特产,2012(5):39~42.
51 沈潇,孙晓红,赵勇,等.蓝莓提取物对金黄色葡萄球菌的抑制作用研究[J].天然产物研究与开发,2012,24(11):1 622~1625.
52 Puupponen Pimia R,Nohynek L,Meier C,et al.Antimicrobial properties of phenolic compounds from berries[J].Journal of applied microbiology,2001,90(4):494~507.
53 Anthony J P,Fyfe L,Stewart D,et al.The effect of blueberry extracts on Giardia duodenalisviability and spontaneous excystation of Cryptosporidium parvumoocysts,in vitro[J].Methods,2007,42(4):339~348.
54 Shen Xiao,Sun Xiao-hong,Xie Qing-chao,et al.Antimicrobial effect of blueberry(Vaccinium corymbosum L.)extracts against the growth of Listeria monocytogenes and Salmonella Enteritidis[J].Food Control,2014,35(1):159~165.
55 宋立江,狄莹,石碧.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161~170.
56 Andres-Lacueva C,Shukitt-Hale B,Galli R L,et al.Anthocyanins in aged blueberry-fed rats are found centrally and may enhance memory[J].Nutritional Neuroscience,2005,8(2):111 ~120.
57 李轶擎.北欧蓝莓提取物对体外培养人角膜缘上皮细胞作用的初步研究[D].广州:中山大学,2009.

