Fe(Ⅲ)—KI—RB体系荧光猝灭法间接测定微量铁
董文丽 徐 刚
(重庆科技学院,重庆 401331)
铁是人体必需的微量元素之一,可以参与血蛋白,细胞色素及各种酶的合成[1,2]。生物医学研究证明[3],微量元素的浓度与人体健康之间具有越来越多的相关性,因此研究测定食品中微量铁具有重要意义。微量铁的测定方法主要有原子吸收光谱法[4,5]、分光光度法[6]、伏安法[7]、高效液相色谱法[8]、荧光分析法[9,10]等。中国 GB/T 5009.90—2003《食品中铁、镁、锰的测定》采用火焰原子吸收法,但由于该法灵敏度不高,对于一些铁含量较低的样品分析受到限制。而荧光分析法以其灵敏度高、选择性好及操作简便等优点,广泛应用于环境水样[11]、食品[12]及药品[13]中微量铁的测定。罗丹明B(rhodamine B,RB)属于“三苯甲烷类”试剂,本身具有很强的荧光性及络合能力,可以跟许多物质反应形成离子缔合物,导致RB分子本身的内源性荧光发生猝灭,从而实现对某些阴阳离子的检测分析。迄今尚未有关于RB荧光猝灭法测定微量铁的研究报道,本研究拟根据在盐酸介质中,Fe3+与过量KI反应后生成I3-,I3-与RB形成离子缔合物,使RB分子內源性荧光发生猝灭,荧光猝灭值的大小与体系中Fe3+浓度在一定范围内成正比,从而建立起Fe(Ⅲ)—KI—RB体系荧光猝灭法间接测定微量铁的新方法。
1 材料与方法
1.1 主要仪器及试剂
荧光光谱仪:LS55型,美国PE公司;
高通量密闭微波消解系统:CEM MARS型,美国培安科技公司;
原子吸收分光光度计:AA-702型,北京东西分析仪器有限公司(仪器使用条件:灯电流5 mA,光谱通带0.2 nm,波长248.5 nm,燃烧器高度6 mm);
电子天平:BP211D型,德国赛多利斯公司;
浓盐酸、30%过氧化氢:优级纯,成都金山化学试剂有限公司;
聚乙烯醇 PVA-124、乳化剂OP-10、罗丹明B:分析纯,重庆川东化学试剂厂;
RB溶液(储备液):1.0×10-3mol/L,使用时稀释至 1.0 ×10-5mol/L;
铁标准溶液(100 μg/mL):准确称取 0.014 3 g Fe2O3(99.99%)于100 mL烧杯中,加入5 mL HCl(6 mol/L)溶解后转移至100 mL容量中,用一级去离子水稀释至刻度,摇匀,此溶液为100 μg/mL的铁(III)标准溶液,使用时稀释成1 μg/mL的铁工作液;
生花生:2013年8月采集于贵州务川;
试验用水为一级去离子水,所用试剂除特别说明外,均为分析纯。
1.2 试验方法
1.2.1 激发波长和发射波长的选择 于25 mL比色管中分别加入1 μg/mL 铁标准工作溶液0.00,4.00 mL,10%的碘化钾溶液1.00 mL,1 mol/L 的 HCl 2.00 mL,混匀后稀释至 10 mL,静置10 min后,再加入 1.0 ×10-5mol/L RB 溶液2 .00 mL,10 g/L 的 PVA-124 溶液0.50 mL,微乳液 0.50 mL,摇匀,然后用去离子水稀释至25 mL,放置10 min,用荧光光谱仪分别扫描空白及离子缔合物的激发波长和发射波长,确定体系的荧光最大激发波长和最大发射波长。
1.2.2 盐酸用量的选择 吸取1 μg/mL铁标准工作溶液0.00,4.00 mL于25 mL比色管中,其它试剂固定不变,只改变盐酸的用量(加入 1 mol/L 的 HCl溶液 0.50,1.00,1.50,2.00,2.50,3.00 mL),分别测定空白荧光强度 F0及离子缔合物溶液的荧光强度F,按式(1)计算荧光猝灭值ΔF,以ΔF对盐酸用量绘制曲线,确定盐酸的最佳用量。

1.2.3 碘化钾用量的选择 其它试剂不变,分别加入10%的碘化钾溶液 0.50,1.00,1.50,2.00,2.50 mL,测定空白荧光强度F0及离子缔合物溶液的荧光强度F,按式(1)计算荧光猝灭值ΔF,以ΔF对碘化钾用量绘制曲线,确定碘化钾的最佳用量。
1.2.4 罗丹明B用量的选择 其它试剂不变,分别加入1.0 ×10-5mol/L 的罗丹明 B 溶液 0.50,1.00,1.50,2 .00,2.50,3.00 mL,测定空白荧光强度 F0及离子缔合物溶液的荧光强度F,按式(1)计算荧光猝灭值ΔF,以ΔF对罗丹明B用量绘制曲线,确定罗丹明B的最佳用量。
信息类试题往往是生物学考试中得分率较低、区分度较大的试题。学生往往读不懂题干信息,不知道如何利用信息作答。之所以出现这两个问题,根本原因是学生缺乏获取和解读信息的能力、调动和运用知识的能力。
1.2.5 表面活性剂的选择 其它试剂不变,分别加入不同种类、不同量的表面活性剂,测定空白和离子缔合物的荧光强度,确定表面活性剂的种类及最佳用量。
1.2.6 标准曲线的绘制 于25 mL比色管中分别加入1 μg/mL铁标准工作溶液 0.00,0.50,1.00,1.50,2.00,2.50,3.00,3.50,4.00,4.50 mL,10% 的碘化钾溶液 1.00 mL,1 mol/L的HCl 2.00 mL,混匀后稀释至10 mL,静置10 min后,再加入1.0×10-5mol/L RB溶液2.00 mL,10 g/L的 PVA-124溶液0.50 mL,微乳液0.50 mL,摇匀,然后用去离子水稀释至25 mL,放置10 min,用1 cm比色皿,以水作参比,于波长λex/λem=352 nm/580 nm处测量试剂空白荧光强度F及离子缔合物溶液的荧光强度F,按式(1)计算荧光猝灭值ΔF,以ΔF对铁(Ⅲ)质量绘制标准曲线。
2 结果与讨论
2.1 激发光谱和发射光谱
由图1可知,在表面活性剂PVA-124和微乳液存在下,体系的最大激发波长为352 nm,最大发射波长为580 nm。KI—RB体系的激发和发射光谱(曲线1和3)荧光值明显比Fe(Ⅲ)—KI—RB体系(曲线2和4)的荧光值高,说明KI本身不与RB反应形成离子缔合物,但当体系中有Fe3+存在时,Fe3+可与KI反应生成I2,I2再与过量的KI反应生成I3一,I3一与RB形成离子缔合物,使RB分子内源性荧光发生猝灭,导致RB分子的荧光强度降低的结果。

图1 荧光激发和发射光谱Figure 1 Excitation and emission spectra of fluorescence
2.2 酸度的影响
试验考察了不同浓度的HCl溶液对体系荧光猝灭值的影响见图2,结果表明,当加入1 mol/L HCl为2.00 mL时荧光猝灭值最大且稳定。因此,本试验选择1 mol/L HCl溶液为 2.00 mL。
2.3 碘化钾用量试验
试验考察了0.1 mol/L KI溶液加入量对体系荧光猝灭情况的影响见图3。体系的荧光猝灭情况先随KI的加入量逐渐增加,当加入 KI的量为1.00 mL时最大,但超过1.00 mL时又逐渐减小,这是因为Fe3+与过量KI反应后生成I3-,I3-与RB形成离子缔合物,使RB分子内源性荧光发生猝灭,但碘化钾浓度太大时,单位体积内有效I3-相对较少,使RB分子內源性荧光猝灭效应相对减弱。因此,本试验选用KI加入量为1.00 mL。
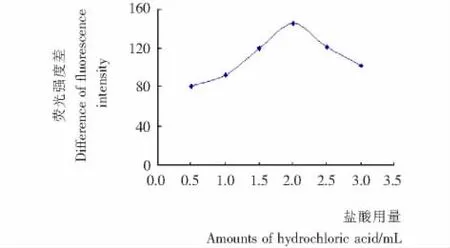
图2 盐酸用量曲线Figure 2 Curve of hydrochloric acid used amount

图3 碘化钾用量曲线Figure 3 Curve of potassium iodide used amount
2.4 罗丹明B用量的影响
试验考察了不同量RB对体系荧光猝灭的影响见图4。试验表明,荧光猝灭值随RB溶液的增加而增大,当RB溶液增加到2.00 mL时,荧光猝灭值最大且灵敏度最高;当RB的用量超过2.00 mL后体系的荧光猝灭值逐渐减小,检测的灵敏度降低,这可能是由于过量RB对于激发光的吸收具有隐蔽效应所致。因此,本试验选择RB最佳用量为2.00 mL。

图4 罗丹明B用量曲线Figure 4 Curve of Rhodamine B used amount
2.5 表面活性剂的影响
试验考察了阴离子表面活性剂十二烷基苯磺酸钠(SDBS)、阳离子表面活性剂十六烷基三甲基溴化铵(CTMBA)、阿拉伯树胶、明胶、司班-40、司班-60、PVA-124、微乳液(VOP-10∶V正戊醇∶V正庚烷∶V水=3.2∶2.3∶0.5∶94)对体系荧光猝灭值的影响,试验表明,当同时加入0.5 mL PVA-124(10 g/L)和0.5 mL微乳液时,体系荧光猝灭值最大且稳定。
2.6 干扰离子
当测定0.08 μg/mL铁,相对误差<5%时,允许干扰离子的倍数为:1 000倍的Ca2+、Al3+;500倍的NH4+;400倍的F-;300倍的C2O42-;50倍的Cd2+、Mn2+;2倍的Cr(VI);0.5倍的 Cu2+;Na+、Mg2+、K+、Cl-、NO3-不干扰测定。
2.7 线性范围及检测下限
按(1.2.6)试验方法分别测定不同量的铁加入后的荧光强度F和空白的荧光强度F0,以ΔF为纵坐标,以铁的质量为横坐标绘制标准曲线,曲线的回归方程为ΔF=21.968C+4.176 9,铁含量在0.02~4.50 μg/25 mL 范围内与 ΔF 呈良好的线性关系(见图5),相关系数为 γ=0.999 2,以空白的3倍标准偏差除以工作曲线的斜率得本方法的检测下限为0.006 μg/25 mL。
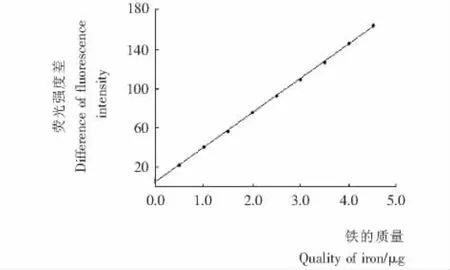
图5 标准曲线Figure 5 Standard curve
3 样品分析及回收率测定
将花生置于105℃干燥箱中烘至恒重后研磨成粉末,准确称取1.000 0 g粉末样品于微波消解罐中,加入浓硝酸10 mL,30%过氧化氢2.0 mL,按照程序升温进行消解(微波程序升温为:0~60℃,升温2 min,停留1 min;60~120℃,升温6 min,停留3 min;120~180℃,升温6 min,停留10 min,微波功率为800 W,效率为100%),消解完毕后取出罐体,冷却至室温,将消解液转移至小烧杯中低温加热蒸至近干,取下加水溶解盐类,然后转移至50 mL容量瓶中,稀释至刻度摇匀备用。
移取5.00 mL样品试液于25 mL比色管中,其余所加试剂按试验方法进行。用1 cm比色皿,以水作参比,于波长λex/λem=352 nm/580 nm处测量样品溶液的荧光值F,计算荧光猝灭值ΔF,同时做加标回收试验,试验结果见表1。
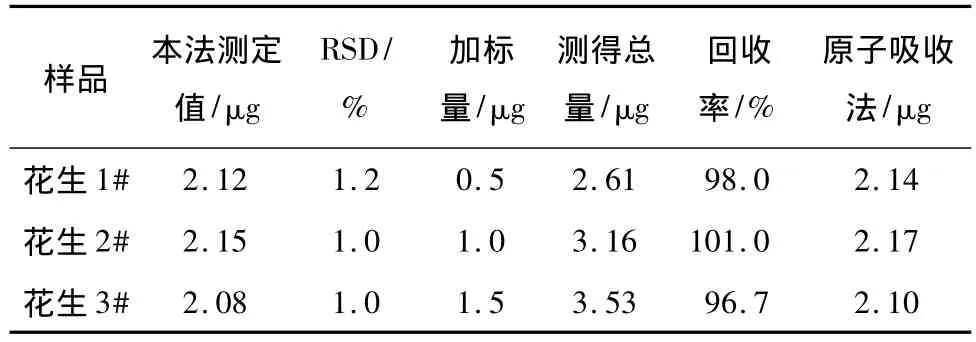
表1 样品测定结果Table 1 Determination results of samples(n=5)
4 结论
本试验对Fe(Ⅲ)—KI—RB缔合物荧光猝灭体系进行了研究,优化了体系的测量条件,并将该方法用于花生中微量铁的测定,结果与原子吸收法[14]基本一致;方法具有较高的灵敏度,检测下限低,可用于水样、食品及中药材中微量铁的测定;由于体系所用的RB试剂具有较强的荧光特性,因此,要求测量者必须具有熟练的加液操作技能,否则会给样品测定带来误差。
1 吕金荣.微量元素铁与人体健康[J].微量元素与健康研究,2006,23(3):63 ~64.
2 孙长峰,郭娜.微量元素铁对人体健康的影响[J].微量元素与健康研究,2011,28(2):64 ~66.
3 孙德生,胡蓉.微量元素与人体健康[J].江西化工,2003(4):46~51.
4 朱明扬,余莲芳,任欢,等.8种干制水产品中7种金属元素含量的检测分析[J].食品与机械,2012,28(6):99~102.
5 Anzano J M,Gonzalez P.Determination of iron and copper in peanuts by flame atomic absorption spectrometry using acid digestion[J].Microchem.J.,2000,64(2):141~145.
6 秦瑜丽.分光光度法测定铁质叶酸片中铁元素的含量[J].食品与机械,2013,29(1):99 ~101.
7 李云,王晨雪,尚游,等.循环伏安法测定溶液中Fe3+和Fe2+浓度比[J].冶金分析,2011,31(3):72~75.
8 余萍,丁连明,孙娜.反相高效液相色谱法测定镍(Ⅱ)和铁(Ⅲ)[J].冶金分析,2010,30(1):65 ~68.
9 马红燕,孙雪花,田锐,等.基于酪氨酸荧光猝灭的荧光光度法测定水样和奶粉中痕量铁[J].理化检验—化学分册,2009,45(5):575~577.
10 Wei Tai-bao,Liu Jun,Yao Hong,et al.Selective chemosensor of Fe3+based on fluorescence quenching by 2,2'-bisbenzirnidazole derivativein aqueous media[J].Chin.J.Chem.,2013,31:5l5 ~519.
11 Hossam E M Sayour,Taha M A Razek,Karima F Fadel.Flow injection spectrofluorimetric determination of iron in industrial effluents based on fluorescence quenching of 1-naphthol-2-sulfonate[J].J.Fluoresc,2011,21:1 385 ~1 391.
12 樊玮鑫,李生泉,郝桂青,等.硫堇同步荧光猝灭法测定痕量铁(III)[J].光谱实验室,2012,29(4):2 109~2 112.
13 李瑜,张振新.铁猝灭荧光分析法测定环丙沙星的研究与应用[J].应用化工,2014,43(5):933~935.
14 中华人民共和国卫生部.GB/T 5009.90—2003食品中铁、镁、锰的测定[S].北京:中国标准出版社,2003.

