窄带成像结合放大内镜技术观察胃表面微血管在早期胃癌诊断中的价值
牛昊书,陈海华,伏亦伟,崔 宏,陈 吉,杨 洁
1.内蒙古包钢医院消化内科,内蒙古 包头014010;2.运城市中心医院消化内科;3.泰州市人民医院消化内科
近年来,内镜技术发展迅速,窄带成像(narrow band imaging,NBI)作为消化内镜领域的重大发展,当其结合放大内镜(magnifying endoscopy with narrow band imaging,ME-NBI)可使内镜医师极大提高对黏膜微血管及微结构形态的观察能力,显著提高临床对早期胃肠道肿瘤的诊治水平。大量研究表明ME-NBI 可显著提高早期胃癌的发现率[1],但因为胃黏膜组织结构的特殊性,目前国际尚缺乏NBI 诊断胃早癌的统一标准,本文从ME-NBI 观察黏膜表面微血管形态的角度,探讨其对区别胃低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN)、分化型腺癌及未分化型腺癌的临床价值。
1 资料与方法
1.1 一般资料 选取2010 年3 月-2015 年2 月于内蒙古包钢医院内镜中心常规胃镜检查发现有糜烂、斑块、颜色异常、隆起或凹陷等可疑病灶者200 例,男125例,女75 例;年龄35 ~60 岁,平均年龄(51.0 ±3.7)岁,症状表现为上腹痛、腹胀、消瘦、反酸、烧心等。
1.2 器械与方法 采用Olympus GIF-H260Z 放大内镜,主机为Olympus CV-260SL,光源为Olympus CLV-260SL,检查前5 min 口服利多卡因胶浆行口咽部局部麻醉。先行普通胃镜检查,镜下胃内喷洒消泡剂去除黏液与泡沫,胃内发现可疑病变如糜烂、斑块、颜色异常、微隆或凹陷等,切换ME-NBI 观察黏膜微血管形态,于病变处活检标本送病理。
1.3 胃黏膜表面微血管形态分型 参照Nakayoshi 分型标准[2],将微血管形态分为2 型:精细网格型(finenetwork pattern,FNP)、螺 旋 型(corkscrew pattern,CSP)。参照Yokoyama 分型标准[3],将微血管形态分为2 型:小叶内环型1(intra-lobular loop pattern 1,ILL-1)、小叶内环型2(intra-lobular loop pattern 2,ILL-2,见图1 ~2)。

图1 胃黏膜Nakayoshi 微血管形态分型Fig 1 Nakayoshi type of microvascular architecture
1.4 病理诊断 活检组织根据2000 年WHO 对胃癌组织分型[4]分为分化型腺癌和未分化型腺癌;根据国际癌症研究机构(IARC)于2000 年版“消化系统肿瘤病理学和遗传学”[5]将癌前病变上皮内瘤变分为LGIN 和高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),因HGIN 与胃早癌的划分标准尚存争论,因此本研究仅选取LGIN 作为癌前病变研究对象。
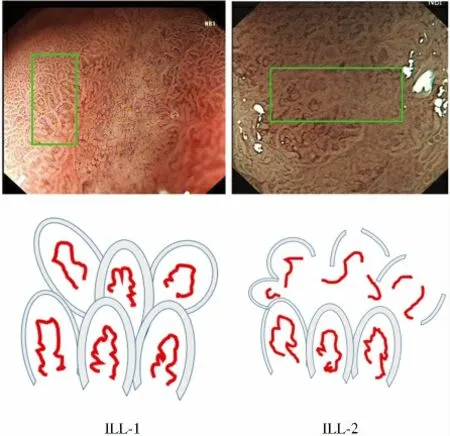
图2 胃黏膜Yokoyama 微血管形态分型Fig 2 Yokoyama type of microvascular architecture
1.5 统计学分析 采用SPSS 21.0 软件包进行统计分析,计数资料组间率的比较使用χ2检验及Fisher 精确检验,P <0.05 为差异有统计学意义。
2 结果
2.1 病理学结果 200 例患者中,36 例确诊为胃早癌(Ⅰ型6 例,Ⅱa 型4 例,Ⅱb 型3 例,Ⅱc 型10 例,Ⅱa+Ⅱc 型13 例),其中分化型腺癌20 例,未分化型腺癌16 例,LGIN 患者32 例。
2.2 微血管形态分型与病理学结果比较 分化型腺癌组中,FNP 型2 例(10%)、ILL-1 型12 例(60%)、ILL-2 型5 例(25%)、CSP 型1 例(5%);ILL-1 型的发生率显著高于ILL-2 型(χ2=5.013,P <0.05);未分化型腺癌组中,ILL-2 型7 例(43.7%),CSP 型9 例(56. 3%),CSP 型发生率高于ILL-2 型,但差异无统计学意义(χ2=0.5,P >0.05),未发现FNP 型及ILL-1型;LGIN 组中,FNP 型20 例(62.5%)、ILL-1 型12 例(37.5%),但差异无统计学意义(χ2=4.0,P >0.05),未发现ILL-2 型及CSP 型。采用Fisher 精确检验发现,FNP、CSP、ILL-1、ILL-2 型在不同分化程度病变中的差异有统计学意义(χ2=61.894,P <0.05)。
2.3 微血管形态分型与表面形态的比较 100%的FNP 型及80%的CSP 型出现在凹陷型病变中;50%的ILL-1 型出现在平坦及平坦隆起型病变中,50%存在于隆起型病变中;91.7%的ILL-2 型存在于平坦及平坦隆起型病变中(Ⅱa+Ⅱc 型)(见表1)。
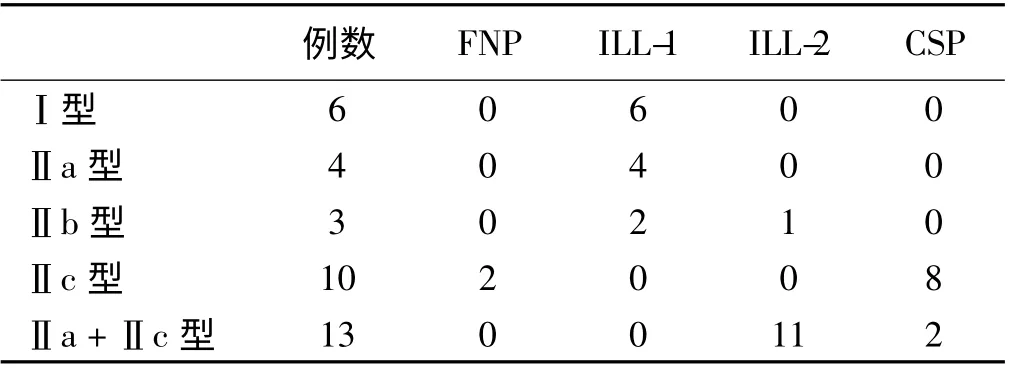
表1 ME-NBI 与表面形态的关系Tab 1 Relationship between ME-NBI and microvascular architecture
3 讨论
近年研究表明,黏膜的微表面结构及微血管形态均会随黏膜病变而发生形态改变[6],由于肿瘤细胞和血管的关系,早期癌变时微血管的形态、密度也会随之变化[7],这对胃癌的早期诊断极其重要。NBI 技术可通过强化观察微血管形态从而达到对胃癌早期发现的目的。
目前国际上针对ME-NBI 在早期胃癌诊断中的研究和标准很多[8],但一直没有达成如食道的上皮乳头内毛细血管袢分型(intrapapillary capillary loops,IPCL)[9]和结肠的工藤腺管开口分型(pit pattern)[10]一样的共识,其原因可能与胃内不同部位微血管形态和微表面结构具有多样性和复杂性[11],及不同胃癌形态分型的微血管形态和微表面结构特点各不相同有关。
自放大内镜出现以来,胃小凹形态所构成的MS就一直是学者们的研究重点,Sakaki 等[12]将胃小凹分为点状(A 型)、短小棒状(B 型)、树枝或条纹状(C型)、斑片或网格状(D 型)及绒毛状(E 型)5 型,分别对应正常、慢性炎症、萎缩和肠化生的不同程度,奠定了微表面结构形态分类的基础,但其准确率、特异率及敏感率较低,且缺乏明确的早癌诊断标准,Tanaka等[13]提出了新的胃小凹分型:Ⅰ型,大小及形态规则的小圆点状小凹;Ⅱ型,短棒状;Ⅲ型,绒毛或脑回状小凹;Ⅳ型,大小及形态不规则的Ⅰ、Ⅱ和Ⅲ型;Ⅴ型,结构破坏的Ⅰ、Ⅱ和Ⅲ型。其研究发现肿瘤周围黏膜的小凹形态主要为Ⅲ型,且大部分为肠化生,隆起型腺瘤表面以Ⅱ或Ⅲ型为主,凹陷型则以Ⅳ型为主,隆起型癌以Ⅲ型(42.9%)或Ⅳ型(57.1%)为主,凹陷型则以Ⅳ型(86.2%)或Ⅴ型(30.0%)为主,印戒细胞癌和低分化癌则表现为Ⅴ型(100%),其结果表明Ⅳ型和Ⅴ型的敏感度、特异度、阳性及阴性预测度分别为94.4%、95.6%、91.9%和97.0%,但该标准忽略了微血管形态改变对诊断早癌的影响,如仅有微血管形态改变而微表面结构无结构破坏时,则易漏诊。
应用ME-NBI 技术诊断早癌,目前国内和国际上采用最多的是Yao 等[14]提出的“VS(vessel plus surface)”分类标准,他采用ME-NBI 观察微血管形态和微表面结构,将其分为规则、不规则和缺失三类,同时明确胃癌的镜下诊断标准为“伴有分界线的不规则微血管形态”或“伴有分界线的不规则微表面结构”,最近一项大规模多中心研究[15]提示该标准敏感度和特异度分别达到95.0%和96.5%。Kaise 等[16]用MENBI 观察黏膜结构(fine mucosal structure,FMS)、微血管的扩张情况及均匀性,制定了相似的早癌诊断标准:FMS 消失、微血管扭曲不均匀扩张及形态的不一致。但其特异度为85%,敏感度为72%,均低于VS 分类标准。我们考虑可能由于炎症及白色不透明物质(white opaque substance,WOS)[17]对观察的影响所致。对于早癌,仅仅诊断仍不够,随着内镜下黏膜切除术(endoscopic mucosal resection,EMR)及内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)的广泛开展,如果能及早判断病理分化程度和浸润深度,则对治疗方案的选择有重要的指导作用,此时,观察与肿瘤分化及浸润深度有密切关系的微血管形态的价值便显现出来。
Nonaka 等[18]在VS 标准基础上对微表面结构和微血管形态进行细分组合,分为5 型,Ⅰ~Ⅱ型79%为腺瘤,Ⅲ~Ⅴ型93% 为高分化腺癌。Nakayoshi等[2]采用ME-NBI 对比观察分化型和未分化型腺癌时发现,66.1%(72/109)的分化型腺癌病例表面微血管形态呈FNP 型,85.7%(48/56)的未分化型腺癌表面微血管形态呈CSP 型,提示不同分化腺癌其微血管形态不同。但在本研究中,仅有10%分化型腺癌患者微血管形态呈FNP 改变,究其原因,Nakayoshi 等[2]的研究中均选择Ⅱc 病例,而本研究中Ⅱc 患者仅占50%,且所有FNP 均出现于Ⅱc 病例中,提示FNP 改变可能与腺癌的凹陷或隆起类型相关,因本实验纳入病例较少,还需大样本试验以证实。在本研究中,56.3%(9/16)的未分化型腺癌微血管形态表现为CSP,占Ⅱc 病例80%(8/10),与同类研究结果相近。有高达23.6%(39/165)的病变微血管形态在Nakayoshi 的研究中未定型,对此,Yokoyama 等[3]基于不规则微血管形态及微表面结构,将此类病例微血管形态分成ILL-1(环形微血管位于绒毛样表面结构中)和ILL-2(绒毛样结构破坏)2 型,研究中发现59.6%(133/223)的分化型腺癌表现为ILL-1 型,而41.2%未分化型腺癌为ILL-2,这与我们的研究结果非常相近。本研究发现,CSP 和ILL-2 主要存在于未分化型腺癌中,而FNP 和ILL-1 主要存在于分化型腺癌中和LGIN 中,运用ME-NBI 观察微血管形态,有助于辨别病变的分化程度。另外,ILL-1 及ILL-2 主要存在于平坦隆起型病变中,而FNP 及CSP 主要存在于凹陷型病变中,提示微血管形态与病变形态相关,如能进一步进行大样本研究,将对病变的镜下切除治疗方案选择具有参考意义。
目前,通过应用ME-NBI 观察微血管形态及微表面结构来评估病变浸润深度的报道很少,最近Kikuchi等[19]研究发现,如病变处存在有血管直径3 倍扩张于周围规则微血管,则有33.3%(6/18)为黏膜下癌,对比无此改变的9. 9% (10/101),差异有统计学意义(P <0.05),以此作为诊断黏膜下癌的标准,其准确度、敏感度、特异度、阳性预测度及阴性预测度分别为81.5%、37.5%、88.3%、33.3%和90.1%,此标准准确度及特异度较高,但敏感度低,我们的研究中,因行ESD 切除治疗的病例较少,所以未能进行微血管形态与黏膜下癌的相关性分析,是否能通过微血管形态的观察来判断肿瘤与浸润深度的关系尚需进一步研究。
本研究中,我们通过ME-NBI 技术发现微血管形态与胃早癌的病理分化程度显著相关,如能进一步研究ME-NBI 下微血管形态、微表面结构形态与早期胃癌的分化程度及浸润深度的关系,将对提高临床早期胃癌诊治水平带来帮助。
[1] Uedo N,Fujishiro M,Goda K,et al. Role of narrow band imaging for diagnosis of early-stage esophagogastric cancer:current consensus of experienced endoscopists in Asia-Pacific region [J]. Dig Endosc,2011,23 Suppl 1:58-71.
[2] Nakayoshi T,Tajiri H,Matsuda K,et al. Magnifying endoscopy combined with narrow band imaging system for early gastric cancer:correlation of vascular pattern with histopathology(including video)[J]. Endoscopy,2004,36(12):1080-1084.
[3] Yokoyama A,Inoue H,Minami H,et al. Novel narrow-band imaging magnifying endoscopic classification for early gastric cancer[J]. Dig Liver Dis,2010,42(10):704-708.
[4] Kleihues P,Sobin LH. World Health Organization classification of tumors[J]. Cancer,2000,88(12):2887.
[5] Hamilton SR,Aaltonen LA. Pathology and genetics of tumours of the digestive system[M]. Lyon:IARC Press,2000:8.
[6] Tajiri H,Matsuda K,Fujisaki J. What can we see with the endoscope?Present status and future perspectives [J]. Digestive Endoscopy,2002,14(4):131-137.
[7] Yao K,Oishi T,Matsui T,et al. Novel magnified endoscopic findings of microvascular architecture in intramucosal gastric cancer[J]. Gastrointest Endosc,2002,56(2):279-284.
[8] Li HY,Ge ZZ,Fujishiro M,et al. Current clinical applications of magnifying endoscopy with narrow band imaging in the stomach[J].Diagn Ther Endosc,2012,2012:271914.
[9] Inoue H,Honda T,Yoshida T,et al. Ultra-high magnification endoscopy of the normal esophageal mucosa [J]. Digestive Endoscopy,1996,8(2):134-138.
[10] Kudo S,Tamura S,Nakajima T,et al. Diagnosis of colorectal tumorous lesions by magnifying endoscopy [J]. Gastrointest Endosc,1996,44(1):8-14.
[11] Yao K. Gastric microvascular architecture as visualized by magnifying endoscopy:body and antral mucosa without pathologic change demonstrate two different patterns of microvascular architecture[J]. Gastrointest Endosc,2004,59(4):596-597.
[12] Sakaki N,Iida Y,Okazaki Y,et al. Magnifying endoscopic observation of the gastric mucosa,particularly in patients with atrophic gastritis[J]. Endoscopy,1978,10(4):269-274.
[13] Tanaka K,Toyoda H,Kadowaki S,et al. Features of early gastric cancer and gastric adenoma by enhanced-magnification endoscopy[J]. J Gastroenterol,2006,41(4):332-338.
[14] Yao K,Anagnostopoulos GK,Ragunath K. Magnifying endoscopy for diagnosing and delineating early gastric cancer [J]. Endoscopy,2009,41(5):462-467.
[15] Ezoe Y,Muto M,Uedo N,et al. Magnifying narrowband imaging is more accurate than conventional white-light imaging in diagnosis of gastric mucosal cancer[J]. Gastroenterology,2011,141(6):2017-2025. e3.
[16] Kaise M,Kato M,Urashima M,et al. Magnifying endoscopy combined with narrow-band imaging for differential diagnosis of superficial depressed gastric lesions[J]. Endoscopy,2009,41(4):310-315.
[17] Yao K,Iwashita A,Tanabe H,et al. White opaque substance within superficial elevated gastric neoplasia as visualized by magnification endoscopy with narrow-band imaging:a new optical sign for differentiating between adenoma and carcinoma [J]. Gastrointest Endosc,2008,68(3):574-580.
[18] Nonaka K,Arai S,Ban S,et al. Prospective study of the evaluation of the usefulness of tumor typing by narrow band imaging for the differential diagnosis of gastric adenoma and well-differentiated adenocarcinoma[J]. Dig Endosc,2011,23(2):146-152.
[19] Kikuchi D,Iizuka T,Hoteya S,et al. Usefulness of magnifying endoscopy with narrow-band imaging for determining tumor invasion depth in early gastric cancer[J]. Gastroenterol Res Pract,2013,2013:217695.

