P53 基因密码子72 多态性与大肠癌易感性的Meta 分析
王明珠,谭诗云,王 军
武汉大学人民医院消化内科,湖北 武汉430060
大肠癌是癌症的第三大最常见的类型,近几年,大肠癌在中国的发病率逐年上升,城市地区占总癌症比例约为6. 5%,农村地区占总癌症的比例约为4.6%[1]。男性和女性大肠癌的发病率分别居所有恶性肿瘤的第3 位、第2 位;而其死亡率分别居所有男性和女性恶性肿瘤的第4 位、第3 位[2]。与大肠癌发生相关的因素目前尚未完全明确,但流行病学研究揭示,微量元素缺乏、吸烟、饮酒及遗传等与大肠癌的发展相关,而遗传因素又是诸多因素中与大肠癌的发生、发展最为密切的一个[3]。
P53 是一种肿瘤抑制基因,在调节细胞生长、分裂及细胞凋亡中起着不可替代的作用[4]。它位于染色体17p13 上,在人类所有类型的癌症中,是一种最常见的突变基因[5]。除了突变外,野生型P53 基因多态性也可以改变其功能,在一般人群中,与癌症发展相关的常见多态性是P53 基因密码子72 所编码的的精氨酸(CGC)被脯氨酸(CCC)替代[6]。氨基酸序列的改变,可以改变P53 蛋白结合靶基因中反应元件的能力,并改变翻译后修饰的识别基序,或改变P53 的稳定性及与其他蛋白的相互作用[7]。这种变化可能有助于肿瘤的发展,且预后不良[8]。
在过去的20 年中,大量的病例对照研究探讨了人P53 基因密码子72 多态性与人类大肠癌发病风险之间的关联。然而,这些研究的结论不尽相同。2010 年-2011 年有两个荟萃分析曾发表评价P53 基因密码子72 多态性与大肠癌发病风险之间的关联。这两项研究发现,这种多态性与大肠癌风险无相关性,并建议进一步研究来证实这些结果。然而,这两项研究有一定的局限性,如样本量相对较小,而且很少有研究是基于亚洲人群。此后,也有一些研究相继发表。为了更全面的估计P53 基因密码子72 多态性与大肠癌之间的关联风险,我们收集了25 个病例对照进行了一项荟萃分析研究,来评估它们之间的联系。
1 材料与方法
1.1 材料 计算机检索PubMed、Medline、EMbase、CBM、CNKI、万方和维普等数据库。中文检索以P53、TP53、密码子72、大肠癌、基因多态性为检索词,英文检索以P53、TP53、codon 72、mutation、variation、polymorphism、colorectal cancer 等为检索词,无语言限制,搜索由两位研究人员独立进行,检索时间从建库至2014 年2 月,同时辅以手工检索。
1.2 方法
1.2.1 纳入和排除标准:纳入标准:(1)研究是基于无相关的个人;(2)必须是病例对照研究;(3)必须提供大肠癌的病例数和对照数;(4)必须提供病例组及对照组Arg/Arg、Arg/Pro 和Pro/Pro 各基因型频数,以计算OR 值及95%CI,若文献中无基因型频率,联系作者后获取的方可纳入研究。排除标准:(1)研究重复发表或者无可用数据报道;(2)未提供基因型频率且向作者索取无果;(3)研究对象非人类;(4)控制组的基因分布不符合Hardy-Weinberg 平衡(HWE)。
1.2.2 资料提取:由两名研究者独立对文献进行筛选并核对,不一致的地方通过商讨或第三方介入协调。提取的资料主要有第一作者的名字、发表年份、国家、病例组和对照组Arg/Arg、Arg/Pro 和Pro/Pro 各基因型频数、对照组H-W 平衡检验值(P 值),P <0.05 认为不符合H-W 平衡规律)。
1.3 统计学分析 采用Cochrane 协作网提供的Rev-Man 5.2 版软件。(1)异质性的检验:用Q 检验和I2检验,当P≥0.1、I2<50%时,认为不存在统计学异质性,用固定效应模型进行Meta 分析;当P <0.10,I2>50%时各研究结果不同质,可使用敏感性分析或分层分析等异质性处理方法,使之达到同质后,再用固定效应模型;若经过异质性分析和处理后,多个同类研究的结果仍然不具有同质性时,可选择随机效应模型。(2)H-W 遗传平衡检验:其方法是利用在线软件(http://ihg. gsf. de/cgi-bin/hw/hwa1. pl)进行计算,P >0.05 说明群体是随机婚配,符合H-W 平衡,可以用于遗传学分析,否则剔除掉。(3)偏倚的评价:以漏斗图的对称性及宽度范围来评价。
2 结果
2.1 文献检索结果 初检获得文献108 篇,无中文文献,全部为英文文献,通过阅读题目和摘要剔除67 篇(其中包括研究非大肠癌类文献44 篇,重复21 篇,Meta 分析2 篇),剩余41 篇通过阅读全文剔除14 篇(均为机制研究),初纳入文献27 篇,因Sotamaa 等研究包括美国及芬兰人口的两个独立研究,合并分析时将其视为两个研究,即27 篇[9-35]文献(28 个研究)。通过H-W 遗传平衡检验计算,其中有3 个研究[33-35](Sameer 等PHWE = 0. 025;Dakouras 等PHWE =0.002;Sjalander 等PHWE =0.049)的P 值<0.05,不符合H-W 平衡规律,将其剔除,最终纳入24 篇[9-32]文献(25 个研究),其中有6 753 例患者,8 562 例对照者。纳入研究的一般情况如表1 所示。
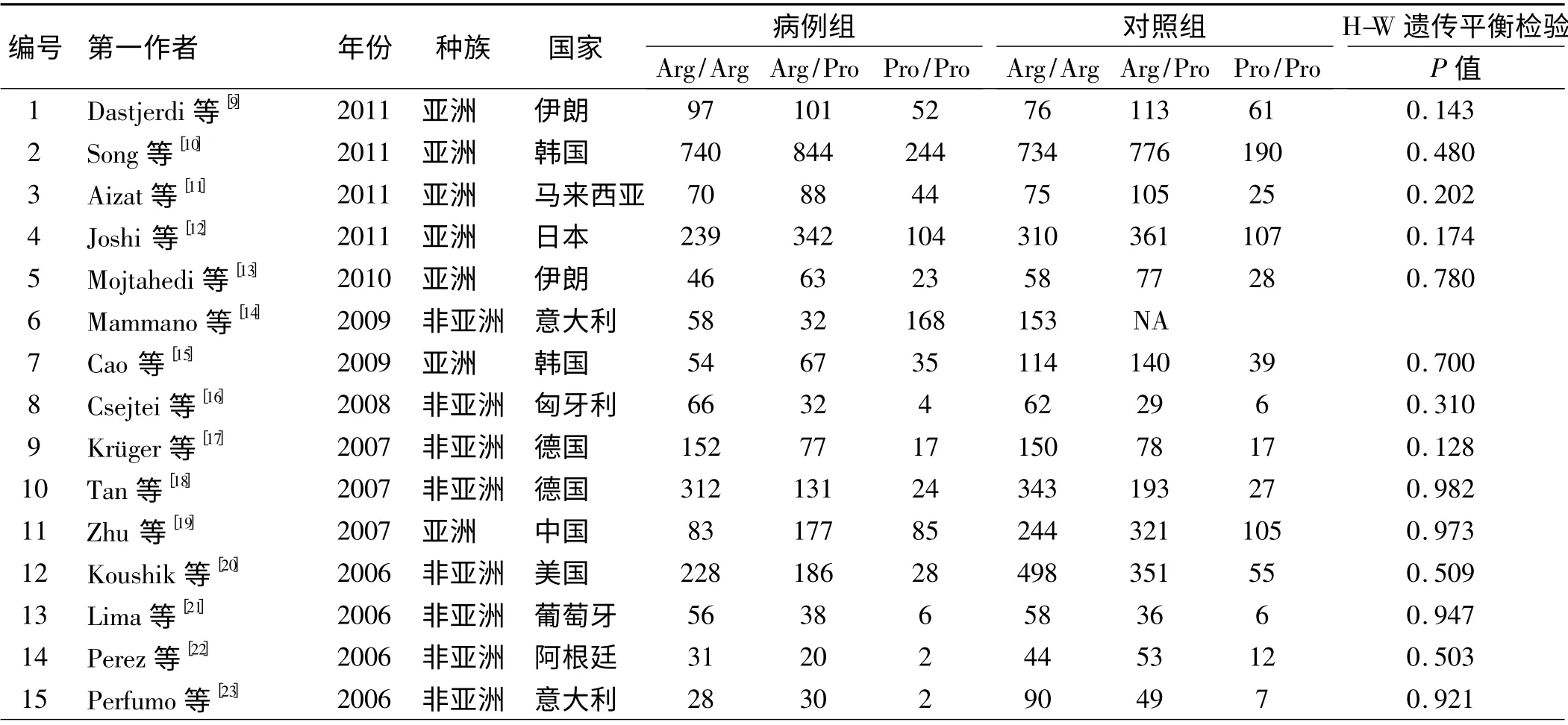
表1 纳入文献的基本情况Tab 1 Characteristics of studies included in the Meta-analysis
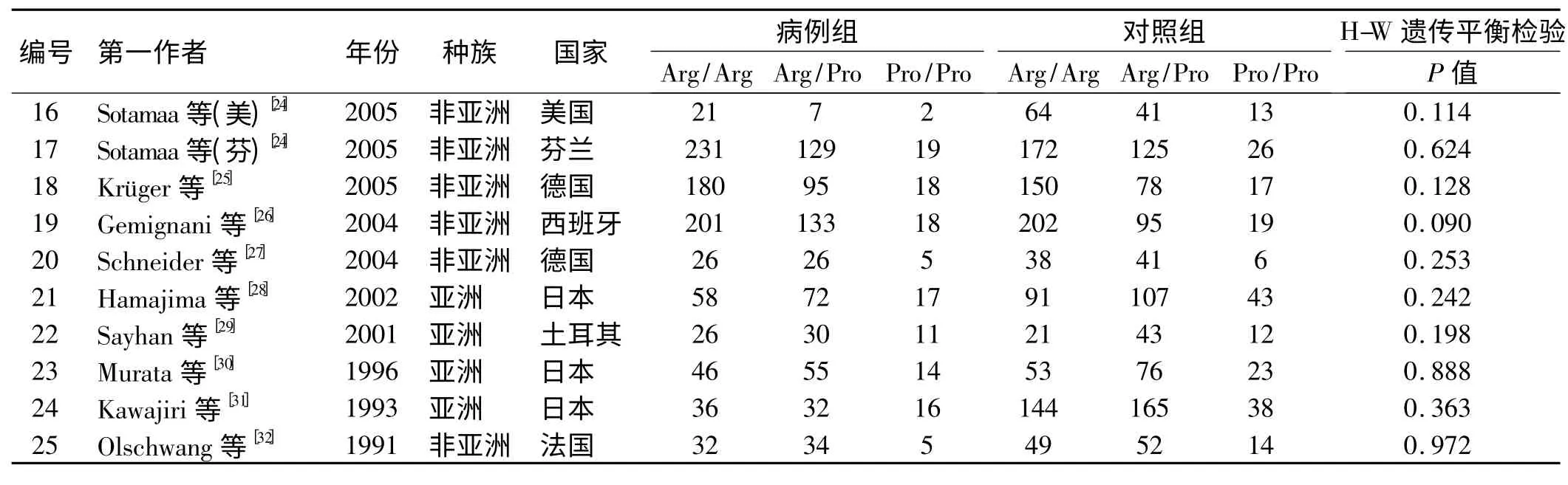
续表1
2.2 Meta 分析结果 对纳入的25 个研究合并进行Meta 分析,结果如表2 所示,4 个模型中,由于显性模型(I2=57%)及PP vs AA 模型(I2=58%)存在异质性,采用随机效应模型进行数据合并,其余两个模型不存在异质性,因此,采用固定效应模型进行数据合并。结果表明隐性模型PP vs AP +AA 与大肠癌发生风险有明显相关性(隐性模型:OR=1.13,95% CI:1.02 ~1.26,P=0.02),其余基因模型与大肠癌发生风险无明显相关性(显性模型:OR =0.99,95% CI:0.88 ~1.11,P=0.84;PP vs AA:OR=1,95% CI:0.82 ~1.22,P=1.00;AP vs AA:OR=1.04,95% CI:0.96 ~1.11,P=0.33)(见表2、图1)。
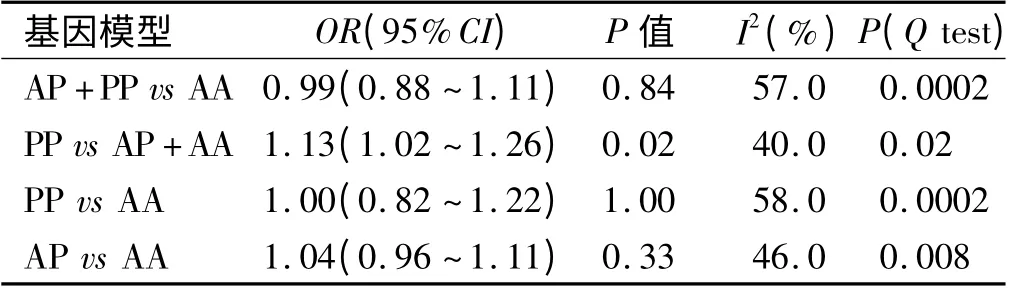
表2 P53 基因密码子72 多态性与大肠癌易感性的Meta 分析Tab 2 Meta-analysis of the P53 codon 72 polymorphism and colorectal cancer risk
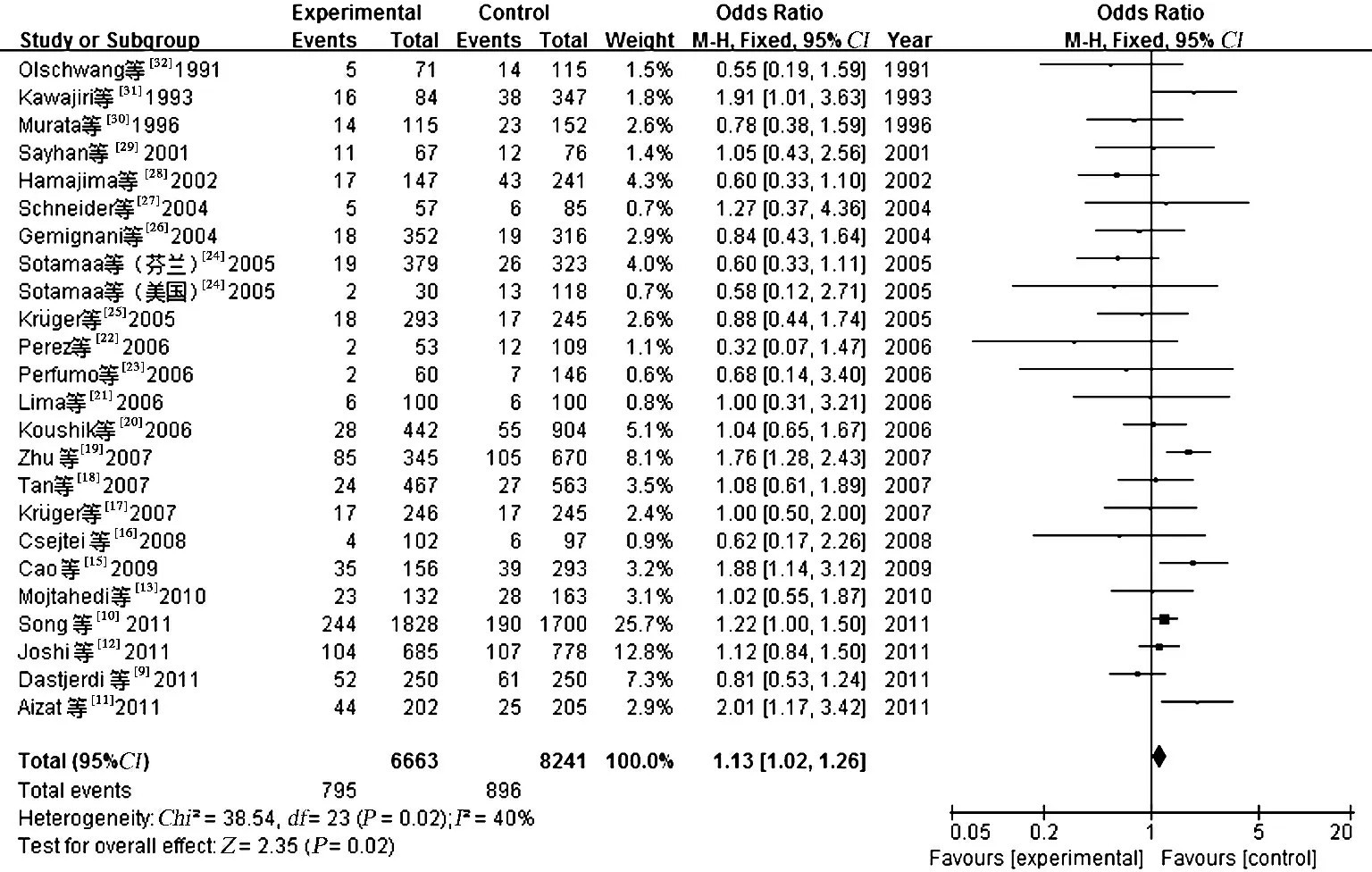
图1 总人群P53 基因密码子72 多态性与大肠癌风险相关性隐性遗传模型的Meta 分析Fig 1 Forest plots for the association of the P53 gene codon 72 polymorphism and colorectal cancer risk in the recessive model
2.3 敏感性分析 对各项研究进行依次剔除,每次仅剔除1 篇,发现剔除Zhu 等[19]的研究后,其研究间的异质性也随之消失,但是各个模型的合并效应量OR值无明显变化,表明我们得到的结果是稳定的,具有可靠性。
2.4 发表偏倚分析 从漏斗图的对称性来看,隐性模型及PP vs AA 模型不对称,可能存在潜在的发表偏倚。而显性模型及AP vs AA 模型较为对称,且分布范围较为狭窄,集中在上部,表明其精度较高,不存在发表偏倚(见图2)。
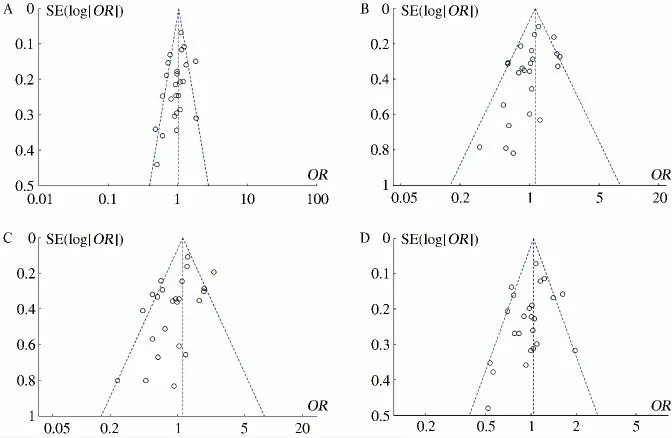
图2 P53 基因密码子72 多态性与大肠癌易感性Meta 分析发表偏倚风险结果 A:显性模型;B:隐性模型;C:PP vs AA 模型;D:AP vs AA 模型Fig 2 Funnel plot for publication bias test between the P53 gene codon 72 polymorphism and colorectal cancer risk A:dominant model;B:recessive model;C:PP vs AA model;D:AP vs AA model
3 讨论
P53 是一种重要的肿瘤抑制基因,在过去20 年里,已被广泛研究,根据以往国内外报道,P53 基因突变与肺癌、宫颈癌、乳腺癌及前列腺癌的发生均有有一定的关系。自从Olschwang 等[32]在1991 年第一次研究P53 基因密码子72 多态性与大肠癌风险之间的关系,此后,关于两者关系的文章被相继报道,然而结果却不尽相同。先前,Wang 及Tang 等[36-37]分别在2010年及2011 年发表了荟萃分析,研究结果表明P53 基因密码子72 多态性与大肠癌风险无相关性。然而这两个研究均存在一定的局限性,前者没有剔除不符合HW 遗传平衡检验的研究(纳入了34、35 两篇文献),且前者没有研究隐性模型,后者的研究虽然避免了前者的缺点,但是样本含量较少(病例组3 603 个,对照组5 524个)。因此,更新的荟萃分析是必要的。
该项荟萃分析样本含量较之前明显增加,统计效能也大大提高。研究结果表明隐性模型PP vs AP +AA 中P53 基因密码子与大肠癌发生风险有明显相关性,其余模型中均未发现大肠癌风险有关。该结果与前两次研究[36-37]并不完全一致。分层分析显示,在亚洲人群中,合并OR 值为1.07(95%CI:0.98 ~1.18),白种人中,合并OR 值为0.99 (95%CI:0.88 ~1.10),该结果表明P53 基因密码子72 多态性和大肠癌易感性,与种族无关。荟萃分析的结果受对照组选择的影响,不同的对照组来源可能是一个混杂因素,对我们的研究结论会产生影响[38]。如一些研究中使用健康人群作为对照组,而其他研究选择无大肠癌住院患者作为对照组。为了消除对照源不同的混杂因素,我们对对照源进行亚组分析。研究结果表明,P53 基因密码子72 多态性与大肠癌易感性也无显著相关性,这证实了我们整体结果的可靠性。
本文尚存在以下不足:(1)文献存在发表偏倚的可能性;(2)未考虑基因与环境的相互作用;(3)我们没有调整OR 值,可能存在年龄、性别、肥胖、吸烟、饮酒等方面的影响。因此结论的可靠性需要考究。
总之,这项荟萃分析表明,P53 基因密码子72 多态性与大肠癌易感性之间存在相关性。然而受诸多混杂因素的影响,以上结论需要大样本、多中心的病例对照研究来证实,此外,期望在未来,基因与环境的相互作用能得到进一步研究,以更全面了解P53 基因密码子72 多态性与大肠癌风险之间的关系。
[1] Zhao P,Dai M,Chen W,et al. Cancer trends in China[J]. Jpn J Clin Oncol,2010,40(4):281-285.
[2] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90.
[3] Risch N. The genetic epidemiology of cancer:interpreting family and twin studies and their implications for molecular genetic approaches[J]. Cancer Epidemiol Biomarkers Prev,2001,10(7):733-741.
[4] Levine AJ. p53,the cellular gatekeeper for growth and division[J].Cell,1997,88(3):323-331.
[5] Hollstein M,Sidransky D,Vogelstein B,et al. p53 mutations in human cancers[J]. Science,1991,253(5015):49-53.
[6] Sreeja L,Syamala V,Raveendran PB,et al. p53 Arg72Propolymorphism predicts survival outcome in lung cancerpatients in Indian population[J].Cancer Invest,2008,26(1):41-46.
[7] Li Y,Prives C. Are interactions with p63 and p73 involved in mutant p53 gain of oncogenic function?[J]. Oncogene,2007,26(15):2220-2225.
[8] Katkoori VR,Jia X,Shanmugam C,et al. Prognostic significance of p53 codon 72 polymorphismdiffers with race in colorectal adenocarcinoma[J]. Clin Cancer Res,2009,15(7):2406-2416.
[9] Dastjerdi MN. TP53 codon 72 polymorphism and P53 protein expression in colorectal cancer specimens in Isfahan[J]. Acta Med Iran,2011,49(2):71-77.
[10] Song HR,Kweon SS,Kim HN,et al. p53 codon 72 polymorphism in patients with gastric and colorectal cancer in a Korean population[J]. Gastric Cancer,2011,14(3):242-248.
[11] Aizat AA,Shahpudin SN,Mustapha MA,et al. Association of Arg72Pro of P53 polymorphism with colorectal cancer susceptibility risk in Malaysian population[J]. Asian Pac J Cancer Prev,2011,12(11):2909-2913.
[12] Joshi AM,Budhathoki S,Ohnaka K,et al. TP53 R72P and MDM2 SNP309 polymorphisms and colorectal cancer risk:the Fukuoka Colorectal Cancer Study[J]. Jpn J Clin Oncol,2011,41(2):232-238.
[13] Mojtahedi Z,Haghshenas MR,Hosseini SV,et al. p53 codon 72 polymorphism in stomach and colorectal adenocarcinomasin Iranian patients[J]. Indian J Cancer,2010,47(1):31-34.
[14] Mammano E,Belluco C,Bonafé M,et al. Association of p53 polymorphisms and colorectal cancer:modulation of risk and progression[J].Eur J Surg Oncol,2009,35(4):415-419.
[15] Cao Z,Song JH,Park YK,et al. The p53 codon 72 polymorphism and susceptibility to colorectal cancer in Korean Patients[J]. Neoplasma,2009,56(2):114-118.
[16] Csejtei A,Tibold A,Varga Z,et al. GSTM,GSTT and p53 polymorphisms as modifiers of clinical outcome in colorectal cancer[J]. Anticancer Res,2008,28(3B):1917-1922.
[17] Krüger S,Engel C,Bier A,et al. The additive effect of p53 Arg72Pro and RNASEL Arg462Gln genotypes on age of disease onset in Lynch syndrome patients with pathogenic germline mutations in MSH2 or MLH1[J]. Cancer Lett,2007,252(1):55-64.
[18] Tan XL,Nieters A,Hoffmeister M,et al. Genetic polymorphisms in TP53,nonsteroidal antiinflammatorydrugs and the risk of colorectal cancer:evidence for gene-environment interaction?[J]. Pharmacogenet Genomics,2007,17(8):639-645.
[19] Zhu ZZ,Wang AZ,Jia HR,et al. Association of the TP53 codon 72 polymorphism with colorectal cancer in a Chinese population[J]. Jpn J Clin Oncol,2007,37(5):385-390.
[20] Koushik A,Tranah GJ,Ma J,et al. p53 Arg72Pro polymorphism and risk of colorectal adenoma and cancer[J]. Int J Cancer,2006,119(8):1863-1868.
[21] Lima JM,Serafim PV,Silva ID,et al. Role of the genetic polymorphism of p53 (codon 72)gene in colorectal cancer[J]. Arq Gastroenterol,2006,43(1):8-13.
[22] Perez LO,Abba MC,Dulout FN,et al. Evaluation of p53 codon72 polymorphism in adenocarcinomas of the colon and rectum in La Plata,Argentina [J]. World J Gastroenterol,2006,12 (9):1426-1429.
[23] Perfumo C,Bonelli L,Menichini P,et al. Increased risk of colorectal adenomas in Italian subjects carrying the p53 PIN3 A2-Pro72 haplotype[J]. Digestion,2006,74(3-4):228-235.
[24] Sotamaa K,Liyanarachchi S,Mecklin JP,et al. p53 codon 72 and MDM2 SNP309 polymorphisms and age of colorectal cancer onset in Lynch syndrome [J]. Clin Cancer Res,2005,11 (19 Pt 1):6840-6844.
[25] Krüger S,Bier A,Engel C,et al. The p53 codon 72 variation is associated with the age of onset of hereditary non-polyposis colorectal cancer (HNPCC)[J]. J Med Genet,2005,42(10):769-773.
[26] Gemignani F,Moreno V,Landi S,et al. A TP53 polymorphism is associated with increased risk of colorectal cancer and with reduced levels of TP53 mRNA[J]. Oncogene,2004,23(10):1954-1956.
[27] Schneider-Stock R,Boltze C,Peters B,et al. Selective loss of codon 72 proline p53 and frequent mutational inactivation of the retained arginine allele in colorectal cancer[J]. Neoplasia,2004,6(5):529-535.
[28] Hamajima N,Matsuo K,Suzuki T,et al. No associations of p73 G4C14-to-A4T14 at exon 2 and p53 Arg72Pro polymorphisms with the risk of digestive tract cancers in Japanese [J]. Cancer Lett,2002,181(1):81-85.
[29] Sayhan N,Yazici H,Budak M,et al. P53 codon 72 genotypes in colon cancer. Association with human papillomavirus infection[J]. Res Commun Mol Pathol Pharmacol,2001,109(1-2):25-34.
[30] Murata M,Tagawa M,Kimura M,et al. Analysis of a germ line polymorphism of the p53 gene in lung cancer patients;discrete results with smoking history[J]. Carcinogenesis,1996,17(2):261-264.
[31] Kawajiri K,Nakachi K,Imai K,et al. Germ line polymorphisms of p53 and CYP1A1 genes involved in human lung cancer[J]. Carcinogenesis,1993,14(6):1085-1089.
[32] Olschwang S,Laurent-Puig P,Vassal A,et al. Characterization of a frequent polymorphism in the coding sequence of the Tp53 gene in colonic cancer patients and a control population [J]. Hum Genet,1991,86(4):369-370.
[33] Sameer AS,Shah ZA,Syeed N,et al. TP53 Pro47Ser and Arg72Pro polymorphisms and colorectal cancer predisposition in an ethnic Kashmiri population[J]. Genet Mol Res,2010,9(2):651-660.
[34] Sjalander A,Birgander R,Athlin L,et al. P53germ line haplotypes associated with increased risk for colorectal cancer[J]. Carcinogenesis,1995,16(7):1461-1464.
[35] Dakouras A,Nikiteas N,Papadakis E,et al. P53Arg72 homozygosity and its increased incidence in left-sided sporadic colorectal adenocarcinomas,in a Greek-Caucasian population [J]. Anticancer Res,2008,28(2A):1039-1043.
[36] Wang JJ,Zheng Y,Sun L,et al. TP53 codon 72 polymorphism and colorectal cancer susceptibility:a Meta-analysis[J]. Mol Biol Rep,2011,38(8):4847-4853.
[37] Tang NP,Wu YM,Wang B,et al. Systematic review and meta-analysis of the association between P53 codon 72 polymorphism and colorectal cancer[J]. Eur J Surg Oncol,2010,36(5):431-438.
[38] Benhamou S,Lee WJ,Alexandrie AK,et al. Meta-and pooled analysis of the effects of glutathione Stransferase M1 polymorphisms and smoking on lung cancer risk [J]. Carcinogenesis,2002,23(8):1343-1350.

