内镜下黏膜下层剥离术治疗上消化道黏膜高级别上皮内瘤变的价值及术后病理分析
刘鹏军,葛亚强,王晓燕,张利霞,许丽娟,徐 敏
1.江苏大学附属武进医院消化内科,江苏 常州213002;2.宿迁市第一人民医院消化科
上皮内瘤变(intraepithelial neoplasia,IN)包括低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN)和HGIN(high-grade intraepithelial neoplasia,HGIN),被认为是一种具有恶性潜能的非浸润性病变[1],其中HGIN 发展成为浸润癌的可能性更大。对上消化道黏膜HGIN 进行早期诊断和干预对降低食管癌和胃癌发病率和死亡率有重要的意义。本文回顾性分析2008 年6 月-2013 年3 月胃镜活检标本病理诊断为HGIN 的48 例患者,行内镜下黏膜下层剥离术(endoscopic submucosal dissection,ESD)治疗,评估手术情况,对比术前术后病理结果并进行术后随访,现报道如下。
1 资料与方法
1.1 一般资料 江苏大学附属武进医院消化科收治的48 例患者,术前经胃镜活检标本病理确诊为食管或胃黏膜HGIN,其中位于食管31 例,位于贲门胃底11例,位于胃窦6 例。男31 例,女17 例,平均年龄(62.5 ±7.8)岁。主要症状为反酸、嗳气、胸骨后不适、哽咽感或上腹部不适疼痛感。所有患者术前检查血常规、凝血常规、肝肾功能、心电图等无明显异常,术前1 周内未服用阿司匹林及氯吡格雷。所有患者术前告知手术风险及收益,签署知情同意书。
1.2 手术器械 Olympus GIF-H260 电子胃镜;Cook黏膜下注射针;KD-630L Flex 刀;Olympus Hook 刀和IT 刀;D201 系列透明帽;HX-610-135 内镜钛夹;ERBE ICC 200 高频电切装置及APC300 氩离子凝固器。
1.3 ESD 方法 所有患者术前常规禁食、禁饮。静脉注射丙泊酚诱导麻醉,常规气管插管。主要步骤:(1)染色:胃镜检查发现病灶后,食管病变给予3%卢戈氏液染色,胃部病变给予靛胭脂染色确定病变范围;(2)标记:使用针刀或Flex 刀在病灶边界外约0.5 cm处进行电凝标记;(3)黏膜下注射:将5 ml 靛胭脂、1 ml 肾上腺素及100 ml 生理盐水配成的混合溶液于病灶边界标记点外侧进行多点黏膜下注射,使病灶充分隆起;(4)切开病变外侧缘黏膜:使用针刀或Flex 刀沿病灶边界标记点预切开病变周围正常黏膜;(5)剥离病变:用IT 刀或Flex 刀于病灶下方对黏膜下层进行剥离;(6)创面处理:切除过程中及切除结束后,对创面显露的小血管及时应用氩离子血浆凝固术(argon plasm coagulation,APC)进行预防性止血。对术中发生穿孔或切除后病变薄弱处给与钛夹封闭。(7)标本处理:大头针固定切除标本于平板上,10%中性甲醛液浸泡送病理;(8)术后病理结果参考WHO 2010 年制定的消化系肿瘤标准病理分类方法进行分类[2]。
1.4 ESD 术后处理 术后第1 天禁食水,静脉补充水、电解质及能量,常规使用抗生素及止血药物。观察生命体征、皮下气肿、消化道出血及腹痛、腹胀等情况。留置胃管者观察胃管引流液体量及颜色。如无异常,第2 天可进食流食,第3 天进食软食。常规给予口服质子泵抑制剂和胃黏膜保护剂2 个月。
1.5 观察指标 观察手术时间、并发症、病灶大小、术后病理特点,评价整块切除率(内镜下一次性整块切除病变)、完整切除率(整块切除标本在病理学水平达到水平、垂直切缘均为阴性)、治愈性切除率(无或低淋巴结转移风险的完整切除)等指标。
1.6 统计学处理 采用SPSS 18.0 统计软件,计数资料以百分比(%)表示,组间比较采用卡方检验,P <0.05为差异有统计学意义。
2 结果
2.1 手术情况及并发症 48 例患者均顺利一次性完成手术,病灶为完整片状黏膜组织,手术整块切除率100%,手术平均时间(76.8 ±23.4)min。ESD 操作过程中,创面均有少量出血,估计平均出血量不超过50 ml,操作过程中见到出血及显露的血管,用切开刀电凝、APC 和钛夹止血,ESD 术后无持续性和迟发性出血。1 例(2.1%,1/48)贲门病变ESD 患者发生穿孔,给予金属钛夹封闭创面,保守治疗后好转。其他不良反应为发热6 例(12.5%,6/48),胸骨后不适17 例(35.4%,17/48),上腹隐痛11(22.9%,11/48),症状轻微,短期恢复。
2.2 ESD 术后病理分析 ESD 术后切除标本最大直径平均为(25.9 ±11.4)mm,术后病理证实维持HGIN 33 例(见图1B)、HGIN 伴局灶癌变11 例(见图1C)、高- 中分化腺癌3 例(见图1D)、LGIN 1 例(见图1A)。术前术后病理诊断符合率68.8%(33/48),与活检标本相比,ESD 术后标本诊断HGIN 更准确(χ2=17.778,P <0.05)。HGIN 癌变率29.2%(14/48),食管黏膜癌变率与胃黏膜癌变率比较差异无统计学意义(χ2=1.838,P >0.05);所有标本垂直切缘均为阴性,病理学评估癌细胞浸润深度结果显示5 例m1 癌,2例m2 癌,2 例m3 癌,5 例sm1 癌,未发现脉管浸润,2例标本水平切缘紧邻异常黏膜,完整切除率95. 8%(46/48),治愈性切除率95.8%(46/48)。3 例贲门胃底高中分化腺癌患者因为浸润深度达sm1,ESD 术后外科手术治疗,1 例手术后病理标本发现黏膜内数个癌细胞残留,另外2 例手术后标本未发现癌细胞,无脉管浸润(见表1 ~2)。
2.3 ESD 术后随访及复查 患者常规于术后3、6、12个月随访,内镜复查。1 例(2. 1%,1/48)贲门胃底HGIN 患者术后3 个月局部复发,再次行ESD 切除。2例(6.5%,2/31)食管ESD 患者切除范围超过食管周径2/3,术后3 个月发生吞咽困难,胃镜提示食管良性狭窄,给予水囊扩张后症状好转。
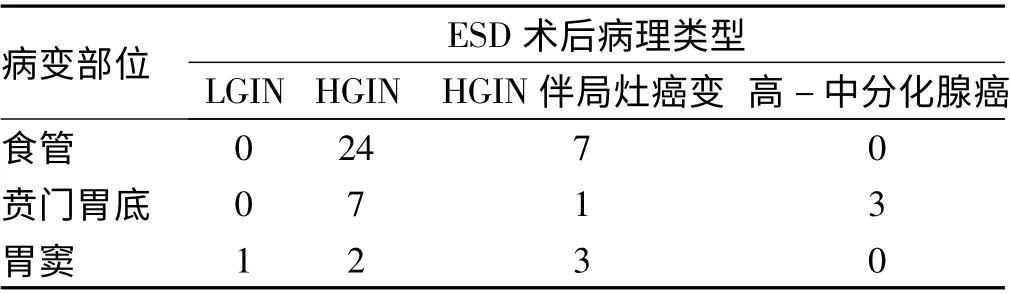
表1 ESD 术后切除标本病理类型Tab 1 Pathological types of resected specimen after ESD operation

表2 ESD 术后切除标本癌细胞浸润深度Tab 2 The depth of carcinoma cell invasion after ESD resection

图1 各级别上皮内瘤变的病理(HE 染色200 ×) A:LGIN;B:HGIN;C:HGIN 伴局灶癌变;D:高-中分化腺癌Fig 1 Pathological sections of intraepithelial neoplasia(HE 200 ×) A:LGIN;B:HGIN;C:HGIN with focal cancer;D:high and moderately differentiated adenocarcinoma
3 讨论
HGIN 是2000 年WHO 肿瘤分类中提出的新概念,取代以往重度不典型增生和原位癌,2010 年新版WHO 消化系统肿瘤分类中,进一步提出上皮内瘤变包括了所有浸润性癌的癌前病变。食管黏膜HGIN 有3/4将过渡到浸润性食管癌[2],胃黏膜HGIN 甚至在几个月内就可以演变为浸润性胃癌[3],因此,早期发现、早期诊断、早期治疗食管及胃黏膜HGIN 对防治食管癌及胃癌有重要临床意义。
但是,对上消化道黏膜HGIN 如何处理,是内镜随访、行ESD 还是腔镜治疗或外科手术,国内临床医师尚未遵循统一标准。Ono 等[4]研究证实,食管HGIN、没有侵袭性的原位癌和局限于黏膜固有层的鳞癌使用ESD 治疗是安全可靠的。Nishida 等[5]也认为对胃黏膜HGIN 行ESD 安全有效,并提供较大范围的切除病变标本进行更精确的诊断,出血率为5.4%,穿孔率为4.3%,整块切除率为97%。本组研究发现,ESD 治疗上消化道黏膜HGIN 整块切除率为100%,仅术中有少量出血,无术后迟发性出血,穿孔率为2.1%。其他术后发热、上腹不适等症状均表现轻微,内科治疗短期恢复。2 例食管病变经ESD 后3 个月出现吞咽困难,内镜复查发现疤痕性狭窄,狭窄率占食管ESD 术6.4%,经球囊扩张后好转。Mizuta 等[6]认为行ESD 后出现食管狭窄的主要因素与病灶的大小周径、位置和侵犯黏膜层的深度有关。动物实验证实,梭形肌成纤维细胞水平性增生可能和ESD 术后食管狭窄有关,局部注射类固醇激素可以预防食管狭窄的发生[7]。对ESD术后食管狭窄,内镜下球囊扩张术安全有效[8]。胃镜活检标本由于取材部位、取材深度及标本数量、大小等的局限,在诊断上消化道黏膜HGIN 中存在局限性,有研究证实,与术后病理存在差异[9]。一次性完整切除较大面积病变是ESD 的独特优势,为术后进一步病理学完整评估提供了可能。叶国良等[10]治疗16 例胃HGIN,术后病理证实10 例为早期胃癌。本组研究发现,ESD 术后病理维持HGIN 33 例、HGIN 伴局灶癌变11 例、高-中分化腺癌3 例、LGIN 变1 例。术前术后病理诊断符合率68.8%(33/48),与活检标本相比,ESD 术后标本诊断HGIN 更准确(P <0. 05),提示HGIN 应该由整体切除的标本进行诊断,而不适用于活检诊断。HGIN 癌变率为29.2%,食管黏膜癌变率与胃黏膜癌变率比较差异无统计学意义(P >0.05),提示HGIN 癌变发生率和病变部位无关。同时ESD术后标本可以进行水平切缘及垂直切缘评估有无异常细胞残留,并进行癌细胞浸润深度及血管、淋巴管侵犯风险判定,从而指导ESD 术后是否需要手术及放化疗。本组病例发现m1 癌5 例,m2 癌2 例,m3 癌2 例及sm1 癌5 例,未发现脉管浸润,完整切除率为95.8%,治愈性切除率为95. 8%,提示ESD 术治疗HGIN 临床疗效确切,可以获得较高的治愈率。新近研究发现,ESD 治疗胃肠道上皮内瘤变的复发率很低,约为1.2%[11],本研究随访仅发现1 例患者局部复发,复发率为2.1%。
综上所述,胃镜活检标本诊断上消化道黏膜HGIN 存在局限性,ESD 可一次性完全切除病灶,安全有效,且可以提供完整标本进行进一步病理学评估。对胃镜下有明确病灶的HGIN,可考虑行ESD,以及时发现早期肿瘤。
[1] Zhou XJ,Fan XS. Interpretation of WHO classification of digestive system tumor in 2010[J]. J Clin Exp Pathol,2011,27(4):341-346.周晓军,樊祥山. 解读2010 年消化系统肿瘤WHO 分类(I)[J].临床与实验病理学杂志,2011,27(4):341-346.
[2] Hong WK. Effect of EMR in the treatment of 56 cases of early esophageal cancer and precancerous lesion[J]. Modern Instruments & Medical Treatment,2013,19(3):77-79.洪卫康. 内镜下粘膜分片切除术治疗56 例早期食管癌及癌前病变疗效观察[J].现代仪器与医疗杂志,2013,19(3):77-79.
[3] Shuai YQ. The new understanding and rational treatment about highgrade gastric intraepithelial neoplasia[J]. Chinese Journal of Practical Surgery,2011,31(8):659-661.帅英强. 胃高级别上皮内瘤变新认识与正确处理[J].中国实用外科杂志,2011,31(8):659-661.
[4] Ono S,Fujishiro M,Nimi K,et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms[J]. Gastrointest Endosc,2009,70(5):860-866.
[5] Nishida T,Tsutsui S,Kato M,et al. Treatment strategy for gastric noninvasive intraepithelial neoplasia diagnosed by endoscopic biopsy[J].World J Gastrointest Pathophysiol,2011,2(6):93-99.
[6] Mizuta H,Nishimori I,Kuratani Y,et al. Predictive factors for esophageal stenosis after endoscopic submucosal dissection for superficial esophageal cancer[J]. Dis Esophagus,2009,22(7):626-631.
[7] Nonaka K,Miyazawa M,Ban S,et al. Different healing process of esophageal large mucosal defects by endoscopic mucosal dissection between with and without steroid injection in an animal model[J]. BMC Gastroenterol,2013,13:72.
[8] Na HK,Choi KD,Ahn JY,et al. Outcomes of balloon dilation for the treatment of strictures after endoscopic submucosal dissection compared with peptic strictures[J]. Surg Endosc,2013,27(9):3237-46.
[9] Xu F. Diagnostic value of endoscopic biopsy for gastric mucosa HGIN[J]. Jilin Medicine,2012,33(3):602-603.徐峰. 胃镜活检对胃黏膜高级别上皮内瘤变的诊断价值[J]. 吉林医学,2012,33(3):602-603.
[10] Ye GL,Sheng H,Zhang XJ,et al. The clinical application and evaluation of endoscopic submucosal dissection in treatment of gastric intraepithelial neoplasia[J]. Chin J Gastroenterol Hepatol,2012,21(4):319-321.叶国良,盛红,张新军,等. 内镜黏膜下剥离术在治疗胃上皮内瘤变中的应用与评价[J]. 胃肠病学和肝病学杂志,2012,21(4):319-321.
[11] Bialek A,Wiechowska-Kozlowska A,Pertkiewicz J,et al.Endoscopic submucosal dissection for the treatment of neoplastic lesions in the gastrointestinal tract[J]. World J Gastroenterol,2013,19(12):1953-61.

