错构瘤息肉综合征2 例并文献复习
袁 召,王朝晖,陈智颖,袁华魏,孔祥响,刘文新
大连市中心医院消化内科,辽宁 大连116033
错构瘤息肉综合征包含一组疾病,其特点是某些肠段被一些组织的无规律的混合体所累及,具有非肿瘤性但有肿瘤样增生的特点。可以是正常组织的异构现象,可以是一种或几种组织过度生长的肿瘤,也可以是非肿瘤性局限性肿瘤样增生,包括以异常和紊乱方式排列的正常组织。
病例1 患者,女,78 岁。因反复腹痛1 年,加重伴腹泻30 d入院。患者1 年前无明显诱因出现全腹间断性隐痛,腰背部放射疼痛,伴腹胀,进食后明显,伴反酸、烧心,伴恶心、呕吐,曾间断口服奥美拉唑等治疗后症状稍有减轻。近半个月来上述症状加重同时伴腹泻,解黄色糊状便,量较多,3 ~4 次/d,便中带血。发病以来味觉减退,伴乏力、消瘦。1 年前行肠镜检查提示结肠炎改变(见图1),多次行胃镜检查提示残胃炎、吻合口炎。10 年前曾因胃平滑肌瘤行胃大部切除术,家族中否认有类似病史。体检:神清,轻度贫血貌,消瘦,头发稀疏,手掌及足底皮肤色素沉着(见图2),指、趾甲萎缩脱落(见图3),全腹轻度压痛,无反跳痛及肌紧张,双下肢轻度凹陷性水肿。实验室检查:白细胞5.43 ×109/L,中性粒细胞0.63,红细胞2.72 ×109/L,血红蛋白93 g/L,血小板331 ×109/L;粪潜血阳性;总蛋白50. 6 g/L,白蛋白28. 1 g/L;血钾3. 00 mmol/L、血钙1.94 mmol/L,血镁0.65 mmol/L;甲胎蛋白、癌胚抗原、糖类抗原19-9、糖类抗原12-5 均正常,心电图、胸片、腹部超声、腹部CT 未见明显异常;胃镜示胃多发息肉,胃吻合口炎,胃大部切除术后(见图4)。肠镜示末端回肠黏膜弥漫充血、水肿,覆白色分泌物,可见结节状隆起,取活组织2 块,回盲部也受累及,全结肠及直肠见大小不等息肉样隆起,较大者约3.0 cm ×3.5 cm(见图5),口侧息肉弥漫密集分布,肛侧息肉散在分布,息肉表面黏膜可见糜烂,息肉密集处肠黏膜充血、水肿,大量黏液附着,肠腔变窄。病理示符合增生性息肉,部分腺体增生活跃。该患者为老年女性,入院后行胃肠镜检查提示消化道多发息肉病,但详细询问患者病史及查体,该患者有腹痛、腹泻,同时伴有皮肤色素沉着、指趾甲萎缩、脱发等表现,实验室检查有贫血、低蛋白血症及电解质紊乱等,复习相关文献后考虑该患者可能为Cronkhite-Canada 综合征(Cronkhite-Canada syndrome,CCS)。入院后给予抑酸、保护胃黏膜、调节肠道菌群、纠正离子紊乱、输入人血白蛋白、美沙拉嗪抗炎、蔗糖铁改善贫血等对症支持治疗后症状好转出院。
病例2 患者,女,24 岁。因反复下腹痛20 年,再次发病1年入院。患者20 年前无明显诱因出现下腹间断性隐痛,排黄色不成形便,1 次/d,无黏液脓血便,无黑便,排便后腹痛减轻,未诊治,1 年前无明显诱因上述症状再发,1 d 前于当地诊所行肠镜检查提示结肠多发息肉,追寻患者4 岁时口唇、指趾末端出现棕褐色斑点,查体:神清,口唇、口腔黏膜、手指及脚趾可见散在灰黑色斑点,口唇周围明显(见图6),全腹无压痛,无反跳痛及肌紧张。便潜血弱阳性,乳房超声示双侧乳腺轻度增生、右侧乳腺囊性结节(BI-RADS 2 级),其余实验室检查未见明显异常。入院后行肠镜检查提示:进镜距肛门85 cm 见回盲部,可见回肠末端及回肠末端息肉嵌顿于回盲瓣,经充气、内镜顶推,回肠息肉还纳,进镜回肠末端20 cm 见息肉,所见回肠末端散在多数息肉,大小0.3 ~2.5 cm,较大息肉可见长蒂,息肉分页状,充血,较污秽分泌物覆盖,于较大息肉处取活组织5 块(见图7);退镜见全大肠散在分布多数息肉,大小0.3 ~3.0 cm,较大息肉可见长蒂,息肉分叶状,充血,较污秽分泌物覆着,于盲肠较大息肉处取活组织3 块,回盲瓣息肉,阑尾窝正常。胃镜检查所见:食管黏膜光滑,未见溃疡及隆起病变;贲门正常;胃底、胃体、胃角见多数息肉样隆起,息肉无蒂或亚蒂,大小0.2 ~1.2 cm,息肉于胃体数量较多,于胃体较大息肉处取活组织检查(见图8):胃窦黏膜片状充血,胃底黏液见黄绿色胆汁;幽门圆,开闭正常,十二指肠球部未见异常,十二指肠降段见多数息肉样隆起,大小0.2 ~1.5 cm,有蒂、亚蒂或无蒂,于较大息肉处取活组织2 块,远视十二直肠肛侧黏膜可见多数息肉。病理示:盲肠慢性炎性,回盲末端符合增生性息肉。十二指肠慢性炎症,胃体符合胃底腺息肉。该患者为青年女性,入院后行胃肠镜检查提示胃十二指肠、回肠末端及大肠多发息肉,根据患者病史,口唇、口腔黏膜、手指及脚趾皮肤黏膜色素沉着、内镜表现及病理等考虑Peutz-Jegher 综合征(Peutz-Jegher syndrome,PJS),入院后对症治疗,同时建议患者完善全消化道钡餐透视及胶囊内镜检查,患者拒绝进一步诊治,后转至上级医院进一步诊治。
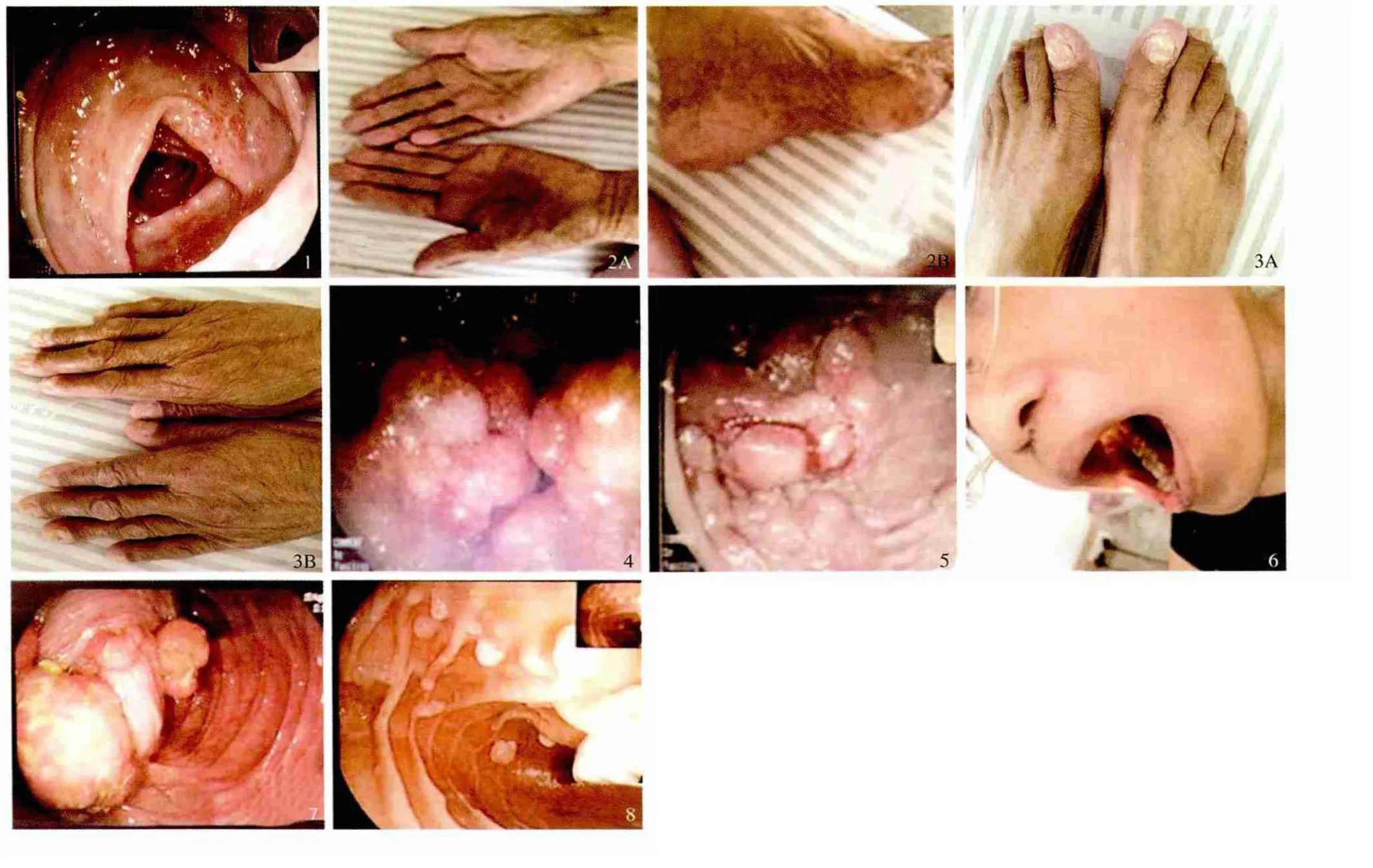
图1 肠镜检查提示结肠炎改变; 图2 手掌及足底皮肤色素沉着; 图3 指、趾甲萎缩脱落; 图4 胃镜示胃多发息肉,胃吻合口炎,胃大部切除术后; 图5 肠镜示全结肠及直肠见大小不等息肉样隆起; 图6 患者口唇、口腔黏膜、手指及脚趾可见散在灰黑色斑点,口唇周围明显; 图7 肠镜可见大肠散在分布多处息肉; 图8 胃镜检查可见胃底、胃体、胃角见多数息肉样隆起Fig 1 The change of colitis under colonoscopy;Fig 2 Hyperpigmentation of palms and plantar area;Fig 3 Atrophy and fall off of the fingernails and toenail;Fig 4 Gastroscope revealed gastric multiple polypoid uplift,stomach anastomotic inflammation and post subtotal gastrectomy;Fig 5 Colonoscopy revealed polyp sizes uplift were found throughout the entire colon and rectum polyp;Fig 6 Patient’s lips,buccal vestibule mucosa,fingers and toes showed numerous pigmented lesions scattered in gray and black spots,apparently around the lips;Fig 7 Numerous polyps scattered in the whole large intestine under the colonoscopy;Fig 8 Gastric fundus,gastric body and gastric angle showed majority polyps under the gastroscope
讨论 遗传性疾病相关的胃肠道息肉综合征以累及结肠为主的多发性息肉病,大部分与遗传性疾病相关,伴有肠道外表现,一般可分为腺瘤性和错构瘤性息肉综合征两大类。其中错构瘤息肉综合征[1]主要有以下3 种:PJS、幼年性息肉病综合征(juvenile polyposis syndrome,JPS)、CCS。
CCS 又称息肉-色素沉着-脱发-爪甲营养不良综合征,是一种罕见、死亡率高的疾病,1955 年由美国内科医师Cronkhite 和放射科医师Canada[2]首先报道在《新英格兰杂志》上,迄今全球共报道约有450 例[3],病因尚不明确,可能与自身免疫异常有关,无家族性倾向。临床上以胃肠道息肉及外胚层改变两大症状群为主要表现,其特征为胃肠道弥漫性多发性息肉、腹泻、营养不良、体质量减退、腹痛、外胚层变化如皮肤色素沉着、指趾甲萎缩、秃发[4],也可出现味觉减退和口腔干燥。实验室检查可有贫血、低蛋白血症、电解质紊乱等。息肉病理组织学分类包括炎症性、增生性、腺瘤性和错构瘤性息肉,可累及除食管外的全消化系,分布以胃和大肠为多。本例在症状、内镜下形态、病理组织学特征等方面均符合CCS。到目前为止,对CCS 尚缺乏有效的治疗手段,一般对症、支持治疗,部分患者可考虑激素、内镜下治疗及外科手术治疗。国外报道本病约15%发展为恶性肿瘤,是胃肠道恶性肿瘤的癌前病变。CCS 预后差,5 年死亡率为55%,患者常因肠吸收不良引起电解质紊乱、维生素缺乏、低蛋白血症,可引起肠套叠、蛋白丢失性肠病、急性重型胰腺炎、致命性胃肠道出血等多种并发症[5],最终死于全身衰竭、继发感染、恶病质等。
PJS 系单一多效性基因常染色体显性遗传病,与19 号染色体短臂19P13.3 上STK11 突变有关[6]。临床表现主要为皮肤黏膜黑色素斑块伴发肠道多发性息肉增生,该病变累及90%以上患者,多见于唇部、颊黏膜、眶周、肘部、趾(指)尖、掌心、足底、脐周,罕见于舌部。色斑常于出生时或婴幼儿期出现,色素可呈黑、棕褐色、灰、蓝等色。PJS 息肉可发生于除口腔外的消化道任何部位,常见于小肠,因息肉引起肠蠕动增强常导致肠道叠、肠梗阻等。临床诊断发现口周色素沉着、胃肠道多发息肉、家族性遗传因素三大特征考虑为PJS。治疗上一般予以内科对症及保守治疗,多建议保守治疗而非根治行肠切除术[7]。如发生肠道叠、肠梗阻、反复消化道出血等,需外科手术,手术目的为解除梗阻或去除出血灶。早期发现并对所有胃肠PJS息肉均进行清扫切除,可降低未来急诊手术率并改善患者生存期。推荐在外科手术中配合推进式小肠镜及结肠镜对全胃肠道息肉进行内镜下或手术中逐个清扫切除[8]。术后需定期复查胃镜、小肠镜[9]、肠镜、乳房X 线、胰腺CT 等,终身进行癌症筛选。PJS 息肉恶变率极低,但仍会增加癌变的风险,PJS 容易引起各种恶性肿瘤,PJS 癌变进程究竟为错构瘤本身发生腺瘤变后进而由腺瘤发展为癌肿,或是由于与错构瘤并存的腺瘤发生癌变,目前尚不明确。
[1] Calva D,Howe JR. Hamartomatous polyposis syndromes[J]. Surg Clin North Am,2008,88(4):779-817.
[2] Cronkhite LW Jr,Canada WJ. Generalized gastrointestinal polyposis;an unusual syndrome of polyposis,pigmentation,alopecia and onychotrophia[J]. N Engl J Med,1955,252(24):1011-1015.
[3] Kopá oCvá M,Urban O,Cyrany J,et al. Cronkhite-Canada syndrome:review of the literature[J]. Gastroenterol Res Pract,2013,2013:856873.
[4] Ward EM,Wolfsen HC. Review article:the non-inherited gastrointestinal polyposis syndromes[J]. Aliment Pharmacol Ther,2002,16(3):333-342.
[5] Yuan B,Jin X,Zhu R,et al. Cronkhite-Canada syndrome associated with rib fractures:a case report [J]. BMC Gastroenterol,2010,10:121.
[6] Chae HD,Jeon CH. Peutz-Jeghers syndrome with germline mutation of STK11[J]. Ann Surg Treat Res,2014,86(6):325-330.
[7] Higham P,Alawi F,Stoopler ET. Medical management update:Peutz Jeghers syndrome[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2010,109(1):5-11.
[8] Oncel M,Remzi FH,Church JM,et al. Benefits of‘clean sweep’in Peuta-Jeghers patients[J]. Colorectal Dis,2004,6(5):332-335.
[9] Korsse SE,Dewint P,Kuipers EJ,et al. Small bowel endoscopy and Peutz-Jeghers syndrome[J]. Best Pract Res Clin Gastroenterol,2012,26(3):263-278.

