结直肠癌组织中PAQR3、PDCD4基因甲基化水平与结直肠癌的关系
结直肠癌组织中PAQR3、PDCD4基因甲基化水平与结直肠癌的关系
李日恒杨瑞红1宋艳敏张涛李青2吕志刚3张爱民安宇亮
(河北大学附属医院,河北保定071000)
摘要〔〕目的研究结直肠癌组织抑癌基因PAQR3、PDCD4甲基化水平,以及二者与结直肠癌临床资料之间的关系。方法收集2013~2014年结直肠癌及癌旁正常组织标本各54例,用甲基化特异性PCR(MSP)法检测结直肠标本中PAQR3、PDCD4基因甲基化水平。结果(1)PAQR3癌组织和癌旁组织甲基化率分别为 33.3%(18/54)和5.6%(3/54),差异显著(P<0.05);PDCD4癌组织和癌旁组织发生甲基化率为分别为53.7%(29/54)和7.4%(7/54),差异显著(P<0.001)。二者同时检测的甲基化阳性率为87%,PAQR3和PDCD4没有相关性(R=0.155,P=0.408)。(2)结直肠癌组织中PAQR3基因甲基化与性别、肿瘤部位无关,年龄越大、分化程度越低、淋巴结转移、浸润越深者,PAQR3甲基化发生率越高。结直肠癌组织中PDCD4 基因甲基化与性别、年龄、肿瘤部位无关,分化程度越低、淋巴结转移、浸润越深者,PDCD4 甲基化发生率越高。结论结直肠癌中PAQR3、PDCD4发生了甲基化,PAQR3基因甲基化水平与年龄、分化程度、有无淋巴结转移、肿瘤浸润深度有关,PDCD4 甲基化水平与分化程度、有无淋巴结转移、肿瘤浸润深度有关。
关键词〔〕PAQR3;PDCD4;甲基化;结直肠癌
中图分类号〔〕R735〔文献标识码〕A〔
基金项目:河北省科技计划项目(132777248);2015年度河北省医学科学研究重点课题计划项目(20150069)
1任丘市妇幼保健院2河北省容城中医院
3河北省清苑县医院
第一作者:李日恒(1972-),男,博士,副主任医师,主要从事普外科疾病研究。
结直肠癌的发生机制是复杂的。表观遗传学改变是一种不发生基因序列变化的基因表达异常,包括组蛋白印记、基因甲基化。基因甲基化是肿瘤的早期事件且过程可逆,为甲基化相关的基因应用与临床的早期诊断和治疗提供了理论依据〔1,2〕。 PAQR3属于孕酮和脂联素受体(PAQR)家族中的一员,在结直肠癌细胞中发挥抑癌基因的作用,参与细胞的各种信号转导、能量代谢、细胞分裂增殖、分化和生殖细胞的成熟等生物学过程,主要通过负性调节Ras/Raf/MEK/ERK信号通路,达到调控细胞增殖、分化、凋亡及细胞恶性转化、癌症的发生发展等生理过程的目的〔3~7〕。在胃癌组织中,PAQR3负性调控ERK和AKT的磷酸化,证明PAQR3通过抑制ERK和AKT的信号通路负性调节EMT的过程〔8~11〕。
PDCD4是与细胞凋亡相关的抑癌基因,参与细胞的转录、翻译及多种信号通路,发挥抑制肿瘤生长的作用。已经证实PDCD4在多种肿瘤组织中表达降低,其表达水平与多种肿瘤患者的预后有关,高表达的PDCD4还能增加化疗药物的感性〔12~14〕。PAQR3和PDCD4作为结直肠癌中的抑癌基因,其沉默机制并不明确,目前也没有联合检测二者甲基化的报道。本文拟探讨PAQR3、PDCD4在结直肠癌中基因甲基化及二者的关系,为结直肠癌的诊断和治疗提供理论依据。
1材料和方法
1.1材料
1.1.1标本来源及存储方法54对结直肠癌组织、正常组织取自河北大学附属医院普通外科,收集标本时间为2013~2014年。纳入标准:患者术前均未接受放疗、化疗或免疫治疗,收集癌组织标本时除外已发生坏死的肿瘤组织,癌旁正常组织取距癌组织边缘>10 cm的正常组织,组织取全层,诊断结果均由术后病理结果确定。男32例,女22例;直肠癌19例,结肠癌35例;年龄36~82岁,平均59.69岁。术中立即取标本放置于液氮中,-80℃低温保存,时间不超过6个月。
1.1.2主要试剂QIAGEN EpiTect Fast DNA Bisulfite试剂盒、蛋白酶K、RNaseA、EP管、枪头、8联排均由石家庄市惠友生物科技有限公司提供,β-actin引物、PAQR3甲基化和非甲基化引物由上海生工生物工程股份有限公司设计并合成。实验中DNA提取及核酸电泳过程中所需的STE裂解液、SDS、氯仿、异戊醇、无水乙醇、75%无水乙醇、Tris-饱和酚、酚/氯仿/异戊醇(25∶24∶1)、氯仿/异戊醇(24∶1)、TE缓冲液、无水醋酸钠等均由河北大学附属医院中心实验室提供。
1.2甲基化特异性PCR(MSP)酚/氯仿抽提法提取组织DNA,根据EpiTect Fast DNA Bisulfit Kit 试剂盒说明书进行亚硫酸氢盐修饰。PAQR3甲基化和非甲基化引物通过MethPrimer软件设计,PAQR3甲基化引物(M):5’-TTGTTGAAGAGCGCGTATTATATC-3(正义),5’-TAAAAACCCGAAAATCTACTCGTA-3’(反义),非甲基化引物(U):5’-TTGTTGAAGAGTGTGTATTATATTGA-3’(正义),5’-TAAAAAACCCAAAAATCTACTCATA-3’(反义);PDCD4甲基化引物(M):5’-TTTAGTTTCGGTTTCGTCGTTAC-3’(正义),5’-GAAAAATCTCTAACCCTTCTCGC-3’(反义);非甲基化引物(U):5’-TTTAGTTTTGGTTTTGTTGTTATGA-3’(正义),5’-CAAAAAATCTCTAACCCTTCTCACT-3’(R)。内参基因β-actin引物:5'-GTG GAC ATC CGC AAA GAC-3'(正义),5'-AAA GGG TGT AAC GCA ACT AA-3'(反义),扩增后的产物进行1%琼脂糖凝胶电泳,紫外分析仪分析。
1.3统计学分析采用SPSS16.0软件进行χ2检验、Spearman相关分析。
2结果
2.1结直肠癌组织中PAQR3、PDCD4基因甲基化水平结直肠癌组织中PAQR3甲基化率为33.3%(18/54),明显高于癌旁正常组织〔5.6%(3/54)〕(P<0.05),见图1。结直肠癌组织中PDCD4甲基化发生率为53.7%(29/54),明显高于癌旁正常组织〔7.4%(7/54)〕(P<0.001),见图2。二者联合检测的甲基化的阳性率为87%。PAQR3和PDCD4没有相关性(R=0.155,P=0.408)。
2.2PDCD4、PAQR3、基因甲基化与结直肠癌临床资料之间的关系结直肠癌组织中PAQR3基因甲基化与性别、肿瘤部位无明显相关性,年龄越大、分化程度越低、淋巴结转移、浸润越深者,PAQR3甲基化率越高;反之,越低。结直肠癌组织中PDCD4 基因甲基化水平与性别、年龄、肿瘤部位无关,分化程度越低、淋巴结转移、浸润越深者,PDCD4 发生率越高;反之,越低。见表1。
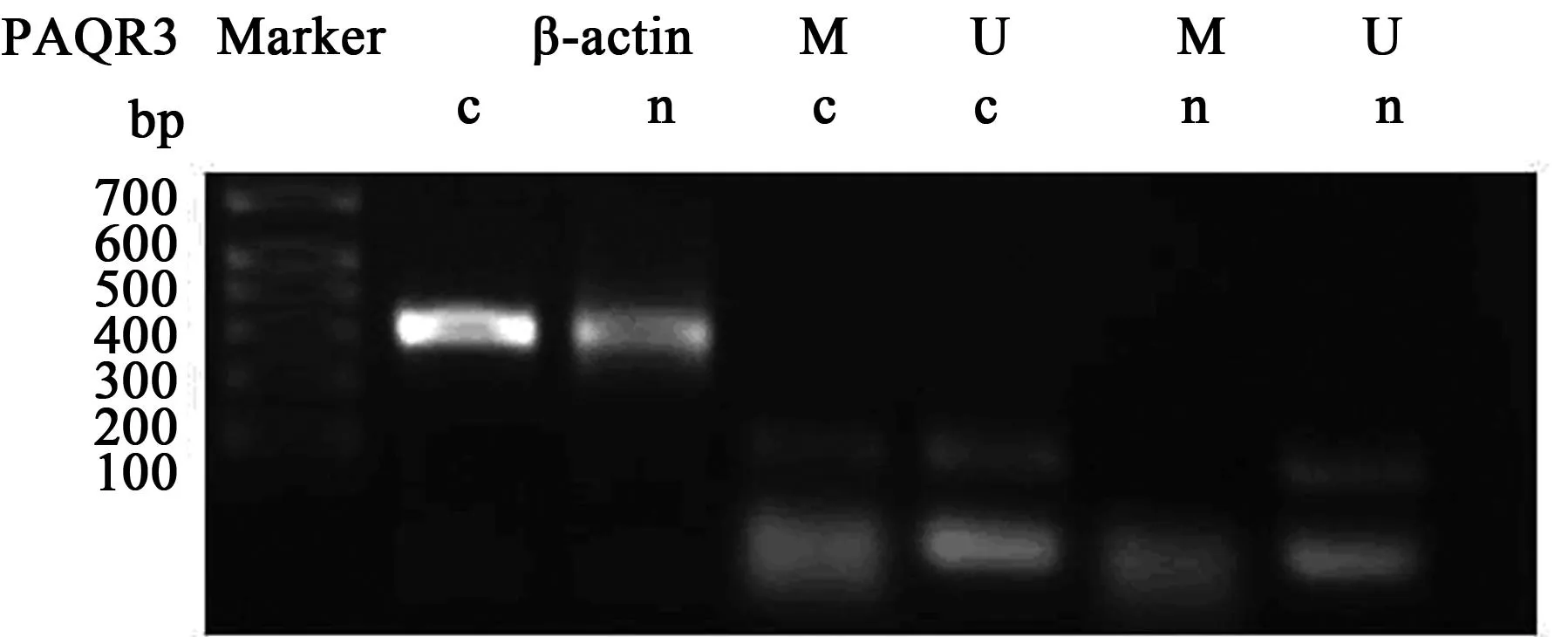
c:结直肠癌组织,n:癌旁正常组织,下图同 图1 结直肠癌组织中PAQR3 MSP扩增产物电泳图
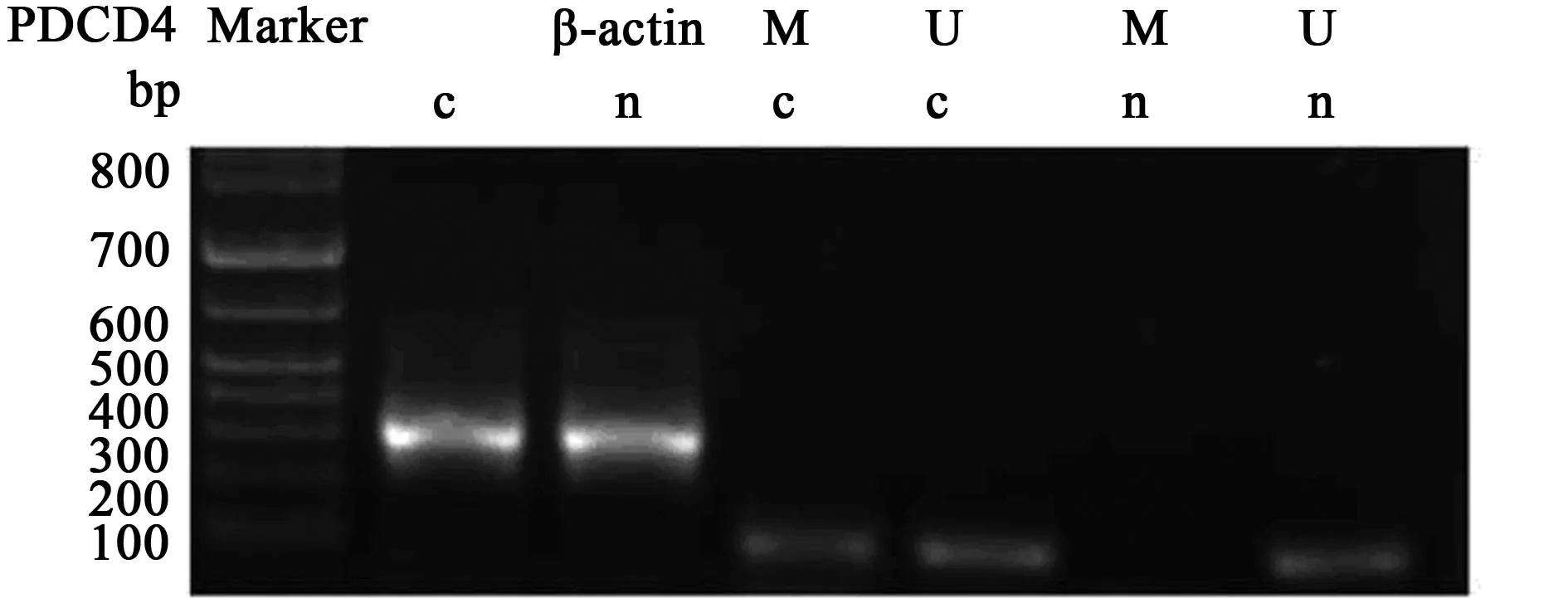
图2 结直肠癌组织中PDCD4 MSP扩增产物电泳图

临床资料nPAQR3甲基化P值PDCD4甲基化P值性别男3211(34.4)0.84517(53.1)0.918女227(31.8)12(54.5)年龄(岁)<60296(20.7)0.03416(55.2)0.816≥602512(48.0)13(52.0)部位结肠3510(28.6)0.31419(54.3)0.907直肠198(42.1)10(52.6)分化程度Ⅰ~Ⅱ级3015(50.0)0.00411(36.7)0.005Ⅲ级243(12.5)18(75.0)淋巴转移无284(14.3)0.03610(35.7)0.006有2614(53.8)19(73.1)浸润深度黏膜肌层3114(45.2)0.03212(38.7)0.010浆膜周围234(17.4)17(73.9)
3讨论
PAQR3基因能在结直肠癌中发挥抑癌基因的作用。参与了细胞的各种信号通路,能影响细胞能量代谢、分裂增殖、分化以及生殖细胞成熟等生物学过程,又名 PKTG,可以编码出37 kD大小的、N端朝胞质、C端朝细胞器、位于高尔基体膜上的7次跨膜蛋白,能负性调控Ras/Raf/MEK/ERK信号通路,此信号通路是经典的丝裂原活化蛋白激酶级联信号途径之一。此外,PAQR3通过另外两种机制负性调控AKT信号通路,一方面,PAQR3敲除后,胞质中与高尔基体结合的p110表达降低,PAQR3结合并改变胞质中PI3K复合物的p110的亚细胞定位,阻止与p85调控位点的结合,导致PI3K失活以及AKT磷酸化,此过程也影响胰岛素的信号通路;另一方面,PAQR3可以阻断GPCR的Gβ位点,抑制AKT在GRCR激活的Gβ/γ位点的作用。Wang等〔15〕也证实PAQR3基因在结直肠癌组织中发挥抑癌的作用,PAQR3表达缺失缩短了PAQR3基因敲除后裸鼠的存活时间。在人类黑色素瘤A375的研究中,PAQR3过表达能明显抑制细胞的扩增及恶性转化,裸鼠成瘤实验中,通过si-RNA技术使PAQR3重新表达能明显抑制皮下成瘤的作用,其下游被异常激活的ERK活性明显受到抑制〔16〕。
PDCD4是一种抑癌基因,参与细胞的转录、翻译及多种信号通路,共同发挥抑制肿瘤生长的作用。PDCD4除了在肿瘤细胞中发挥抑制转录、促进凋亡、调节细胞周期等作用,还能影响细胞类型的激活。
基因甲基化是肿瘤发生的早期事件,可以作为结直肠癌的诊断依据。目前还没有关于PAQR3基因甲基化的报道。本研究证实了PAQR3基因甲基化参与结直肠癌的形成,可以作为结直肠癌的肿瘤标记物。之前的相关研究证实了PDCD4表达沉默与多种肿瘤形成有关,而PDCD4表达沉默的机制很复杂,基因甲基化就是其中的一种,例如Gao等〔14〕同时检测了8种胶质瘤细胞系中PDCD4基因的甲基化水平,其中5个发生了完全甲基化,2个发生了部分甲基化,1个未发生甲基化,由于甲基化的过程是可逆的,用去甲基化药物5-氮杂-2-脱氧胞苷处理后,PDCD4重新表达,细胞分化及转移能力减弱。在不同组织中,PDCD4基因甲基化水平不同,本研究中证实了PDCD4基因在结直肠癌中发生了甲基化,而不是完全甲基化,说明甲基化在沉默基因的过程中只发挥了部分的作用,与癌旁正常组织有统计学差异,说明PDCD4基因甲基化在结直肠癌的形成中发挥了作用。单独基因甲基化检测无法确定其在结直肠癌中的作用,多种基因甲基化对于结直肠癌诊断提供更为准确的依据。之前关于联合基因检测基因甲基化的报道有很多,能提高甲基化检出率。James等〔17〕同时检测了结直肠癌中DKK1和SFRP1启动子甲基化状态,并说明DKK1和SFRP1甲基化与结直肠癌的发生有关,SFRP1在结直肠癌中最易发生甲基化。尽管我们分析二者在甲基化方面没有相关性,但二者联检提高了甲基化的阳性率,为结直肠癌诊断提供了依据。同时我们发现PAQR3甲基化水平与年龄有关,年龄越大PAQR3基因甲基化率越高;而PDCD4基因甲基化水平与年龄无关,分析基因甲基化与年龄相关性,随着年龄的增大,机体甲基化水平越高但年龄相关的甲基化水平改变的机制仍不是很明确,这种关系在不同的研究中说法不一,首先考虑年龄增大后,体内酶活性发生了改变,促进基因发生甲基化;此外,可能受地理环境因素及随机抽样、样本量大小的影响,考虑这种差异无显著意义〔18〕。基因甲基化是肿瘤发生的早期事件〔19〕,分化程度越低,基因甲基化水平越高,基因表达水平越低,发挥抑癌作用的能力越差。随着分化程度的升高,甲基化发生的概率越低。因此,在分化程度越高的肿瘤组织中,基因甲基化的概率越高。二者甲基化与结直肠癌浸润深度和有无淋巴结转移有关,考虑为二者基因沉默所致;同时,二者可以作为结直肠癌的监测预后指标。
本研究证实了PAQR3和PDCD4基因甲基化在结直肠癌中的作用,为进一步体外实验、逆转基因甲基化、重新表达抑癌基因提供了切实有效的理论依据。
4参考文献
1Javier CF,Azuara D,Berenguer LA,etal.DNA methylation biomarkers for noninvasive diagnosis of colorectal cancer〔J〕.Cancer Prev Res,2013;6(7):656-65.
2Henri ST,Daniel MC,Michael BD,etal.Nutritional factors and gender influence age-related DNA methylation in the human rectal mucosa〔J〕.Aging Cell,2013;12(1):148-55.
3陈雁,谢小多.RKTG 基因功能研究〔J〕.细胞生物学杂志,2009;31(1):9-14.
4Tang YT,Hu TH,Arterburn M,etal.PAQR proteins:a novel membrane receptor family defined by an ancient 7-transmembrane pass motif〔J〕.J Mol Evol,2005;61:372-80.
5Feng L,Xie XD,Ding QR,etal.Spatial regulation of Raf kinase signaling by RKTG〔J〕.Proc Natl Acad Sci USA,2007;104(36):14348-53.
6Cano E,Mahadevanl C.Parallel signal processing among mammalian MAPKs〔J〕.Trends Biochem Sci,1995;20(3):117-22.
7Fan FJ,Feng L,He J,etal.RKTG sequesters B-Raf to the Golgi apparatus and inhibits the proliferation and tumorigenicity of human malignant melanoma cells〔J〕.Carcinogenesis,2008;29(6):1157-63.
8Xie XD,Zhang YX,Jiang YH,etal.Suppressive function of RKTG on chemical arcinogen-induced skin carcinogenesis in mouse〔J〕.Carcinogenesis,2008;29(8):1632-8.
9Zhang Y,Jiang X,Qin X,etal.RKTG inhibits angiogenesis by suppressing MAPK-mediated autocrine VEGF signaling and is downregulated in clear-cell renal cell carcinoma〔J〕.Oncogene,2010;(29):5404-15.
10Ling ZQ,Guo W,Lu XX,etal.A Golgi specific protein PAQR3 is closely associated with the progression,metastasis and prognosis of human gastric cancers〔J〕.Ann Oncol,2014;25(7):1363-72.
11Jiang Y,Xie X,Zhang Y,etal.Regμlation of G-protein signaling by RKTG via sequestration of the G beta gamma subunit to the Golgi apparatus〔J〕.Mol Cell Biol,2010;(30):78-90.
12Wen YH,Shi X,Chiriboga L,etal.Alterations in the expression of PDCD4 in ductal carcinoma of the breast〔J〕.Oncol Rep,2007;18:1387-93.
13Kalinichenko SV,Kopantzev EP,Korobko EV,etal.PDCD4 protein and mRNA level alterations do not correlate in human lung tumors〔J〕.Lung Cancer,2008;62:173-80.
14Gao F,Wang XY,Zhu FL,etal.PDCD4 gene silencing in gliomas is associated with 5′CpG island methylation and unfavourable prognosis〔J〕.J Cell Mol Med,2009;13(10):4257-67.
15Wang X,LI XB,Fan FJ,etal.PAQR3 plays a suppressive role in the tumorigenesis of colorectal cancers〔J〕.Carcinogenesis,2012;33(11):2228-35.
16Ding QQ,Huo LF,Yang JY,etal.Down-regulation of mycloid cell leukemia-1 through inhibiting Erk/Pin 1 pathway by sorafenib facilitates chemosensitization in breast cancer〔J〕.Cancer Res,2008;68(15):6109-17.
17James BR,Michael M,Miralem M,etal.Promoter methylation of Wnt antagonists DKK1 and SFRP1 is associated with opposing tumor subtypes in two large popμlations of colorectal cancer patients〔J〕.Carcinogenesis,2011;32(5):741-7.
18Lillycrop KA,Hoile SP,Grenfell L,etal.DNA methylation,ageing and the influence of early life nutrition〔J〕.Proc Nutr Soci,2014;73(3):413-21.
19Bird A.Perceptions of epigenetics〔J〕.Nature,2007;447(7143):396-8.
〔2015-01-19修回〕
(编辑徐杰)

