阿伐他汀对ApoE基因敲除小鼠海马和大脑皮质HDAC4和pCREB表达的影响
阿伐他汀对ApoE基因敲除小鼠海马和大脑皮质HDAC4和pCREB表达的影响
李报黄大可桂丽汪渊芦宝静贾雪梅
(安徽医科大学基础医学院,安徽合肥230032)
摘要〔〕目的探讨阿伐他汀对高脂血症模型小鼠脑组织组蛋白去乙酰酶(HDAC4)和pCREB表达的影响。方法将16只雄性ApoE基因敲除小鼠随机分成两组,一组正常饮食,一组在正常饮食同时给予阿伐他汀灌胃。实验结束后称重测血脂,取脑组织固定,石蜡切片后进行HE和免疫组化染色。结果阿伐他汀治疗组小鼠海马和大脑皮质HDAC4表达水平显著下降(P< 0.05),而pCREB表达水平显著增加(P< 0.05)。结论提示HDAC4和转录因子pCREB在阿伐他汀改善高脂血症引起的脑神经退行性疾病可能具有重要作用。
关键词〔〕阿伐他汀;ApoE基因敲除;组蛋白去乙酰化酶;环磷腺苷效应元件结合蛋白
中图分类号〔〕R322.81〔文献标识码〕A〔
基金项目:国家自然科学基金(30570750);安徽省教育厅自然科学基金(KJ2012A164)
通讯作者:贾雪梅(1959-),女,教授,硕士,主要从事神经退行性疾病研究。
第一作者:李报(1979-),男,实验师,硕士,主要从事神经退行性疾病研究。
高脂血症是阿尔茨海默病(AD)发病的危险因素之一。阿伐他汀作为胆固醇合成途径关键限速酶HMGCoA还原酶的抑制剂,可以降低血清中胆固醇的含量。研究表明,阿伐他汀对AD模型小鼠的神经炎症和神经元丢失有保护作用〔1〕,但是作用机制还不清楚。组蛋白去乙酰化酶(HDAC)对神经发育和学习认知行为具有重要的调控作用,通过修饰组蛋白调控基因表达。本课题组也发现载脂蛋白(Apo)E基因敲除小鼠海马区HDAC4的表达显著升高〔2〕。ApoE基因是中枢神经系统中运输胆固醇的重要载体,也是后发性AD的重要关联基因。ApoE基因敲除小鼠的血脂水平明显升高,脑部出现神经退行性病变,成为高脂血症和AD研究的动物模型之一〔3〕。本研究以ApoE基因敲除小鼠作为模型动物,观察阿伐他汀治疗后HDAC4和pCREB在脑部的表达变化,为进一步研究阿伐他汀治疗神经退行性疾病作用机制提供形态学依据。
1材料和方法
1.1材料和分组实验所用动物均为C57BL/6遗传背景的雄性ApoE 基因敲除小鼠,购自中国医学科学研究院动物中心。4周龄ApoE 基因敲除小鼠随机分成模型组和治疗组,每组8只。模型组给予正常饮食,治疗组在正常饮食的同时给予阿伐他汀(5 mg·kg-1·d-1)灌胃,12 w后实验结束,眼球取血测血脂。
1.2主要试剂和仪器阿伐他汀和血脂检测试剂盒购自上海荣盛公司;HDAC4和pCREB抗体分别为美国Santa cruz公司和北京博奥森生物技术有限公司提供;免疫组化检测试剂盒为美国GBI公司生产的通用型PV-9000;DAB显色试剂盒购自北京中山金桥生物技术有限公司。显微镜为Nikon80i,日立全自动生化分析仪。
1.3实验材料的采集摘取眼球取血后按照血脂检测试剂盒进行操作,最后用生化分析仪进行检测。血样采集后断颈处死小鼠,取脑组织用甲醛溶液固定,后脱水、石蜡包埋和切片。
1.4H-E染色和免疫组化切片脱蜡至水:二甲苯2次各20 min,100%乙醇2次各10 min, 95%乙醇、85%和70%乙醇各5 min最后放入ddH2O中。H-E染色:苏木精染色20 min后蓝化,伊红染色1 min。免疫组化步骤按照检测试剂盒和DAB显色试剂盒说明进行操作,一抗4℃孵育过夜,抗体HDAC4和pCREB稀释度分别为1∶100和1∶300。阴性对照用PBS代替一抗。使用Nikon显微镜10×40倍镜头,保持光学参数和曝光参数均一致,采集组织相同部位的免疫组化显色图片。采集的图片用Nikon80i显微拍摄系统中的形态分析软件进行平均光密度值(MOD)统计。
1.5统计学分析应用SPSS13.0软件进行t检验。
2结果
2.1血脂水平检测治疗组小鼠中总胆固醇(CHO)〔(12.43±2.30)mmol/L〕和低密度脂蛋白胆固醇(LDL-C)〔(2.58±0.74)mmol/L〕含量均低于模型组〔(19.69±3.94)、(3.65±0.43)mmol/L〕(P< 0.05),虽然治疗组甘油三酯(TG)的水平〔(2.11±0.64)mmol/L〕低于模型组〔(3.01±0.83)mmol/L〕,但差异无显著性(P> 0.05)。
2.2H-E染色细胞核被苏木精染为蓝色,细胞质被伊红染为红色。海马区神经元锥体细胞紧密排列,而皮质区神经元细胞分布较稀疏。治疗组海马区和皮质区的神经元细胞核固缩,浓染现象要轻于模型组,表明阿伐他汀治疗后神经元变性现象减轻。见图1。
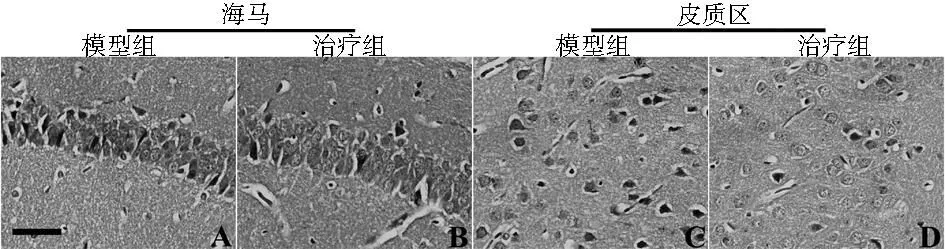
标尺=50 μm 图1 小鼠海马区和大脑皮质区H-E染色
2.3免疫组化显色免疫组化阳性产物为棕黄色颗粒,用PBS代替一抗的阴性对照未见棕黄色颗粒物。HDAC4和pCREB在海马区和大脑皮质区的细胞核和质中均有表达,见图2。阿伐他汀处理后,海马区和大脑皮质区HDAC4的表达均降低(P<0.05);阿伐他汀处理后,pCREB在海马区和大脑皮质区的表达均升高(P<0.05)。见图3。
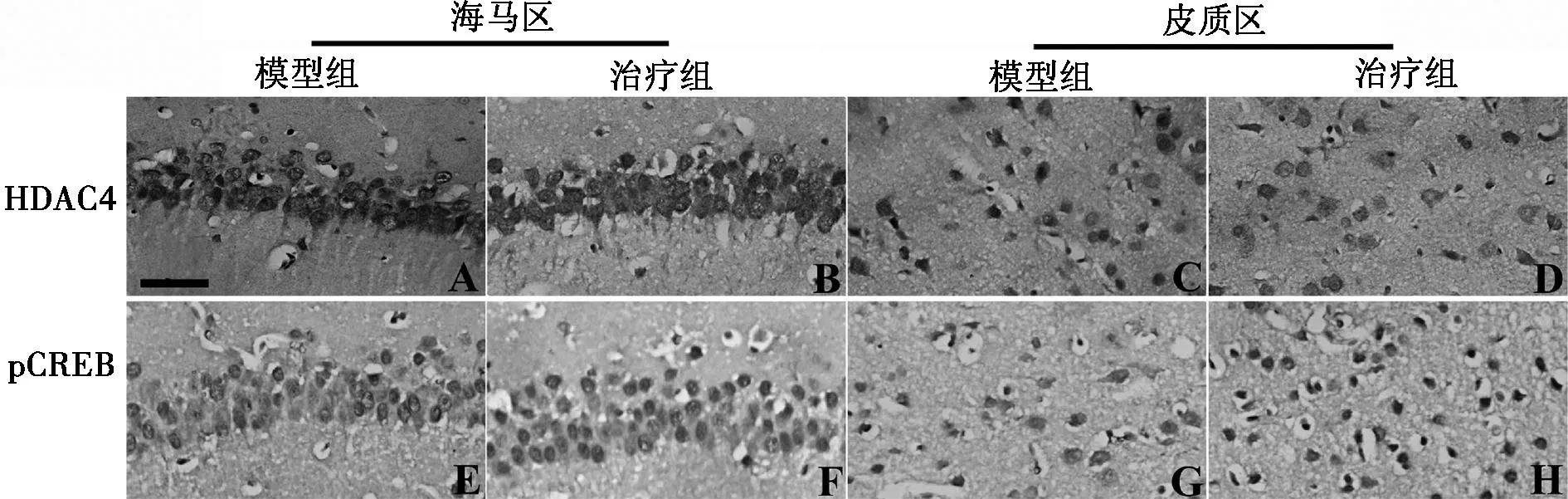
标尺=50 μm 图2 小鼠海马区和大脑皮质区 HDAC4和 pCREB免疫组化显色
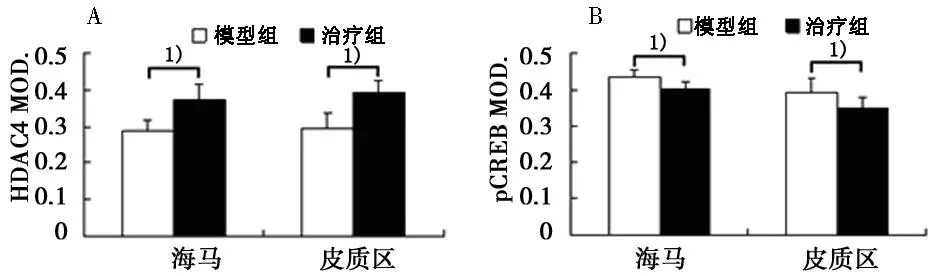
1)P<0.05 图3 HDAC4和pCREB在小鼠海马区和 大脑皮质区的表达
3讨论
流行学研究表明,他汀类药物对AD病人症状有保护作用〔4〕,尤其对于具有高脂血症的AD病人,但机制目前还不清楚。
近期研究发现表观遗传调控因子尤其是组蛋白乙酰化修饰在神经发育和调控中具有重要作用〔5〕。组蛋白乙酰化水平通过组蛋白乙酰化酶(HATs)和HDACs共同调控。HAT作用是为组蛋白提供乙酰基使组蛋白乙酰化水平提高,促进转录因子与DNA序列接合,激活相关基因表达。HDAC主要作用是降低染色质乙酰化水平,抑制基因的表达〔6〕。临床AD病人和模型动物脑组织的染色质乙酰化水平均显著降低。HDAC在高脂血症和动脉粥样硬化的发生发展过程中具有重要调控作用〔7〕。HDACs家族共有11个成员,分为四大类,目前已证明HDAC2、3和4在神经生长发育和记忆认知方面具有负调控作用〔8,9〕,我们前期研究也发现HDAC4在ApoE基因敲除小鼠海马区表达显著升高。HDAC作为一类染色质修饰因子,是通过调控转录因子进而调节下游功能基因表达影响神经的生长发育,而CREB是调控神经生长发育的重要转录因子。 Vecsey等〔10〕已证明HDAC通过CREB负调控记忆与突触的可塑性,Bolger等〔11〕用带有荧光酶素报告基因的CRE响应原件,发现HDAC4转移至核内将直接抑制CREB的转录活性。
本实验结果表明阿伐他汀可能通过降低HDAC4在脑部的表达引起染色质乙酰化水平提高,激活转录因子pCREB,促进下游调控基因Bcl-2、BDNF、Synaptophysin和SNAP25等的表达。其调控机制可能为HDAC4表达被抑制后激活了CREB介导的转录调控程序性细胞存活机制(PCL〔12,13〕),(1)促进Bcl-2表达,抑制神经元凋亡;(2)提高神经生长因子BDNF、突触素相关蛋白Synaptophysin和SNAP25表达,增强神经元活性;(3)除了阿伐他汀可以降低血管性炎症反应,CREB介导的PCL机制也可以减少Aβ表达和沉积,减弱神经炎症反应;最终促进神经细胞生长发育,提高记忆认知能力〔14,15〕。本实验结果表明HDAC4调控的CREB转录激活途径可能在阿伐他汀治疗高脂血症引起的脑神经退行性疾病具有重要作用,为阐明其治疗机制提供了形态学依据。
4参考文献
1Fischer A,Sananbenesi F,Mungenast A,etal.Targeting the correct HDAC(s) to treat cognitive disorders〔J〕.Trends Pharmacol Sci,2010;31(12):605-17.
2李报,黄大可,桂丽,等.组蛋白去乙酰化酶3和4在ApoE基因敲除小鼠海马CA1和CA3区神经元内的表达变化〔J〕.解剖学杂志,2014;37(1):34-7.
3Liu CC,Kanekiyo T,Xu H,etal.Apolipoprotein E and Alzheimer disease:risk,mechanisms and therapy 〔J〕.Nat Rev Neurol,2013;9(2):106-18.
4Jick H,Zornberg GL,Jick SS,etal.Statins and the risk of dementia〔J〕.Lancet,2000;356(9642):1627-31.
5Gräff J,Tsai LH.Histone acetylation:molecular mnemonics on the chromatin 〔J〕.Nat Rev Neurosci,2013;14(2):97-111.
6Zovkic IB,Guzman-Karlsson MC,Sweatt JD.Epigenetic regulation of memory formation and maintenance 〔J〕.Learn Mem,2013;20(2):61-74.
7Eom GH,Kook H.Posttranslational modifications of histone deacetylases:implications for cardiovascular diseases〔J〕.Pharmacol Ther,2014;143(2):168-80.
8Guan JS,Haggarty SJ,Giacometti E,etal.HDAC2 negatively regulates memory formation and synaptic plasticity〔J〕.Nature,2009;459(7243):55-60.
9McQuown SC,Barrett RM,Matheos DP,etal.HDAC3 is a critical negative regulator of long-term memory formation〔J〕.J Neurosci,2011;31(2):764-74.
10Vecsey CG,Hawk JD,Lattal KM,etal.Histone deacetylase inhibitors enhance memory and synaptic plasticity via CREB:CBP-dependent transcriptional activation〔J〕.J Neurosci,2007;27(23):6128-40.
11Bolger TA, Yao TP.Intracellular trafficking of histone deacetylase 4 regulates neuronal cell death 〔J〕.J Neurosci,2005;25(41):9544-53.
12Sakamoto K,Karelina K,Obrietan K.CREB:a multifaceted regulator of neuronal plasticity and protection〔J〕.J Neurochem,2011;116(1):1-9.
13Dragunow M.CREB and neurodegeneration〔J〕.Front Biosci,2004;9:100-3.
14Freitas AE,Bettio LE,Neis VB,etal.Sub-chronic agmatine treatment modulates hippocampal neuroplasticity and cell survival signaling pathways in mice〔J〕.J Psychiatr Res,2014;58:137-46.
15Fujii M,Sherchan P,Soejima Y,etal.Cannabinoid receptor type 2 agonist attenuates apoptosis by activation of phosphorylated CREB-Bcl-2 pathway after subarachnoid hemorrhage in rats〔J〕.Exp Neurol,2014;261:396-403.
〔2014-11-19修回〕
(编辑李相军)

