Orexin-A对癫痫大鼠学习记忆能力及海马齿状回神经细胞增殖的影响
Orexin-A对癫痫大鼠学习记忆能力及海马齿状回神经细胞增殖的影响
孙杰李筹忠王曲高方友
(贵州省人民医院神经外科,贵州贵阳550002)
摘要〔〕目的探讨Orexin-A(OXA)对癫痫大鼠学习记忆能力及海马齿状回神经细胞增殖的影响。方法选取健康成年SD大鼠50只,随机分为对照组、PTZ+NS组、PTZ+OXA组、PTZ+U0126组、PTZ+U0126+OXA组,每组10只。选用PTZ(30 mg/kg)腹腔注射造模。对照组和PTZ+NS组注射8 μl生理盐水,PTZ+OXA组注射等量1.5 nmol/μl的OXA,PTZ+U0126组注射等量的U0126,PTZ+U0126+OXA组分别注射等量U0126和OXA;注射后恢复饲养7 d后进行水迷宫试验。观察各组大鼠学习记忆能力,并采用免疫荧光染色法检测海马齿状回神经细胞增殖情况。结果与对照组相比,其余四组大鼠的逃避潜伏期明显变长(P<0.01)。PTZ+U0126组逃避潜伏期明显长于PTZ+NS组(P<0.01);PTZ+NS组、PTZ+U0126组、PTZ+U0126+OXA组逃避潜伏期明显长于PTZ+OXA组(P<0.05)。与对照组相比,其余四组大鼠穿越平台的次数、穿越平台所处象限的时间均明显减少(P<0.01);PTZ+OXA组、PTZ+U0126+OXA组大鼠穿越平台象限的次数、穿越平台所处象限的时间均明显多于PTZ+NS组(P<0.01)。PTZ+U0126+OXA组大鼠穿越平台象限的次数、穿越平台所处象限的时间明显少于PTZ+OXA组(P<0.01)。PTZ+U0126组海马齿状回区Brdu+/ DCX+细胞数明显低于PTZ+NS组(P<0.01);PTZ+NS组、PTZ+U0126组、PTZ+U0126+OXA组海马齿状回区Brdu+/DCX+细胞数明显低于PTZ+OXA组(P<0.05)。结论OXA能够通过促进齿状回颗粒细胞的再生改善癫痫大鼠的学习记忆能力,其可能与ERK1/2激活有关。
关键词〔〕癫痫;Orexin-A;学习记忆;神经细胞
中图分类号〔〕R749〔文献标识码〕A〔
通讯作者:高方友(1972-),男,博士,教授,硕士生导师,主要从事癫痫的发病机制研究。
第一作者:孙杰(1988-),男,硕士,主要从事癫痫的发病机制研究。
长期癫痫发作会降低学习记忆能力,对患者的日常生活造成严重影响。目前认为,癫痫主要通过破坏神经元、打破神经肽与神经递质间的平衡等多种机制损伤学习记忆能力〔1〕。Orexins为一种兴奋性神经肽,对神经内分泌、体内能量代谢、进食等多方面发挥关键的调控作用。近年来研究显示,Orexin-A(OXA)能够激活细胞外信号调节激酶(ERK1/2)参与细胞生长和增殖〔2〕。研究发现OXA能够提高癫痫大鼠的学习记忆能力,但该作用是否通过激活ERK1/2来实现至今仍不明确〔3〕。本次研究探讨OXA对癫痫大鼠学习记忆能力、均马齿状回神经细胞增殖的影响。
1材料与方法
1.1动物与分组选取健康成年SD大鼠50只,清洁级,体重150~180 g,吉林大学实验动物中心提供,合格证:SCXX-(吉)2003-0004。随机分为对照组、成四唑(PTZ)联合生理盐水(PTZ+NS)组、PTZ+OXA组、ER1/2抑制剂组(PTZ+U0126)组、PTZ+U0126+OXA组,每组10只。24℃温度下分笼喂养。
1.2部分仪器与试剂OXA(上海玉博生物科技有限公司);U0126(上海拜力生物科技有限公司);PTZ、嗅脱氧核苷尿嘧啶(BrdU)抗体(圣克鲁斯生物技术公司);小鼠抗大鼠BrdU单克隆抗体、山羊抗大鼠双肾上腺皮质激素(DCX)多克隆抗体(上海研晶生化试剂有限公司);兔抗山羊IgG、异硫氰酸荧光素(FITC)标记山羊抗小鼠IgG(武汉博士德生物工程有限公司)。泰盟Morris水迷宫视频跟踪分析系统WMT-100(成都泰盟软件有限公司)。脑立体定位仪、微量注射器(北京铭泰佳信科技有限公司)。
1.3大鼠癫痫模型建立除对照组外的四组大鼠每日清晨8时给予PTZ(30 mg/kg)腹腔注射,观察0.5~1 h,联系30 d,到符合造模成功标准时为止。对照组大鼠同时间注射等量生理盐水。大鼠癫痫症状的判断依据Racine分级标准:Ⅰ级:出现立须等面部抽搐;Ⅱ级:颈部肌肉痉挛,主要表现为点头;Ⅲ级:单侧前肢抽搐;Ⅳ级:双侧前肢抽搐,同时伴身体直立;Ⅴ级:双侧后肢强直,用时伴全身阵挛。连续出现Ⅳ级及以上≥3次为造模成功。
1.4药物侧脑室注射用10%的水合氯醛(300 mg/kg)麻醉造模成功后的大鼠,固定在脑立体定位仪上,将不锈钢微导管插入后固定。对照组和PTZ+NS组注射8 μl生理盐水,PTZ+OXA组注射等量1.5 nmol/μl的OXA,PTZ+U0126组注射等量U0126,PTZ+U0126+OXA组分别注射等量OXA、U0126。注射后恢复饲养7 d后进行水迷宫试验。
1.5Morris水迷宫试验(1)定位航行试验:首日将大鼠放入水池中自由游泳3 min,熟悉池中环境;第2天起,分别于每日上午、下午分别测试1次,每次测试均让大鼠从四个象限中各入水1次,记录寻找平台的线路图,爬上平台所用时间为逃避潜伏期和游泳速度。若在2 min内仍未寻找到平台,则将其放在平台上休息30 min,记录潜伏期为2 min,训练时间间隔1 min。(2)空间搜索试验:完成定位航行试验后第2天将水池中的平台拿去,从同一个象限将大鼠放入水池中,记录2 min内经过平台所在位置的次数和在平台所在象限的游泳时间。
1.6海马齿状回Brdu和DCX表达检测采用免疫荧光染色法,用Brdu和DCX进行荧光双标记,对新生细胞的增殖、迁移进行检测。各组大鼠在Morris水迷宫试验结束后12、24 h分别腹腔注射BrdU,剂量为100 mg/kg。7 d后麻醉大鼠,先用200 ml生理盐水快速灌注,再用4%多聚甲醛溶液250 ml先快后慢灌注30 min,取脑组织并制作成20 μm的海马连续冠状切片。修复抗原30 min后,用2 mol/L的盐酸在常温条件下孵育30 min后用2 mol/L的硼酸溶液相同条件下孵育30 min,行DNA变性;磷酸盐缓冲液(PBS)彻底洗净后,加入小牛血清封闭液孵育60 min,将封闭液弃去后加入DCX多克隆抗体(1∶100)在4℃环境中放置过夜;PBS彻底洗净后加入相应的荧光二抗,孵育60 min;PBS彻底洗净后封片。观察Brdu和DCX的荧光表达。
1.7统计学方法应用SPSS18.0软件行t检验。
2结果
2.1行为学观察注射PTZ第3~5天后,TZ+NS组、PTZ+OXA组、PTZ+U0126组、PTZ+U0126+OXA组大鼠均表现面部抽搐。第5~7天出现颈部肌肉抽搐;8~17 d,多数大鼠癫痫发作达Ⅲ级,出现单侧前肢抽搐;17~25 d,癫痫发作达Ⅳ~Ⅴ级,出现双侧前肢抽搐,并伴身体直立。30 d时,90.00%大鼠造模成功。其中3只大鼠死亡,4只大鼠未达造模成功标准而剔除。最终TZ+NS组8只、PTZ+OXA组9只、PTZ+U0126组8只、PTZ+U0126+OXA组8只。
2.2水迷宫试验结果
2.2.1定位航行试验随训练时间延长,各组大鼠的平均逃避潜伏期均缩短。与对照组相比,其余四组大鼠的逃避潜伏期明显变长(P<0.01),PTZ+U0126组逃避潜伏期明显长于PTZ+NS组(P<0.01);PTZ+NS组、PTZ+U0126组、PTZ+U0126+OXA组逃避潜伏期明显长于Frz+OXA组(P<0.05 ,P<0.01)。见表1。
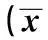
表1 各组定位航行试验潜伏期比较 ± s)
2.2.2空间搜索试验对照组中大鼠游泳轨迹清晰,部分接近直线,目的性强;PTZ+Ns组大鼠游泳轨迹混乱,无目的性;PTZ+OXA组大鼠游泳轨迹清晰;PTZ+U0126组大鼠游泳轨迹杂乱;PTZ+U0126+OXA组大鼠游泳轨迹较为清晰。与对照组相比,其余四组大鼠穿越平台的次数、穿越平台所处象限的时间均明显减少(P<0.01);PTZ+OXA组、PTZ+U0126+OXA组大鼠穿越平台象限的次数、穿越平台所处象限的时间均明显多于PTZ+NS组(P<0.01);但PTZ+U0126组大鼠穿越平台象限的次数及所在象限的时间均明显减少。PTZ+U0126+OXA组大鼠穿越平台象限的次数及所在象限的时间明显少于PTZ+OXA组(P<0.01)。见表2。
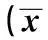
表2 各组空间搜索试验穿越平台次数和象限的
2.3各组大鼠海马齿状回DCX和Brdu表达情况比较各组大鼠均有DCX表达,多集中在齿状回颗粒下区,少数在门区。Brdu表达多集中在齿状回颗粒下区。多数Brdu+细胞有DCX+表达,Brdu+/ DCX+表达多集中于齿状回颗粒下区,见图1~图3。海马齿状回区Brdu+/DCX+细胞数在PTZ+NS组和对照组之间无统计学差异(P>0.05)。PTZ+U0126组海马齿状回区Brdu+/ DCX+细胞数明显低于PTZ+NS组(P<0.01);与PTZ+OXA组相比,PTZ+NS组、PTZ+U0126组、PTZ+U0126+OXA组海马齿状回区Brdu+/DCX+细胞数明显减少(P<0.05,P<0.01)。

A为对照组;B为PTz+NS组;C为PTZ+OXA组;D为PTZ+U0126组;E为PTZ+U0126+OXA组(下图同) 图1 大鼠海马齿状回DCX+细胞表达(×400)

图2 大鼠海马齿状回Brdu+细胞表达(×400)
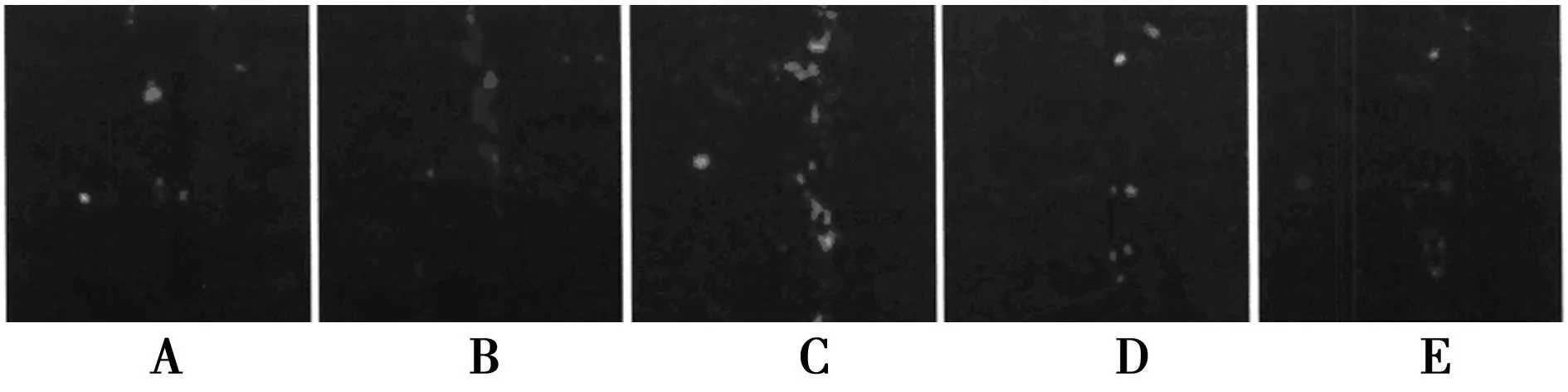
图3 大鼠海马齿状回Brdu+/ DCX+细胞表达(×400)
3讨论
临床对癫痫的治疗不应只停留在对病情的有效控制,通过改善认知功能,提升患者的生活质量已成为癫痫治疗的最终目的〔4〕。癫痫病情发展损伤海马神经、突触等相关结构,脑中神经递质失衡、电生理紊乱等多种原因共同引起了癫痫患者学习记忆能力障碍。癫痫反复发作会降低CSF、OXA水平,也是引起记忆能力障碍的可能原因之一〔5〕。本研究说明OXA能明显缩短PTZ导致的癫痫大鼠逃避潜伏期。研究认为,重度癫痫会对海马细胞迁移、增殖能力造成严重影响,引起非正常的神经元环路,损伤学习记忆能力〔6〕。本次研究中,PTZ+OXA组齿状回颗粒下层多见增殖的Brdu+细胞,树突向分子层伸展与CA3区域的神经元相连,共同构建起局部突触联系,促进长时程增强效应(LTP)的生成,说明OXA可有效提高记忆再现能力。
中枢神经系统中,ERK1/2广泛表达可协调神经元对外界刺激信号及时作出反应,改善学习记忆能力〔7〕。本次研究说明ERK1/2的激活不但会缓解癫痫大鼠空间学习记忆能力减退,还会降低OXA水平,使癫痫大鼠的学习记忆能力得到改善,提示OXA参与学习记忆的过程与激活ERK1/2密切相关。
相关研究认为,癫痫病情发作可引发ERK1/2的过度激活,加重癫痫对脑组织的损伤;但ERK1/2在病情发作后存在一过性激活,可作为一种保护性代偿反应〔8〕。本次研究中,ERK1/2抑制剂能够使癫痫对海马CA3区域神经细胞的损伤加重,对OXA促进新生颗粒细胞迁移至颗粒层起明显抑制作用。可见OXA激活ERK1/2可能通过抑制海马区细胞凋亡、调节神经突触可塑性形成、促进齿状回颗粒细胞的增殖,改善学习记忆能力。
综上所述,OXA可有效提升癫痫大鼠的学习记忆能力,可能与激活ERK1/2、促进海马齿状回神经细胞增殖相关。但如何防止过度激活ERK1/2,诱导海马齿状回神经细胞再生,将新生的神经元加入进神经环路中仍需要进一步研究。
4参考文献
1王学峰,王亮.癫痫发病中的突触机制〔J〕.中国神经免疫学和神经病学杂志,2010;17(4):235-7.
2谢涛.EGCG对戊四氮致痫大鼠的保护作用及机制探讨〔D〕.石家庄:河北医科大学硕士学位论文,2012.
3史丽敏,余俊先.药物相关性癫痫的发作机制分析〔J〕.中国医院用药评价与分析,2011;11(1):65-7.
4胡以达,王学峰.癫痫研究新进展-2008年〔J〕.中国神经精神疾病杂志,2009;35(8):511,封3.
5孙红柳.低频率电刺激海马CA3区对大鼠杏仁核电点燃癫痫的作用机制研究〔D〕.杭州:浙江大学硕士深位论文,2011.
6赖娅莉.星形胶质细胞在癫痫发病机制中的作用研究进展〔J〕.实用医院临床杂志,2011;8(4):202-5.
7李雪峰,刘绍明.外伤后癫痫发病机制的研究进展〔J〕.中华神经医学杂志,2007;6(11):1181-2,1188.
8许正浩.低频率深部脑刺激对大鼠电点燃癫痫的干预作用及其机制研究〔D〕.杭州:浙江大学硕士学位论文,2012.
〔2015-03-19修回〕
(编辑袁左鸣)

