MPTP对不同年龄快速老化小鼠血清环氧化酶-2的影响
MPTP对不同年龄快速老化小鼠血清环氧化酶-2的影响
马晓伟张忠霞李晓丽王彦永王铭维
(河北医科大学第一医院神经内科河北省脑老化与认知神经科学实验室,河北石家庄050031)
摘要〔〕目的探讨不同年龄快速老化小鼠(SAMP8)急性注射1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)后血清环氧化酶-2(COX-2)的动态改变。方法选用健康雌性3、6、10月龄SAMP8小鼠各36只,随机分为对照组和用药组。用药组小鼠背部皮下注射MPTP 14 mg/kg,1次/2 h,共4次,制成急性损伤模型;对照组小鼠给予同量生理盐水。分别于第1次给药后1、3、7 d进行行为学观察及生化指标的检测。采用旷场实验观察其运动功能,高效液相色谱法检测黑质多巴胺(DA)含量,酶联免疫吸附法(ELISA)检测血清环氧化酶(COX)-2的表达,比较不同年龄组SAMP8小鼠各时间点损伤的差异。结果各年龄组MPTP小鼠水平穿格数与垂直站立次数均减少,DA水平明显下降,与对照组相比差异显著(P<0.05),与3、6月龄相比,10月龄小鼠上述指标下降更明显;各用药组小鼠血清COX-2表达从第1天开始即明显增高(P<0.05),第3天增高最明显,第7天比第3天略有回落,10月龄小鼠比3、6月龄升高更显著(P<0.05)。结论衰老是影响帕金森病(PD)模型黑质纹状体系统损伤的重要因素,并且与环境毒素起协同作用;氧化应激参与了PD早期发病的病理反应过程,并随PD的进展呈动态变化,其反应程度与年龄有关。
关键词〔〕年龄;MPTP;快速老化小鼠;环氧化酶-2;帕金森病(PD)
中图分类号〔〕R741〔文献标识码〕A〔
基金项目:河北省医学科学研究重点课题计划(20110302)
通讯作者:王铭维(1956-),女,教授,主任医师,博士,博士生导师,主要从事脑老化与退行性疾病研究。
第一作者:马晓伟(1980-),女,硕士,主治医师,主要从事神经内科疾病研究。
快速老化小鼠(SAMP8)是一种生长周期较快的近交系小鼠,在研究衰老和衰老相关性疾病中有显著优势〔1,2〕。帕金森病(PD)是一种常见的年龄相关的慢性神经退行性疾病,临床多表现为运动迟缓、肌僵直和静止性震颤,黑质纹状体多巴胺(DA)能神经元的选择性损伤为其主要病理学改变,60岁以上老年人发病率在2%左右〔3〕。衰老与毒素是PD发病的主要因素,氧化应激是目前发病机制的关注热点。利用选择性损伤DA能神经元的神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)研究PD,已成为目前公认的理想模型〔4〕。前列腺素E2的合成限速酶环氧化酶(COX)-2能够通过产生活性氧簇(ROS)介导DA的氧化及氧化应激的发生〔5〕,在PD的发生发展中发挥重要作用,而PD氧化应激反应的增龄性改变目前尚未见报道。本实验利用SAMP8小鼠制作PD模型,通过检测不同年龄小鼠血清COX-2水平,观察衰老与毒素的双重影响,初步探讨其动态改变与PD病程之间的关系。
1材料与方法
1.1实验动物SAMP8雌性小鼠108只,3、6、10月龄各36只,体质量(28±2)g,清洁级,由香港中文大学解剖学系惠赠。
1.2主要试剂与仪器MPTP(Sigma,USA)、超低温离心机(德国eppendorf,5417R)、多功能酶标仪(美国Thermo Labsystems,SN 354-01015)。
1.3实验分组与给药各月龄小鼠均随机分为:生理盐水对照组和MPTP用药组各18只,小鼠背部皮下注射MPTP(Sigma,USA),每次14 mg/kg,连续注射4次,每次间隔2 h;对照组每次均注射等体积无菌生理盐水。每组分别于第1次注射后1、3、7 d 3个时间点处死,每个时间点6只。
1.4行为学检测采用旷场实验检测各组小鼠给药后1、3、7 d的自主活动水平。实验装置由旷场实验箱、图像采集系统和操作分析系统组成。实验箱长×宽×高为40 cm×40 cm×40 cm,并划分为16个4 cm×4 cm的方格;实验箱正上方为摄像装置。置于暗光动物照明、环境安静的场所。实验时将小鼠置于方箱的正中央,观察其5 min内活动情况,记录其垂直站立次数(前肢离开地面1 cm以上的次数)与水平穿格次数(三爪以上跨入邻格)。每只小鼠实验结束,用90%酒精擦拭,以免留下气味影响其他小鼠。
1.5标本留取体积分数10%水合氯醛麻醉小鼠,从眼球取血,离心取血清;之后迅速断头取脑,在冰上剥离出中脑组织,电子天平称重,置于液氮中冷冻。血清与组织均置于-80℃保存备用。
1.6DA水平的检测采用高效液相-电化学法(HPLC-ECD)检测中脑DA含量,送检于首都医科大学神经科学研究所。
1.7COX-2水平的检测采用双抗夹心酶联免疫法(ELISA)测定各组小鼠血清中COX-2的含量。样品及标准品均采用复孔,最终反应底物用酶标仪比色测定。
1.8统计学处理采用SPSS13.0软件行单因素方差分析及SNK检验。
2结果
2.1旷场实验结果与对照组相比,用药组小鼠水平穿格次数与垂直站立次数均显著减少(P<0.01);与3、6月龄小鼠相比,10月龄小鼠在第1、3、7 d次数下降更明显,尤其是垂直站立次数(P<0.05)。见表1,表2。
2.2DA水平的改变与对照组相比,注射MPTP后各月龄小鼠DA水平在1、3、7 d均明显下降(P<0.01),各时间点之间无显著性差异(P>0.05)。而在第1、3、7 d 各个时间点,10月龄小鼠均比3、6月龄下降更明显(P<0.05)。见表3。
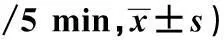
表1 不同年龄组SAMP8小鼠各时间点水平
与对照组比较:1)P<0.05,2)P<0.01;与3、6月龄比较:3)P<0.05,下表同
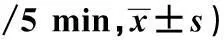
表2 不同年龄组SAMP8小鼠各时间点垂直
2.3COX-2的表达与对照组相比,用药组小鼠COX-2表达从第1天开始即明显增高,并在第3天出现高峰,之后第7天略有下降(P<0.05);与3、6月龄小鼠相比,各时间点10月龄小鼠COX-2表达水平升高最明显(P<0.05)。见表4。

表3 各组SAMP8小鼠各时间点DA含量
与对照组比较:1)P<0.01 ;与3、6月龄组比较:2)P<0.05
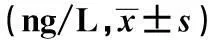
表4 不同年龄组SAMP8小鼠各时间点血清
与对照组比较:1)P<0.05;与3、6月龄比较:2)P<0.05
3讨论
目前,60岁以上人群中PD的发病已达2%〔3〕,而其发病机制却尚未明确,衰老、环境、氧化应激、炎症、遗传等多种因素可能起到了协同作用〔6〕。SAMP8小鼠是日本京都大学Takeda等人培育得到的快速老化小鼠,寿命一般为12~13个月,在渡过一段正常生长期(4~6月龄)后迅速出现行动反应迟缓、被毛光泽减退、脱毛等自然老化特征〔7〕,是目前公认的研究衰老和衰老相关性疾病的理想的动物模型〔2〕。MPTP在单胺氧化酶B的作用下转变为有毒性的为1-甲基-4-苯基吡啶(MPP+),通过黑质纹状体末梢优先聚集,并成百倍地聚集于线粒体内,通过特异性抑制氧化呼吸链复合体Ⅰ和电子传递,促进活性氧簇和过量一氧化氮的生成而导致DA能神经元的损伤,其神经毒性作用已在多种动物中得到证实,成为研究PD的理想模型。
本实验说明其黑质纹状体系统的DA能神经元受损,自发活动水平下降,证实这种快速衰老小鼠对于MPTP同样易感,可以成功复制PD模型,衰老是PD发病的影响因素之一,衰老与毒素二者起到了协同作用。
氧化应激是导致DA能神经元损伤的主要因素之一。COX-2是催化花生四烯酸合成前列腺素的限速酶,不仅是早期炎症反应的生物学指标之一〔8〕,并且通过产生ROS引发氧化应激反应,介导了MPP+所致的神经毒性作用,参与PD的病理机制〔9,10〕。研究认为,COX-2可以将体内的DA氧化为有活性的DA-醌类,而这些DA-醌类可以使α-突触核蛋白聚集,之后导致PD的病理性标志物路易小体的形成〔9,11,12〕,而COX-2抑制剂也是通过阻止COX-2介导的DA的氧化而起到神经保护作用〔5〕。本实验通过检测SAMP8小鼠血清中COX-2的动态变化,发现MPTP可使其反应性增高,而老龄小鼠的增高比年轻小鼠更加明显。同时,与既往那些检测组织标本或细胞内COX-2变化的研究相比,临床应用取材方便,简单易行,并便于复查,患者容易接受,为临床寻找血液检测氧化应激指标起到了重要的提示作用。综上所述,衰老与环境毒素都是影响PD发病的重要因素,并且二者起到了协同作用。氧化应激反应是PD的发病机制之一,其相关的氧化应激指标随着PD的发生发展具有一些特征性的动态变化,尤其是血清而不是组织检测COX-2简易可行,对临床早期辅助诊断和病情检测具有一定的指导意义,但能否应用于临床还需进一步研究证实。
4参考文献
1Colas D,Gharib A,Bezin L,etal.Regional age-related changes in neuronal nitric oxide synthase (nNOS),messenger RNA levels and activity in SAMP8 brain〔J〕.BMC Neurosci,2005;28(4):615.
2Zhang L,Li Q,Wolff LT,etal.Changes of brain activity in the aged SAMP mouse〔J〕.Biogerontology,2007;8(2):81-8.
3Sowell RA,Owen JB,Butterfield DA,etal.Proteomics in animal models of Alzheimer's and Parkinson's diseases〔J〕.Ageing Res Rev,2009;8(1):1-17.
4Yokoyama H,Kuroiwa H,Yano R,etal.Targeting reactive oxygen species,reactive nitrogen species and inflammation in MPTP neurotoxicity and Parkinson's disease〔J〕.Neurol Sci,2008;29(5):293-301.
5Hsieh YC,Mounsey RB,Teismann P.MPP+-induced toxicity in the presence of dopamine is mediated by COX-2 through oxidative stress〔J〕.Naunyn-Schmiedeberg's Arch Pharmacol,2011;384(2):157-67.
6Cookson MR.The biochemistry of Parkinson's disease〔J〕.Ann Rev Biochem,2005;74:29-52.
7Cenci MA,Whishaw IQ,Schallert T.Animal models of neurological deficits:how relevant is the rat〔J〕.Nat Rev Neurosci,2002;3(7):574-9.
8Wang T,Pei Z,Zhang W,etal.MPP+-induced COX2 activation and subsequent dopaminergic neurodegeneration〔J〕.FASEB J,2005;19(9):1134-6.
9Teismann P,Tieu K,Choi DK,etal.Cyclooxygenase-2 is instrumental in Parkinson's disease neurodegeneration〔J〕.Proc Natl Acad Sci USA,2003;100(9):5473-8.
10Teismann P,Vila M,Choi DK,etal.COX-2 and neurodegeneration in Parkinson's disease〔J〕.Ann N Y Acad Sci,2003;991:272-7.
11Periquet M,Fulga T,Myllykangas L,etal.Aggregated alpha-synuclein mediates dopaminergic neurotoxicity in vivo〔J〕.J Neurosci,2007;27(12):3338-46.
12Wilson CA,Murphy DD,Giasson BI,etal.Degradative organelles containing mislocalized alpha-and beta-synuclein proliferate in presenilin-1 null neurons〔J〕.J Cell Biol,2004;165(3):335-46.
〔2014-01-17修回〕
(编辑赵慧玲/曹梦园)

