水溶性丁二酸酐酰化壳聚糖纳米凝胶的制备及其pH响应性研究
(青岛科技大学橡塑材料与工程教育部重点实验室山东省橡塑材料与工程重点实验室,山东青岛266042)
纳米粒子凝胶化[1-3]是近年来的研究热点,它既具有纳米粒子的表面效应(surface effect)和小尺寸效应(small size effect),又具备凝胶所特有的溶胀收缩性质,已被广泛应用于药物释放等领域。
壳聚糖是甲壳素N-脱乙酰基的产物,化学名称为(1,4)-2-氨基-2-脱氧-β-D-葡萄糖,是一种资源丰富、价格低廉的天然高分子,它具有良好的生物相容性[4-5]、生物可降解性[6]及抗肿瘤免疫增强作用[7-8],在生物医药[9-10]、食品化工、废水处理[11]等领域得到了广泛研究和应用。但壳聚糖溶解性较差,需要通过物理或化学改性[12-13]改善它的溶解性以扩大其应用范围。丁二酸酐酰化壳聚糖是一种水溶性的壳聚糖衍生物,由壳聚糖与丁二酸酐发生酰化反应得到。壳聚糖的酰化反应降低了壳聚糖分子内和分子间形成氢键的能力,破坏了壳聚糖分子链原有的规整性,导致其结晶性明显降低,使得丁二酸酐酰化壳聚糖的水溶性大大提高,改善了壳聚糖成型加工性并扩大了其应用范围。
作者在室温下先制备了丁二酸酐酰化壳聚糖,通过元素分析探讨反应物料比对产物酰化取代度及水溶性的影响,然后将丁二酸酐酰化壳聚糖加入到甲酸溶液中通过自组装得到纳米凝胶粒子,通过扫描电子显微镜对粒子的形态进行表征与分析,利用粒径分析仪(DLS)研究粒子的粒径大小与溶液酸碱度的关系,拟为后续药物控制释放的研究奠定基础。
1 实验
1.1 试剂与仪器
低分子量壳聚糖(CS,脱乙酰度91%,Mn=20 000),青岛海汇生物工程有限公司;丁二酸酐(SAA),分析纯,天津光复精细化工研究所;无水碳酸钠、氢氧化钠、冰乙酸、丙酮、盐酸(质量分数36%)、甲酸等均为分析纯。
HC-3018型高速离心机;PHS-3C 型pH 计,上海雷磁;Zeta电位分析仪、粒径分析仪,英国马尔文仪器有限公司;TENSOR-27型傅立叶红外光谱仪(KBr压片);Vario EL Ⅲ型元素分析仪,德国;XRD-7000S/L型X-射线衍射仪;JSM-7500F 型扫描电子显微镜,日本电子。
1.2 丁二酸酐酰化壳聚糖的制备
称取2.0g壳聚糖于250 mL 圆底烧瓶中,加入150mL 蒸馏水,室温磁力搅拌30 min,使充分溶胀;按比例称取2.0g 无水碳酸钠和丁二酸酐,将二者混合均匀后均分为4份;每隔30min向圆底烧瓶中加入1份,加完后反应3h;用1mol·L-1的氢氧化钠溶液调反应液pH 值至10,离心;取上清液(沉淀物为未反应的壳聚糖),用冰乙酸调pH 值至3,得到大量银耳状凝胶物质,过滤,干燥,即得丁二酸酐酰化壳聚糖。
1.3 丁二酸酐酰化壳聚糖纳米凝胶粒子的制备
取制得的丁二酸酐酰化壳聚糖0.2g溶于50mL蒸馏水中,常温下搅拌使充分溶解;用注射器取0.5 mL缓慢滴入0.5mL的甲酸溶液中,溶液逐渐呈蓝色乳光液,常温下挥发溶剂,真空干燥,即得自组装的丁二酸酐酰化壳聚糖纳米凝胶粒子。
2 结果与讨论
2.1 反应物料比对产物酰化取代度和水溶性的影响(表1)
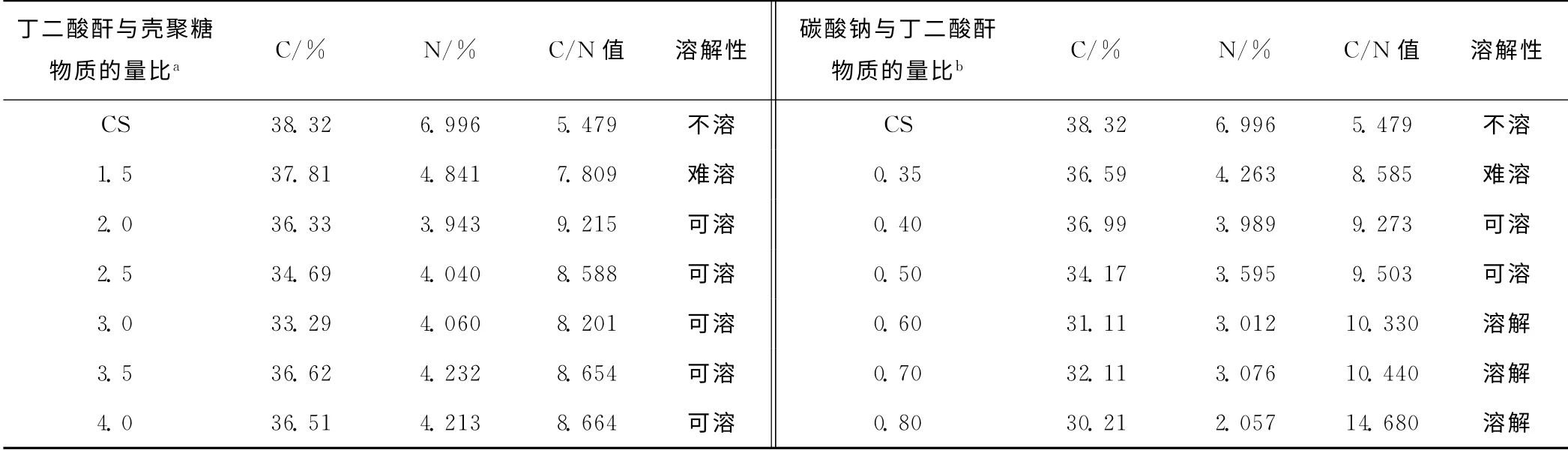
表1 反应物料比对产物酰化取代度和水溶性的影响Tab.1 The effect of material ratio on acylated substitution degree and water-solubility
由表1可以看出:(1)当丁二酸酐与壳聚糖物质的量比为1.5时,C/N 值较小,酰化程度较低,被取代的氨基数较少,氢键作用仍然很强,水溶性较差;而当物质的量比大于1.5时,随丁二酸酐加入量的增加,C/N值有较大提高,水溶性增强。综合考虑,丁二酸酐与壳聚糖物质的量比以2.0 为最佳,此时C/N 值最大。(2)随着碳酸钠与丁二酸酐物质的量比的增大,产物的C/N 值逐渐增大,酰化取代度逐渐增大;当物质的量比为0.80时,C/N 值达到最大,产物的酰化取代度较高且溶解性较好。因此,碳酸钠与丁二酸酐物质的量比以0.80为最佳。
2.2 FTIR分析(图1)
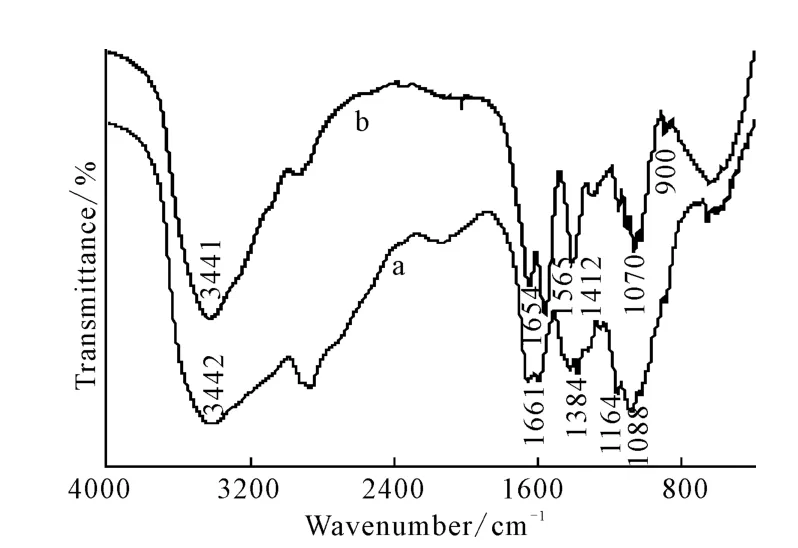
图1 壳聚糖(a)与丁二酸酐酰化壳聚糖(b)的红外光谱Fig.1 FTIR Spectra of chitosan(a)and succinyl chitosan(b)
由图1可以看出:3 441cm-1处是酰化壳聚糖中-NH2和-OH 的多重吸收峰;3 200~2 500cm-1处的吸收峰与壳聚糖相比,峰宽而散,说明-COOH 的存在;1 654cm-1处的宽峰为羧酸C=O 的特征峰;1 565cm-1处为酰胺中N-H 的弯曲振动峰;1 412 cm-1、1 070cm-1处是酰胺中C-N 的伸缩振动峰;900cm-1处是羧基中O-H 的面外弯曲振动峰。以上特征峰均显示丁二酸酐与壳聚糖发生了酰化反应,且酰化反应基本发生在氨基上。
2.3 XRD分析(图2)
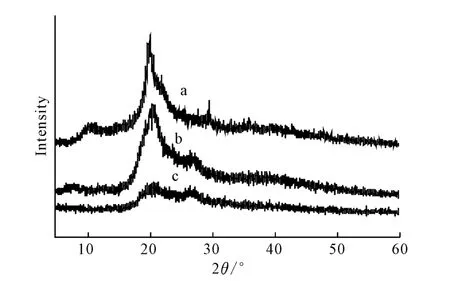
图2 壳聚糖(a)和丁二酸酐酰化壳聚糖(b、c)的XRD图谱Fig.2 XRD Patterns of chitosan(a)and succinyl chitosan(b,c)
由图2可知:(1)壳聚糖(a曲线)在2θ=10°、20°处有2个强衍射峰,这是壳聚糖分子结晶化程度的体现,是壳聚糖的特征衍射峰。(2)丁二酸酐酰化壳聚糖(b、c曲线)在2θ=10°处的衍射峰消失,在2θ=20°处的衍射峰强度减弱,说明丁二酸酐酰化反应一定程度上破坏了壳聚糖分子链原有的规整性,降低了壳聚糖分子内和分子间形成氢键的能力,结晶性明显降低;在2θ=25°~30°之间出现了新的衍射峰,说明丁二酸酐与壳聚糖反应后在产物中形成了一种不同于壳聚糖的新的结晶结构,这种结晶结构的形成可能与丁二酸酐酰化壳聚糖的侧链-NHCOCH2CH2COOH 的规整排列有关,且很明显地看到,当丁二酸酐与壳聚糖物质的量比为2.0时,2θ=20°处的衍射峰强度大大减弱(c曲线),氢键的作用力明显减小,结晶性能大幅降低,水溶性相应增强。
2.4 粒径分布及Zeta电位分析(图3)
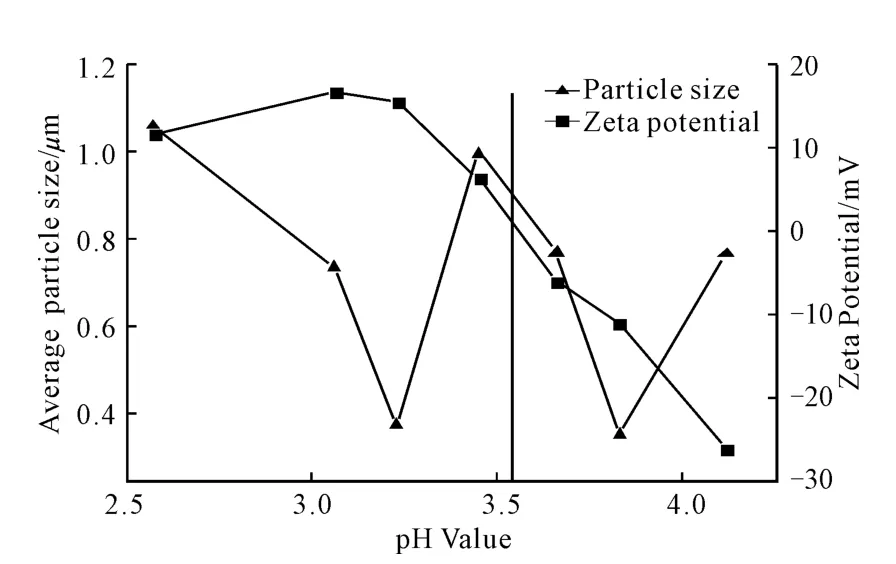
图3 丁二酸酐酰化壳聚糖的平均粒径和Zeta电位随溶液pH 值的变化Fig.3 Changes of average particle size and Zeta potential of succinyl chitosan with pH value of solution
由图3可以看出:存在一个等电点pI=3.54。当pH<3.54时,平均粒径随pH 值的减小先减小后增大,当pH=3.23时达到极小值。因为在酸性条件下,丁二酸酐酰化壳聚糖分子链通过氢键缔合而收缩使微粒平均粒径减小,但pH 值逐渐减小而使氢键作用力逐渐增大并相互交联形成网状结构,且pH 值小于pI值时粒子质子化带正电相互排斥,导致微粒平均粒径随着pH 值的减小逐渐增大;当pH=3.54时,溶液中的正负电荷达到平衡,静电作用消失,丁二酸酐酰化壳聚糖溶解度变小开始析出;当pH>3.54时,溶液中正负电荷重新出现,由于丁二酸酐酰化壳聚糖的羧基逐渐去离子化为-COO-带负电,当pH 值逐渐增大且当pH>3.82时电荷浓度逐渐增加,电荷之间的排斥作用随之增大,导致微粒平均粒径也逐渐变大。表明丁二酸酐酰化壳聚糖具有pH 响应性,可以作为智能型药物载体材料。
2.5 纳米凝胶粒子的粒径分布(图4)
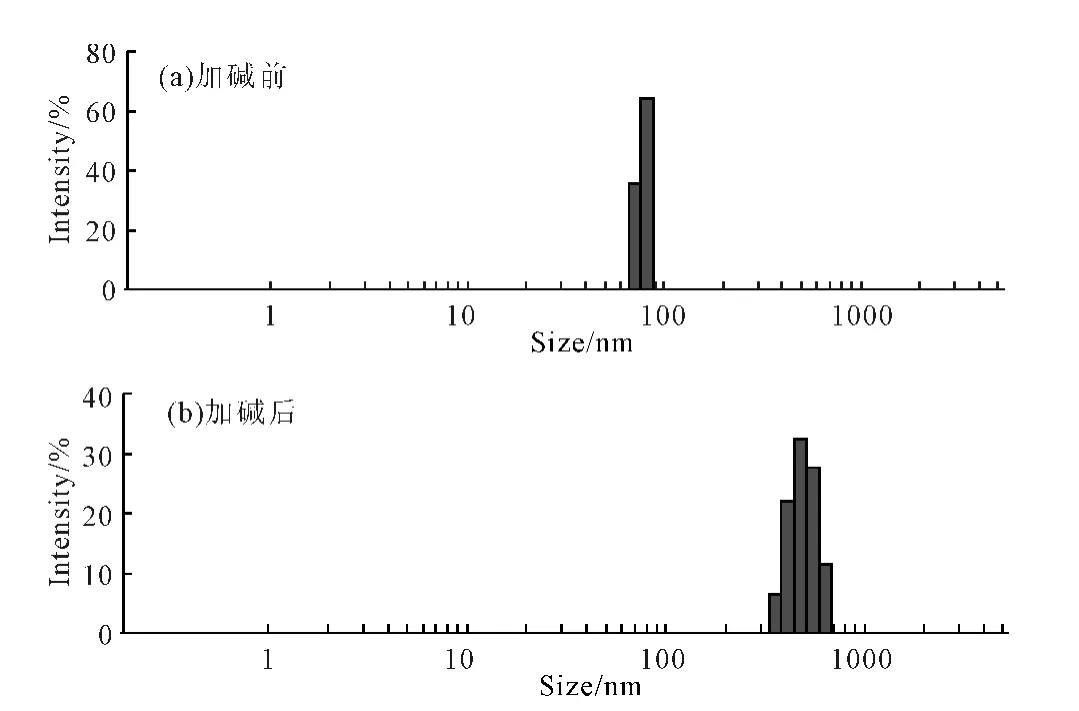
图4 丁二酸酐酰化壳聚糖纳米凝胶粒子在不同pH 值下的粒径分布Fig.4 Particle size distribution of succinyl chitosan nanogel particles at different pH values
由图4可以看出:纳米凝胶粒子在加碱前(酸性条件下)平均粒径为70~80nm;加碱后(碱性条件下)粒径明显增大,平均粒径为350~700nm。说明制得的纳米凝胶粒子在酸性条件下是收缩的,而在碱性条件下是溶胀的。表明该纳米凝胶粒子具有pH 响应性,可用于智能型药物缓释载体的制备,载药后可以实现在酸性条件下不释放、在碱性条件下释放的目的。
2.6 纳米凝胶粒子的SEM 分析(图5)
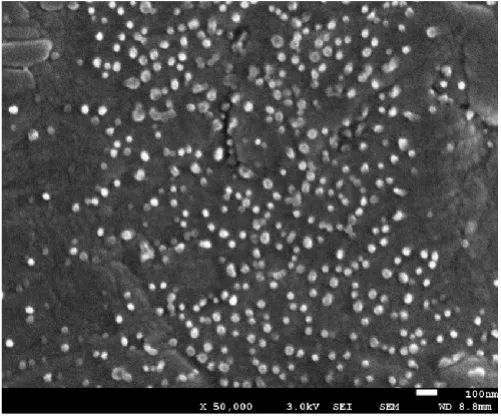
图5 丁二酸酐酰化壳聚糖纳米凝胶粒子的SEM 照片(×50000)Fig.5 SEM Images of succinyl chitosannanogel particles(×50000)
由图5可以看出:自组装法制备的丁二酸酐酰化壳聚糖纳米凝胶粒子呈球形,且大小均一、分散性好,粒径约为20~30nm。
3 结论
以水为介质、碳酸钠为催化剂,成功合成了丁二酸酐酰化壳聚糖。红外光谱分析表明,酰化反应基本发生在壳聚糖C-2位氨基上;元素分析表明,当丁二酸酐与壳聚糖物质的量比为2.0且碳酸钠与丁二酸酐物质的量比为0.80时,酰化产物的C/N 值最大即在壳聚糖上接枝的丁二酸酐的量最多,产物水溶性最好;酰化反应破坏了壳聚糖分子内和分子间的氢键相互作用,结晶性明显降低;Zeta电位分析发现存在一个等电点pI=3.54。SEM 照片显示采用自组装法制备的丁二酸酐酰化壳聚糖纳米凝胶粒子大小均一、分散性好,粒径为20~30nm;DLS表明纳米凝胶粒子在酸性条件下是收缩的,平均粒径为70~80nm,而在碱性条件下是溶胀的,平均粒径为350~700nm。综合分析发现丁二酸酐酰化壳聚糖纳米凝胶粒子具有pH 响应性,可以广泛应用于智能型药物载体的制备,为生物医学领域药物控制释放的研究奠定了基础。
[1]GU Z,DANG T T,MA M L,et al.Glucose-responsive microgels integrated with enzyme nanocapsules for closed-loop insulin delivery[J].ACS Nano,2013,7(8):6758-6766.
[2]GU Z,AIMETTI A A,WANG Q,et al.Injectable nano-network for glucose-mediated insulin delivery[J].ACS Nano,2013,7(5):4194-4201.
[3]CHEN D,SONG P,JIANG F,et al.pH-Responsive mechanism of a deoxycholic acid and folate comodified chitosan micelle under cancerous environment[J].Journal of Physical Chemistry B,2013,117(5):1261-1268.
[4]SHI B Y,SHEN Z Y,ZHANG H,et al.ExploringN-imidazolyl-O-carboxymethyl chitosan for high performance gene delivery[J].Biomacromolecules,2012,13(1):146-153.
[5]LIU T Y,CHEN S Y,LIN Y L,et al.Synthesis and characterization of amphiphatic carboxymethyl-hexanoyl chitosan hydrogel:Water-retention ability and drug encapsulation[J].Langmuir,2006,22(23):9740-9745.
[6]DONG W,HAN B Q,FENG Y L,et al.Pharmacokinetics and biodegradation mechanisms of a versatile carboxymethyl derivative of chitosan in rats:Invivoandinvitroevaluation[J].Biomacromolecules,2010,11(6):1527-1533.
[7]NAM T,PARK S,LEE S Y,et al.Tumor targeting chitosan nanoparticles for dual-modality optical/MR cancer imaging[J].Bioconjugate Chemistry,2010,21(4):578-582.
[8]LÜ P P,MA Y F,YU R,et al.Targeted delivery of insoluble cargo(paclitaxel)by PEGylated chitosan nanoparticles grafted with Arg-Gly-Asp(RGD)[J].Molecular Pharmaceutics,2012,9(6):1736-1747.
[9]AMOOZGAR Z,PARK J,LIN Q,et al.Low molecular-weight chitosan as a pH-sensitive stealth coating for tumor-specific drug delivery[J].Molecular Pharmaceutics,2012,9(5):1262-1270.
[10]SUNG H W,SONAJE K,LIAO Z X,et al.pH-Responsive nanoparticles shelled with chitosan for oral delivery of insulin:From mechanism to therapeutic applications[J].Accounts of Chemical Research,2012,45(4):619-629.
[11]wan NGAH W S,LIANG K H.Adsorption of gold(Ⅲ)ions onto chitosan andN-carboxymethyl chitosan:Equilibrium studies[J].Industrial & Engineering Chemistry Research,1999,38(4):1411-1414.
[12]WANG J,CHEN J S,ZONG J Y,et al.Calcium carbonate/carboxymethyl chitosan hybrid microspheres and nanospheres for drug delivery[J].Journal of Physical Chemistry C,2010,114(44):18940-18945.
[13]LAUDENSLAGER M J,SCHIFFMAN J D,SCHAUER C L.Carboxymethyl chitosan as a matrix material for platinum,gold,and silver nanoparticles[J].Biomacromolecules,2008,9(10):2682-2685.

