脂质体协同磷酸钙/DNA共沉淀的基因转染研究
(武汉工程大学材料科学与工程学院,湖北武汉430074)
基因治疗作为一种新的治疗方法在治疗威胁人类健康的重大疾病方面具有很好前景。近年来,科研人员发展了许多基因传递载体用于保护质粒DNA,防止其在体内降解失活、提高其被细胞摄取比例[1]。
磷酸钙是一类生物相容性好的生物材料,人体的牙齿和骨骼都含有磷酸钙。1973 年,Graham 等[2]发明了标准的磷酸钙转染方法,该法十分简单,只有两步:首先将氯化钙溶液与DNA 溶液混合,再与磷酸盐混合即得到磷酸钙与DNA(Ca-P/DNA)的共沉淀。DNA 能很好地吸附在磷酸钙上可能是因为磷酸钙与核酸上的磷酸根有较强的亲和力。
Ca-P/DNA 共沉淀技术是最常用的复合DNA 技术,具有操作简单、毒性小、体外转染效率高等优点,但是沉淀条件(如浓度、温度、pH 值、混合速率、沉淀时间等)难以控制,从而影响了转染效率的稳定性。此外,获得较高转染效率的同时还会带来较高的细胞毒性[3]。因此,Ca-P/DNA 共沉淀的基因转染效果重现性不好。但是基于磷酸钙很好的生物相容性和生物降解性,Maitra[4]甚至认为它是“第二代非病毒基因载体”。许多研究者对沉淀条件进行优化,从而提高了转染效率。Kakizawa等[5]用嵌段共聚物控制磷酸钙纳米粒子的粒径,提高了转染效率,并且用其成功传递siRNA;Olton 等[6]制备了单分散的磷酸钙纳米粒子(Ca/P 值高达110∶1~300∶1,粒径25~50nm),优化了沉淀条件,取得很高的转染效率。
由于Ca-P/DNA 共沉淀的转染效率与Ca/P 值密切相关,通常Ca/P值较小时,生成的沉淀纳米粒子多而转染效率高,但是细胞毒性也相对较大;Ca/P 值较大时,生成的沉淀纳米粒子少而转染效率低,细胞毒性小。因此,作者在此用少量商业化的脂质体Lipofectamine 2000复合未形成Ca-P/DNA 共沉淀的游离DNA,协同高Ca/P值的Ca-P/DNA 共沉淀以提高基因转染效率,并保持其较低的细胞毒性,以期获得一种低毒高效的基因转染方法。
1 实验
1.1 材料与试剂
人胚胎肾细胞(293T)和小鼠胚胎成纤维细胞(NIH3T3)均购自中国典型培养物保藏中心(武汉),用含10% 胎牛血清、2mg·mL-1NaHCO3和100U·mL-1双抗的DMEM(Gibco)培养基在37 ℃、5%CO2培养箱中培养。
报告基因质粒pGL3-Luc 购自Promega,在Escherichiacoli中扩增并用E.Z.N.A.fastfilter endo-free plasmid maxi kit(Omega)提取纯化,溶解在纯水中,于-20 ℃保存。
脂质体Lipofectamine 2000 购自Invitrogen。
二甲基亚砜(DMSO)、氯化钙、十水合磷酸三钠等均为分析纯,未经提纯直接使用。
1.2 Ca-P/DNA 共沉淀的制备
首先,将10μg 质粒DNA 与25μL 2mol·L-1CaCl2混合,再用去离子水稀释到204μL,然后将得到的溶液迅速加入到204μL 浓度分别为4.96mmol·L-1、1.65mmol·L-1、0.5 mmol·L-1的Na3PO4溶液中,混合均匀,即得到Ca/P 值分别为50、150、500的Ca-P/DNA 共沉淀,分别编号为A、B、C。
1.3 Lipofectamine 2000/DNA 复合物的制备
分别将0.1μL、0.2μL、0.4μL、1.0μL Lipofectamine 2000 和1μg 质粒DNA 用蒸馏水稀释到50μL,室温放置5min 后,将Lipofectamine 2000 水溶液加入质粒DNA 溶液中混合均匀,室温放置20 min,即得到Lipofectamine 2000 和DNA 比率(μL∶μg)分别为0.1∶1、0.2∶1、0.4∶1、1.0∶1的Lipofectamine 2000/DNA 复合物,分别编号为A′、B′、C′、D′。
1.4 脂质体协同Ca-P/DNA 共沉淀的制备
向不同Ca/P值的Ca-P/DNA 共沉淀悬液中加入不同量的Lipofectamine 2000,混合均匀后,室温放置20min,即得到脂质体协同Ca-P/DNA 共沉淀,分别编号(表1)进行基因转染研究。
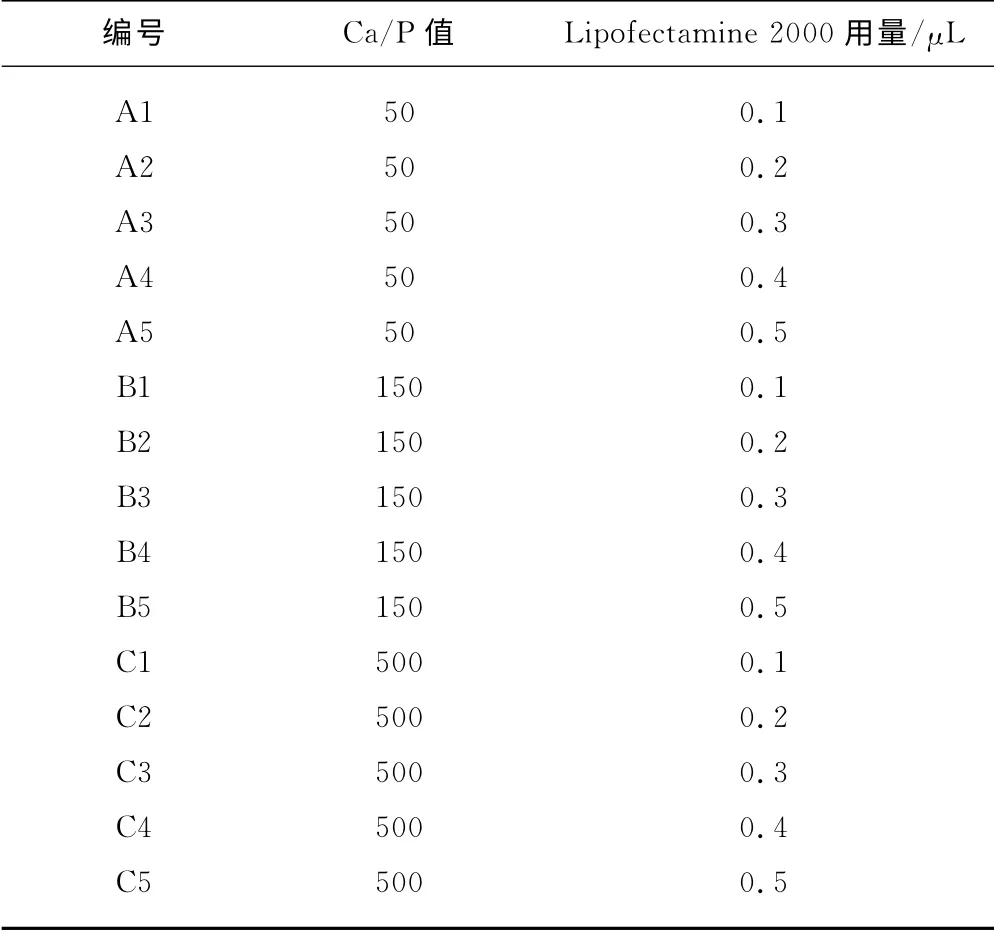
表1 脂质体协同Ca-P/DNA共沉淀Tab .1 Ca-P/DNAco-precipitations in coordination with liposome
1.5 体外转染
将含8×104个·mL-1细胞的完全培养基直接种入24 孔培养板,细胞贴壁生长24h 后加入Lipofectamine 2000/DNA 复合物悬液,于37 ℃、5%CO2条件下培养一定时间后测定基因表达量。
为了检测荧光素酶(luciferase)的表达,去除培养基,用0.1mol·L-1磷酸盐缓冲溶液(pH 值7.4)轻轻润洗细胞,然后按每孔200μL 加入裂解液(Promega),充分裂解后,离心,取20μL 上清液与100μL荧光素酶底物(Promega)充分混合,用化学发光仪(Lumat LB9507,Berthold)测定荧光素酶的活性。
细胞裂解液中的蛋白质浓度用BCA Protein Assay Reagent Kit试剂盒(Pierce)测定;用酶标仪(Biorad 550)在570nm 处测定OD值。每个样品做3 个平行样,取平均值,表示为平均值±标准偏差(SD)。
1.6 细胞存活率的计算
pGL3-Luc转染48h后,去除培养基,每孔加入新鲜培养基1mL 和MTT 60μL(5mg·mL-1),37 ℃培养4h。小心吸除上清液,每孔加入0.8 mL DMSO,轻轻振摇5min 溶解由活细胞线粒体中的琥珀酸脱氢酶还原MTT 得到的蓝紫色甲瓒晶体,用酶标仪于570nm 处测定溶液的OD值。以24 孔培养板上培养的细胞的存活率作为对照。每个样品做5 个平行样,取平均值,表示为平均值±标准偏差(SD)。
1.7 未复合DNA 的量的测定
分别制备Ca-P/DNA 共沉淀和脂质体协同Ca-P/DNA 共沉淀后,离心,取100μL 上清液用于测定未复合DNA 的量。上清液中DNA(pGL3-Luc)的浓度用Quant-iTTMPicoGreen dsDNA Assay Kit(Molecular Probes)试剂盒测定。每个样品做3 个平行样,取平均值,表示为平均值±标准偏差(SD)。
2 结果与讨论
2.1 Ca-P/DNA 共沉淀对293T 细胞的转染
Ca/P值为50、150、500 时,Ca-P/DNA 共沉淀对293T 细胞的转染效率(以每毫克蛋白的相对荧光强度表示,值越大,转染效率越高)见图1。
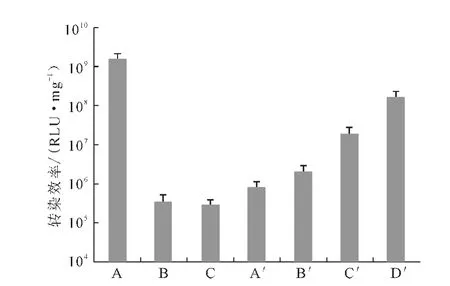
图1 Ca-P/DNA共沉淀和Lipofectamine 2000/DNA复合物在293T 细胞中的荧光素酶表达Fig.1 Luciferase expression in cell 293Ttransfected with Ca-P/DNAco-precipitations and Lipofectamine 2000/DNA compound
由图1可看出,Ca/P值为50时的Ca-P/DNA 共沉淀转染效率比Ca/P值为150和500 时高2~3 个数量级,与文献[6]一致。虽然Ca/P值为50时的基因转染效率最高,但细胞存活率只有75%(图2),细胞毒性最大。
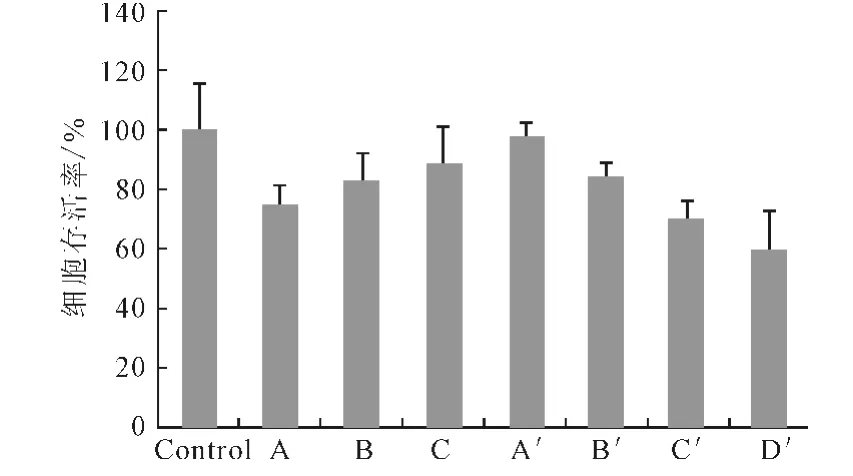
图2 293T细胞在Ca-P/DNA共沉淀和Lipofectamine 2000/DNA复合物转染48h后的细胞存活率Fig.2 Cell viability of cell 293Ttransfected for 48hwith Ca-P/DNAco-precipitations and Lipofectamine 2000/DNA compound
Ca-P/DNA 共沉淀技术是DNA 在氯化钙与磷酸钠沉淀反应中伴随磷酸钙纳米粒子的生成共同沉淀在细胞表面,Strain等[7]研究表明,只有约7%的DNA能从内涵体逃逸进入细胞质,进入细胞核的DNA 更是少于4%,而仍有转染活性的DNA 只有0.5%。因此,生成的磷酸钙纳米粒子的数量决定着被沉淀的DNA 的数量,从而影响DNA 的转染效率。
图3是不同Ca/P值的Ca-P/DNA 共沉淀中未复合DNA 的量。
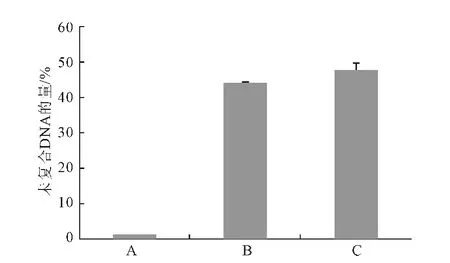
图3 Ca-P/DNA共沉淀中未复合DNA的量Fig.3 Content of unbound DNA in Ca-P/DNAco-precipitations
由图3可看出:当Ca/P值为50 时,超过95% 的DNA 与磷酸钙共沉淀;当Ca/P 值为150和500 时,约50%的DNA 未形成共沉淀。因此,Ca/P 值为50时,Ca-P/DNA 共沉淀的转染效率最高。据文献报道,Ca/P 值越小,Ca-P/DNA 共沉淀的颗粒越大,其细胞毒性也越大。
2.2 脂质体协同Ca-P/DNA 共沉淀对293T 细胞的转染
Lipofectamine 2000 是已经商业化的脂质体,其负载DNA 的转染效率随其用量的增加而提高(图1),其细胞毒性也相应升高(图2)。当Lipofectamine 2000 用量为1.0μL 时,基因转染效率最高,但细胞存活率仅为60%;而当Ca/P 值为150和500时有大量的DNA 未形成共沉淀而处于游离状态(图3),因此,考虑用少量的Lipofectamine 2000 来复合未沉淀的DNA,协同磷酸钙运载DNA 从而提高基因转染效率并保持较低的细胞毒性。图4 为不同用量的Lipofectamine 2000 协同Ca-P/DNA 共沉淀对293T 细胞的转染效率。
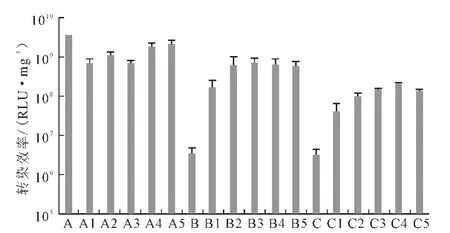
图4 不同用量的Lipofectamine 2000协同Ca-P/DNA共沉淀在293T 细胞中的荧光素酶表达Fig.4 Luciferase expression in cell 293Ttransfected with Ca-P/DNAco-precipitations in coordination with different volumes of Lipofectamine 2000
由图4 可看出:当Ca/P 值为50 时,加入Lipofectamine 2000 并不能提高DNA 的转染效率;当Ca/P值为150或500 时,随着Lipofectamine 2000 的加入,转染效率显著提高1~2 个数量级,并且Lipofectamine 2000 用量超过0.2μL 后转染效率趋于稳定。因此,确定Lipofectamine 2000的最佳用量为0.2 μL。
Lipofectamine 2000用量为0.2μL 时,细胞存活率和未复合DNA 的量如图5、6所示。
由图5 可看出,当Ca/P值为150和500时,加入0.2μL Lipofectamine 2000 细胞存活率仍然超过80%。由图6可看出:Ca/P 值为50 时,加入0.2μL Lipofectamine 2000时未复合DNA 的量并未显著减少;Ca/P值为150时未复合DNA 的量由43.8%降至8.5%;Ca/P值为500时未复合DNA 的量由47.8%降至24.4%。
综上结果,当Ca/P值为150时加入0.2μL Lipofectamine 2000为最佳基因转染条件,此时的基因转染效率高且细胞毒性低。
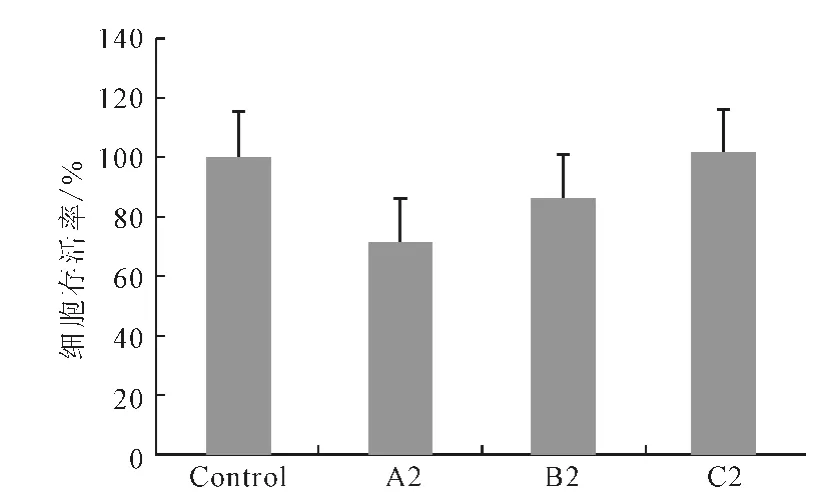
图5 293T细胞在0.2μL Lipofectamine 2000协同Ca-P/DNA共沉淀转染48h后的细胞存活率Fig.5 Cell viability of cell 293Ttransfected for 48hwith Ca-P/DNAco-precipitations in coordination with 0.2μL Lipofectamine 2000
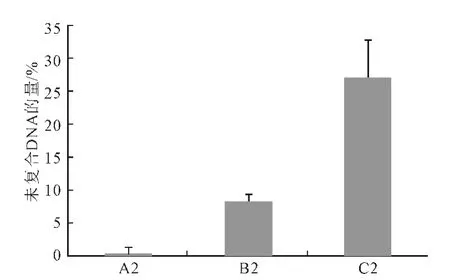
图6 0.2μL Lipofectamine 2000协同Ca-P/DNA共沉淀中未复合DNA的量Fig.6 Content of unbound DNA in Ca-P/DNAco-precipitations in coordination with 0.2μL Lipofectamine 2000
2.3 脂质体协同Ca-P/DNA 共沉淀对NIH3T3 细胞的转染
为了进一步考察Lipofectamine 2000协同Ca-P/DNA 共沉淀对不同细胞系的转染效率,研究了其对NIH3T3 细胞的转染情况,结果如图7 所示。
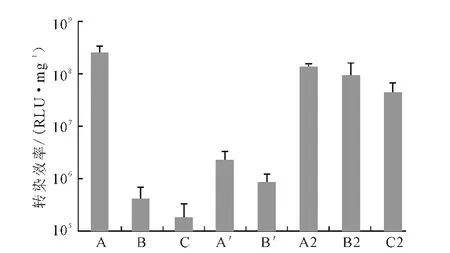
图7 Lipofectamine 2000协同Ca-P/DNA共沉淀在NIH3T3细胞中的荧光素酶表达Fig.7 Luciferase expression in cell NIH3T3transfected with Ca-P/DNAco-precipitations in coordination with Lipofectamine 2000
由图7可知,相同条件下Lipofectamine 2000协同Ca-P/DNA 共沉淀对NIH3T3细胞的转染效率较293T 细胞(图4)低。这可能是因为,不同细胞系特异性不一样。但对于相同的细胞系,在不同条件下基因表达的水平应具有相同的趋势。从图7 可以看出:Ca/P值为50时,Ca-P/DNA 共沉淀的转染效率最高(A);Ca/P 值为50 时 加入0.2μL Lipofectamine 2000转染效率无显著变化(A2);Ca/P 值为150 和500时,加入0.2μL Lipofectamine 2000转染效率显著提高(B2、C2)。
3 结论
用少量商业化的脂质体Lipofectamine 2000 复合未形成Ca-P/DNA 共沉淀的游离DNA,协同高Ca/P值的Ca-P/DNA 共沉淀提高基因转染效率,并保持了其较低的细胞毒性。结果表明:当Ca/P值为150 时,加入0.2μL Lipofectamine 2000 可得到高基因转染效率和低细胞毒性。这种脂质体协同Ca-P/DNA 共沉淀技术有望在基因治疗中得到广泛应用。
[1]WAEHLER R,RUSSELL S J,CURIEL D T.Engineering targeted viral vectors for gene therapy[J].Nat Rev Genet,2007,8(8):573-587.
[2]GRAHAM F L,van der EB A J.A new technique for the assay of infectivity of human adenovirus 5 DNA[J].Virology,1973,52(2):456-467.
[3]ZHANG Q,ZHAO D,ZHANG X Z,et al.Calcium phosphate/DNAco-precipitates encapsulated fast-degrading polymer films for substrate-mediated gene delivery[J].Journal of Biomedicine Materials Research B,Applied Biomaterials,2009,91(1):172-180.
[4]MAITRA A.Calcium phosphate nanoparticles:Second-generation nonviral vectors in gene therapy[J].Expert Review Molecular Diagnosis,2005,5(6):893-905.
[5]KAKIZAWA Y,FURUKAWA S,ISHII A,et al.Organic-inorganic hybrid-nanocarrier of siRNA constructing through the selfassembly of calcium phosphate and PEG-based block aniomer[J].Journal Controlled Release,2006,111(3):368-370.
[6]OLTON D,LI J H,WILSON M E,et al.Nanostructured calcium phosphates(nanoCaPs)for non-viral gene delivery:Influence of the synthesis parameters on transfection efficiency[J].Biomaterials,2007,28(6):1267-1279.
[7]STRAIN A J,WYLLIE A H.The uptake and stability of simianvirus-40DNA after calcium phosphate transfection of CV-1cells[J].Biochemical Journal,1984,218(2):475-482.

