牛GDF9、BMP15、FSHβ和FSHR基因遗传变异与多胎性状的关联性研究
游 伟,刘桂芬,成海建,刘晓牧,姚玉妮,宋恩亮*
(1.山东省畜禽疫病防治与繁育重点实验室,山东 济南 250100;2.山东省农业科学院畜牧兽医研究所,山东 济南 250100)
能繁母牛存栏水平下降给肉牛产业持续健康发展带来不利影响,造成市场上架子牛和犊牛货源紧缺,而同时母牛低繁殖率制约了养牛业的发展,使得提高牛的繁殖率成为国内外养牛业研究的热点课题。母牛生双胎或多胎是复杂的性状,受遗传和环境[1]两方面因素的影响。排卵数决定了生双胎或多胎,从表型上看属于数量性状或阈性状,从微观上看,受基因调控。排卵数受排卵前卵泡数量和质量的影响,卵泡发育决定母牛的排卵数和胎产数,最终影响母牛的繁殖性能。
牛双胎具有它的遗传性,可通过遗传选育来提高双胎率,为了提高牛的双胎率研究者已进行了大量的研究与探索,国内对双胎的研究主要集中在关联性研究方面[2-6],至今其遗传机制仍不清楚。近年来越来越多的研究发现,许多激素、细胞因子和粘附因子通过内分泌活动与排卵联系起来,在卵泡发育和排卵过程中发挥着非常重要的作用,如:促黄体素 (Luteotropic hormone,LH)、促卵泡素 (Follicle stimulating hormone,FSH)[7,8]、 促卵泡素受体 (Follicle stimulating hormone receptors,FSHR)[9,10]、 生长和分化因子-9(Growth different-Ⅰation factor-9,GDF-9)、骨形态发生蛋白 15(Bone morphogenetic protein-15,BMP-15)[11-13]等。卵母细胞在调节和促进卵泡的生长中具有重要的作用,其所产生的生长因子主要通过旁分泌信号作用于颗粒细胞。小鼠的基因研究表明,GDF9和BMP15是卵母细胞来源的生长因子,其关键作用在卵巢功能的调节、排卵率和生育率[14,15]。GDF和BMP15是与哺乳动物卵母细胞分泌蛋白质相关的是正常生育必不可少的两种因子,这两个基因的大量突变已被证明与卵巢早衰和异卵双生[12]以及增加排卵率有关[16]。在雌性小鼠卵泡发育早期GDF9基因功能丧失,将导致不孕不育[17]。在绵羊中,GDF9和BMP15的突变的影响敏感的拷贝数。这两个基因的杂合突变增加双胞胎的频率倍数,而纯合突变导致卵巢发育不全和不育[13,18]。这两种因子对不同物种成功繁殖有不同程度的影响,如小鼠敲除BMP15基因表现出轻度降低生育率[19],而羊BMP15基因的纯合子突变形式是不育的[18,20]。在人类这两种蛋白的异常表达都参与了卵巢早衰、孪生[21]等生殖功能。
受以上研究结果启示,结合试验牛生双胞胎家系遗传性,对下丘脑-垂体-性腺轴系统相关的功能基因:GDF9、BMP15、FSHβ、FSHR基因进行多态性分析,找到八头生双胎牛的共同突变位点。分析在产双胎牛和产单胎牛群体中对与生殖轴相关的激素水平(GH、LH、FSH、P4)的分布水平,从而了解激素对单胎妊娠和双胎妊娠的意义以及基因突变对性激素分泌的影响,进而为产双胎牛繁殖性状产生影响的分子机理奠定理论基础。
1 材料和方法
1.1 试验动物
在山东省鲁西牛原种场采集到具有血缘关系的生过双胎的鲁西母牛的血液样本共8份,以及单胎鲁西母牛血样60头份。全部采用颈静脉采血,用常规的酚-氯仿抽提法从血样中提取基因组DNA。
1.2 方法
1.2.1 引物设计
本实验设计GDF9、BMP15、FSHβ和FSHR引物,扩增出上述四种基因的全部外显子区。引物序列及产物大小及退火温度见表1。

表1 GDF9、BMP15、FSHβ和FSHR四种基因引物序列、产物大小及退火温度
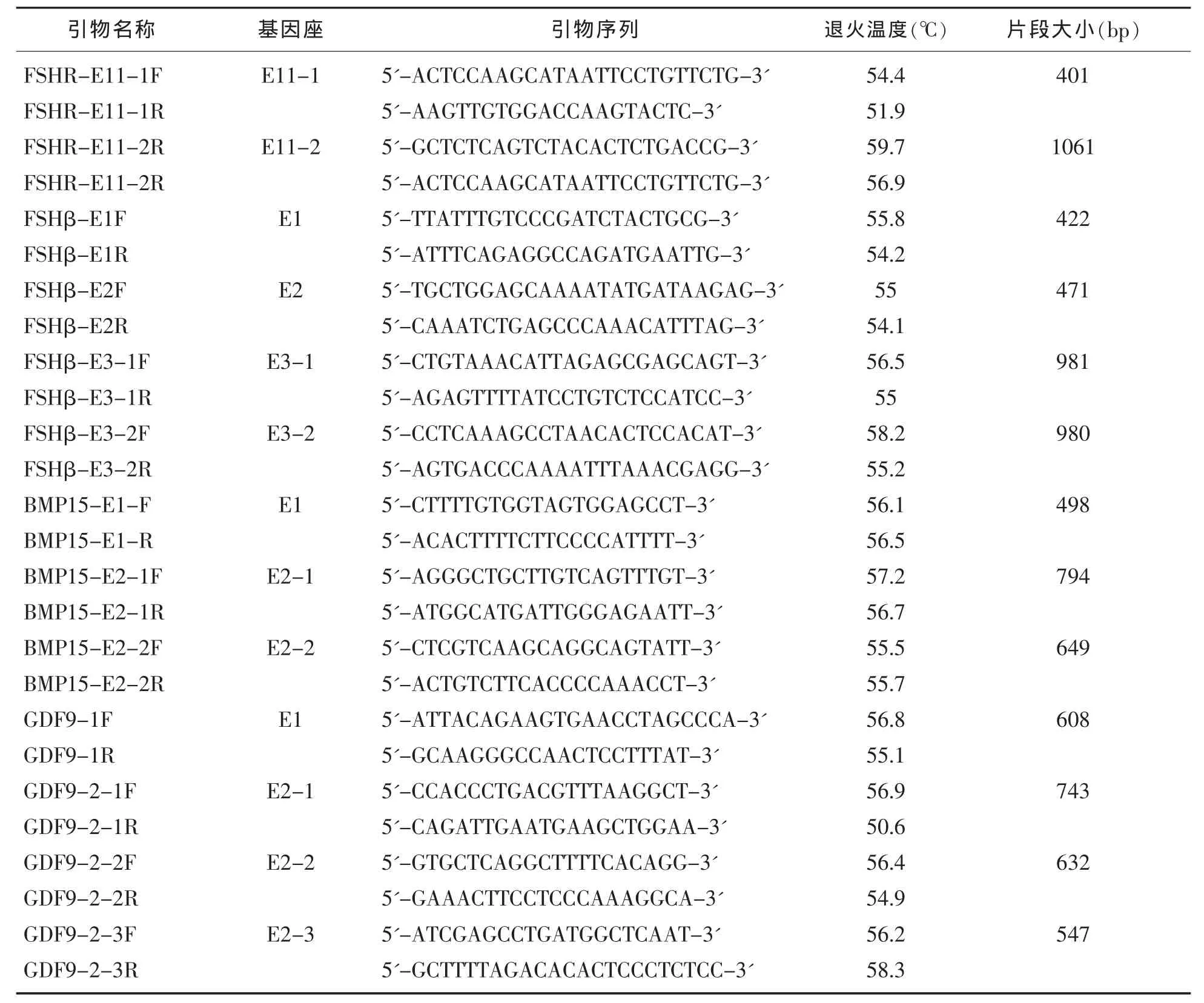
引物名称 基因座 引物序列 退火温度(℃) 片段大小(bp)FSHR-E11-1F FSHR-E11-1R FSHR-E11-2R FSHR-E11-2R FSHβ-E1F FSHβ-E1R FSHβ-E2F FSHβ-E2R FSHβ-E3-1F FSHβ-E3-1R FSHβ-E3-2F FSHβ-E3-2R BMP15-E1-F BMP15-E1-R BMP15-E2-1F BMP15-E2-1R BMP15-E2-2F BMP15-E2-2R GDF9-1F GDF9-1R GDF9-2-1F GDF9-2-1R GDF9-2-2F GDF9-2-2R GDF9-2-3F GDF9-2-3R E11-1 E11-2 E1 E2 E3-1 E3-2 E1 E2-1 E2-2 E1 E2-1 E2-2 E2-3 5'-ACTCCAAGCATAATTCCTGTTCTG-3'5'-AAGTTGTGGACCAAGTACTC-3'5'-GCTCTCAGTCTACACTCTGACCG-3'5'-ACTCCAAGCATAATTCCTGTTCTG-3'5'-TTATTTGTCCCGATCTACTGCG-3'5'-ATTTCAGAGGCCAGATGAATTG-3'5'-TGCTGGAGCAAAATATGATAAGAG-3'5'-CAAATCTGAGCCCAAACATTTAG-3'5'-CTGTAAACATTAGAGCGAGCAGT-3'5'-AGAGTTTTATCCTGTCTCCATCC-3'5'-CCTCAAAGCCTAACACTCCACAT-3'5'-AGTGACCCAAAATTTAAACGAGG-3'5'-CTTTTGTGGTAGTGGAGCCT-3'5'-ACACTTTTCTTCCCCATTTT-3'5'-AGGGCTGCTTGTCAGTTTGT-3'5'-ATGGCATGATTGGGAGAATT-3'5'-CTCGTCAAGCAGGCAGTATT-3'5'-ACTGTCTTCACCCCAAACCT-3'5'-ATTACAGAAGTGAACCTAGCCCA-3'5'-GCAAGGGCCAACTCCTTTAT-3'5'-CCACCCTGACGTTTAAGGCT-3'5'-CAGATTGAATGAAGCTGGAA-3'5'-GTGCTCAGGCTTTTCACAGG-3'5'-GAAACTTCCTCCCAAAGGCA-3'5'-ATCGAGCCTGATGGCTCAAT-3'5'-GCTTTTAGACACACTCCCTCTCC-3'54.4 51.9 59.7 56.9 55.8 54.2 55 54.1 56.5 55 58.2 55.2 56.1 56.5 57.2 56.7 55.5 55.7 56.8 55.1 56.9 50.6 56.4 54.9 56.2 58.3 401 1061 422 471 981 980 498 794 649 608 743 632 547
1.2.2 基因测序和血清激素水平检测
对双胎牛和单胎牛个体血样的PCR扩增产物送交山东省农科院测序中心直接在ABI3730自动测序仪上测序。血清样本送交北京北方生物技术研究所直接在XH6080放免仪器上采用放射免疫的方法检测血清激素水平。
2 结果与分析
2.1 GDF9、BMP15、FSHβ和FSHR基因外显子区序列结果
对GDF9、BMP15、FSHβ、FSHR基因的全部外显子区序列进行测定,测定的结果发现,在GDF9、FSHβ和FSHR基因的外显子区域,共找到7处突变位点,分别命名为GDF9-A99G、GDF9-G121A、FSHβ-C1126T、FSHβ-G1138A、FSHR-G1109C、FSHR-G1153A 和 FSHR-A1327T,其中在 GDF9和 FSHβ中所发现的突变位点在单胎牛和双胎牛中均有发现,而在FSHR基因的第11外显子共找到三处8头产双胎牛共同的突变位点。针对三个突变位点设计两对引物(引物P1 F:5’-AAGATCCTCCTGGTCCTGTT-3’,R:5’-ATTGGAACCATTAGTAACCCT-3’; 引物 P2 F:5’-CACAACTATGCCATCGACTGG-3’,R:5’-ACATTGAGCACAAGGAGGGAC-3’)在产单胎牛群中进行检测。共检测到三处共同的突变位点FSHRG1109C、FSHR-G1153A和FSHR-A1327T。FSHR-P1和FSHR-P2基因座在产双胎牛和产单胎牛中共表现出的基因型如图1、图2、图3、图4所示。(图1、图3中泳道1-8为双胎牛,其余为单胎牛)。

图1 FSHR基因引物FSHR-P1扩增序列的SSCP电泳图

图2 FSHR基因引物FSHR-P1 SNPs的测序结果(A为单胎牛,B为双胎牛)
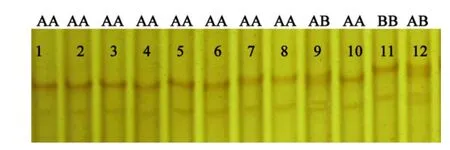
图3 FSHR基因引物FSHR-P2扩增序列的SSCP电泳图
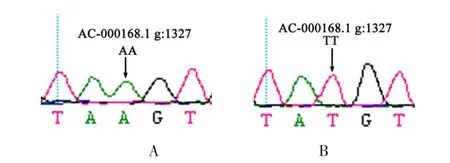
图4 FSHR基因引物FSHR-P2 SNPs的测序结果(A为单胎牛,B为双胎牛)
2.2 上胎产单胎母牛和产双胎母牛血清学激素水平
双胎牛与单胎牛GH、LH、FSH、P4最小二乘均值差异显著性检验结果显示,双胎与单胎水平比较差异均没有统计学意义(P值分别为0.148、0.331、0.090、0.058),除P4激素单胎牛较双胎牛略高外,产双胎牛孕前血清学GH、LH、FSH这3种激素水平高于产单胎牛,且比产单胎牛高出近2倍接近(表2)。

表2 双胎牛和单胎牛血清中GH、LH、FSH、P检测分析
3 讨论
3.1 牛FSHR基因多态性及其在产单、双胎牛群体中的分布
Xiaoyu Huang等研究发现,大熊猫的FSHβ基因的A213T,A91G和A89C3碱基发生替换且A213T替代导致1个氨基酸突变(赖氨酸→蛋氨酸),大熊猫A等位基因与B等位基因相比有更好的产仔性状[22]。FSHβ基因诱导GDF9和促性腺激素释放激素的协同作用。Chu等研究发现,FSHR基因的单核苷酸多态性在两个高繁殖力羊品种(小尾寒羊和湖羊)和两个低繁殖力绵羊品种(考力代和中国美利奴羊)中分布明显不同[23]。FSHR基因编码产物为疏水性跨膜蛋白,具有明显的信号肽,其切割位点位于17-18位的氨基酸之间,二级结构主要以α-螺旋与无规则卷曲为主,并主要在质膜中发挥生物学作用,跨膜区域分为跨膜域、胞外域和胞内域3个部分序列分析表明,FSHR编码产物可能具有离子通道、运载体、受体、信号转导和阳离子通道等功能,在离子跨膜与信号传递过程中发挥重要作用,并对黄牛的激素调节有影响。本研究所发现的FSHR-G1109C、FSHR-G1153A和FSHR-A1327T三处突变点在双胎牛中分别以CC、AA、TT纯合子的形式存在,在产单胎群体中只有2个产单胎牛个体在1109处是以GC杂合子的形式存在的,其它个体都是以GG的纯合子形式存在,突变率仅为0.03%。因此,双胎牛和单胎牛二者之间FSHR基因的第11个外显子的突变率差异很大,且三处突变位点都在编码区,可能对激素的调节产生作用,从而影响黄牛的排卵率。而GDF9-A99G、GDF9-G121A、FSHβ-C1126T和FSHβ-G1138A四处突变位点在双胎牛和单胎牛中均有发现。表明在产双胎的性状中FSHR的三处突变位点起着主导作用,FSHβ基因诱导GDF9和促性腺激素释放激素的协同作用,可能控制FSH、LH、P4、GH的活性,与牛产双胎的繁殖性状有一定关系,对增加生双胎的几率、提高牛的繁殖率有一定的可能性。
3.2 上胎产单、双胎母牛血清学激素水平的分布规律
Lazaros等对FSHR的T307A不同基因型分析显示,该突变能够降低血清FSH水平,提高卵泡和卵母细胞的数量,增加大卵泡数量[24,25]。GDF9和BMP15 mRNA的表达水平在体外成熟水牛卵母细胞的过程中变化并且被认为是依赖促性腺素(FSH和LH)[26]。排卵卵泡的数量与复杂的内分泌和旁分泌途径的调节紧密相关。其中一个重要的机制就是卵巢的TGF信号通路。GDF9和BMP15的卵母细胞的分泌是正常的人类生育必要和在确定卵泡发育和排卵率发挥重要作用。BMP-15是通过抑制FSH受体表达来抑制FSH信号传导[27]。FSH和LH及其受体的表达对卵泡能否成功选择起决定性作用[28,29]。FSH和LH浓度的相对变化、引起刺激反应的激素浓度阈值和卵泡同期化发育程度。在高浓度的FSH作用下,大量卵泡快速生长发育,进入选择阶段。本研究中,双胎牛的孕前GH、LH、FSH三种激素水平高于产单胎牛,且与产单胎牛2倍接近。这可能是由于GDF9、FSHβ及FSHR基因发生突变可能导致蛋白表达活性和结合能力的改变,使卵泡选择调控作用增强,排卵率增加。可能的调控途径主要包括:FSHβ、GDF9和FSHR基因突变后,增强了FSH的表达量及其与受体的结合能力,使血液中FSH浓度有所增加,延长了其在阈值以上的作用时间,使更多的卵泡能够发育到LH依赖型;降低卵泡生长发育所需要的FSH最低浓度,这样可以使部分卵泡在较低的FSH浓度下可以接受刺激而生长,产生更多的LH受体,能过渡到LH依赖期;在较高浓度的FSH和LH联合作用下,卵泡同期化发育程度提高,在同一发情周期中,同步发育的卵泡数目增多。
本研究中双胎样本例数较少,有必要综合双胎妊娠的孕期指标,了解双胎妊娠母牛与单胎妊娠母牛GH、LH、FSH、P4水平的差别的基础上联合基因标记,进一步验证和研究,并完善产前和产后检测和数据汇总,进一步指导肉牛多产性的选育,将对提高牛的繁殖率具有重大意义。
[1]Painter JN,Willemsen G,Nyholt D,et al.A genome wide linkage scan for dizygotic twinning in 525 families of mothers of dizygotic twins[J].Human reproduction,2010,25(6):1569-1580.
[2]雷雪芹,魏伍川,陈宏,等.6个牛品种在FSHR基因位点的遗传关系及其多态对双胎性状的标记[J].西北农林科技大学学报(自然科学版),2004,(7):1-6.
[3]张路培,张小辉,许尚忠,等.牛GDF9和BMP15基因遗传变异与双胎性状的关系研究[J].畜牧兽医学报,2007,(8):800-805.
[4]黄萌,许尚忠,昝林森,等.牛RXRG基因遗传变异与双胎性状的关联分析[J].遗传,2008,2:190-194.
[5]邢耀潭.天祝白牦牛FSH、FSHR基因多态性分析与双胎性状的关联研究[D]:甘肃农业大学;2011.
[6]雷雪芹,陈宏,徐廷生,等.FSHR基因的PCR-RFLP对牛双胎性状的标记分析[J].中国农学通报,2003,(4):7-10.
[7]Miyano Y,Tahara S,Sakata I,et al.Regulation of LH/FSH expression by secretoglobin 3A2 in the mouse pituitary gland[J].Cell and tissue research,2014,356(1):253-260.
[8]Chu C,Zhou Ja,Zhao Y,et al.Expression of FSH and its co-localization with FSH receptor and GnRH receptor in rat cerebellar cortex[J].Journal of molecular histology,2012,44(1):19-26.
[9]王明亮,陈鹏,郝明超,等.黄牛FSHR基因的生物信息学分析[J].甘肃农业大学学报,2012,(4):7-13.
[10]Lazaros LA,Hatzi EG,Pamporaki CE,et al.The ovarian response to standard gonadotrophin stimulation depends on FSHR,SHBG and CYP19 gene synergism[J].Journal of assisted reproduction and genetics,2012,29(11):1185-1191.
[11]Polley S,De S,Brahma B,et al.Polymorphism of BMPR1B,BMP15 and GDF9 fecundity genes in prolific Garole sheep[J].Tropical animal health and production,2010,42(5):985-993.
[12]Otsuka F,McTavish KJ,Shimasaki S.Integral role of GDF-9 and BMP-15 in ovarian function[J].Molecular reproduction and development,2011,78(1):9-21.
[13]Migaud M,Mullen MP,Hanrahan JP,Howard DJ,Powell R.Investigation of Prolific Sheep from UK and Ireland for Evidence on Origin of the Mutations in BMP15(FecXG,FecXB)and GDF9(FecGH)in Belclare and Cambridge Sheep[J].PloS one,2013,8(1):e53172.
[14]Di Pasquale E,Beck-Peccoz P,Persani L.Hypergonadotropic ovarian failure associated with an inherited mutation of human bone morphogenetic protein-15(BMP15)gene[J].American journal of human genetics,2004,75(1):106-111.
[15]Moore RK,Erickson GF,Shimasaki S.Are BMP-15 and GDF-9 primary determinants of ovulation quota in mammals[J].Trends Endocrinol Metab,2004,15(8):356-361.
[16]Mullen MP,Hanrahan JP.Direct evidence on the contribution of a missense mutation in GDF9 to variation in ovulation rate of Finnsheep[J].PloS one,2014,9(4):e95251.
[17]McGrath SA,Esquela AF,Lee SJ.Oocyte-specific expression of growth/differentiation factor-9[J].Mol Endocrinol,1995,9(1):131-136.
[18]Galloway SM,McNatty KP,Cambridge LM,et al.Mutations in an oocyte-derived growth factor gene(BMP15)cause increased ovulation rate and infertility in a dosage-sensitive manner[J].Nature genetics,2000,25(3):279-283.
[19]Yan C,Wang P,DeMayo J,et al.Synergistic roles of bone morphogenetic protein 15 and growth differentiation factor 9 in ovarian function[J].Mol Endocrinol,2001,15(6):854-866.
[20]Demars J,Fabre S,Sarry J,et al.Genome-wide association studies identify two novel BMP15 mutations responsible for an atypical hyperprolificacy phenotype in sheep[J].PLoS genetics,2013,9(4):e1003482.
[21]Zhao ZZ,Painter JN,Palmer JS,et al.Variation in bone morphogenetic protein 15 is not associated with spontaneous human dizygotic twinning[J].Human reproduction,2008,23(10):2372-2379.
[22]Huang X,Li D,Wang J,et al.Polymorphism of follicle stimulating hormone beta(FSHβ)subunit gene and its association with litter traits in giant panda[J].Molecular biology reports,2013,40(11):6281-6286.
[23]Chu MX,Guo XH,Feng CJ,et al.Polymorphism of 5′regulatory region of ovine FSHR gene and its association with litter size in Small Tail Han sheep[J].Molecular biology reports,2012,39(4):3721-3725.
[24]王海滨,谢辉蓉,夏国良.哺乳动物卵泡早期发育调控的研究进展[J].国外畜牧科技,2002,19(02):37-42.
[25]杨孟伯.大足黑山羊卵泡发育规律及发情周期中FSH、INH水平的变化[D].重庆:西南大学,2009.
[26]Lazaros L,Hatzi E,Xita N,et al.Influence of FSHR diplotypes on ovarian response to standard gonadotropin stimulation for IVF/ICSI[J].The Journal of reproductive medicine,2013,58(9-10):395-401.
[27]Simoni M,Casarini L.Mechanisms in endocrinology:Genetics of FSH action:a 2014-and-beyond view[J].European journal of endocrinology/European Federation of Endocrine Societies,2014,170(3):R91-107.
[28]Nath A,Sharma V,Dubey PK,et al.Impact of gonadotropin supplementation on the expression of germ cell marker genes(MATER,ZAR1,GDF9,and BMP15)during in vitro maturation of buffalo(Bubalus bubalis)oocyte[J].In vitro cellular&developmental biology Animal,2013,49(1):34-41.
[29]崔奎青,朱鹏,刘庆友,等.骨形成蛋白-15基因研究进展[J].生物技术通报,2012,(9):16-20.

