重组链球菌溶血素(SLO)的原核表达、纯化
钟佳芸,张 涛
1成都外国语学校;2成都医学院生物医学系
重组链球菌溶血素(SLO)的原核表达、纯化
钟佳芸1,张 涛2
1成都外国语学校;2成都医学院生物医学系
目的构建SLO原核表达质粒,重组蛋白的诱导表达并纯化。方法提取链霉菌溶血素O模板DNA,PCR法扩增slo基因。构建融合表达重组质粒pGEX-6p-1-slo和pet32a-tev-slo,将正确的重组质粒转化至大肠杆菌BL21和大肠杆菌BL21-DE3,使用异丙基硫代βD半乳糖苷(IPTG)诱导表达重组融合蛋白。采用亲和层析纯化重组蛋白,切除标签后,再通过亲和层析纯化,获取SLO重组蛋白。结果PCR扩增出slo基因,基因片段(1700 bp)与理论一致。经SDSPAGE,蛋白质印迹显示重组蛋白相对分子质量为55 kDa,与数据库中的相对分子质量结果相符。结论成功构建了slo原核表达质粒,表达并纯化了SLO重组蛋白。
链霉菌溶血素O;原核表达;蛋白质纯化
1 引言
链球菌溶血素是由A群链球菌产生的一种外毒素,能溶解红细胞,并对机体多种细胞有毒性作用。链球菌溶血素主要有链球菌溶血素“O”(SLO)和链球菌溶血素“S”(SLS)两种[1]。其中SLS多数是由A、C、G群链球菌产生,是一种小分子糖肽,不具有免疫原性,在养存在的条件下稳定的存在,但是对热和酸较为敏感。
链球菌溶血素“O”(SLO),基因大小为1700 bp左右,紧跟着spn基因。所表达的蛋白相对分子量为55 kDa,大部分是由A群链球菌产生的,SLO释放前主要存在于细菌的细胞壁和细胞膜之间的周围包浆中[2],在细菌的对数期及稳定期释放[3],因此可以看出释放SLO的链球菌对营养要求较高。SLO蛋白的等电点为6.0-6.4,主要由十七种氨基酸组成,主要以天冬氨酸、赖氨酸以及谷氨酸为首,组氨酸和半胱氨酸以及脯氨酸较少,不存在酪氨酸。SLO是含有-SH的蛋白质,因此具有强烈的异质性,对氧十分的敏感,在氧存在的情况下-SH被氧化成-SS-基,暂时失去溶解细胞的功能,因此又被称之为SH-激活细胞溶素,它通过与靶细胞膜表面相应的胆固醇受体不可逆的相互作用,从而与靶细胞结合,单体发生寡聚化,形成环状的前孔结构,然后发生构象改变,从而前孔插入膜中,最终在靶细胞膜上形成跨膜的大型两性β-桶状孔道,这一结构赋予其“造孔”的特殊功能[4]。此桶装孔道大约有25-30纳米大小。溶红细胞活性是SLO的特殊生物活性,以HU来表示,据推算一百个SLO分子可以溶解一个红细胞。SLO的溶细胞效应高度的依赖胆固醇。细胞膜上的胆固醇不仅是SLO的结合位点,也是其靶点[3,5]。SLO的溶细胞活性可以被锌离子和钙离子所抑制,锌离子和钙离子主要通过与SLO的琉基发生反应,从而发挥抑制作用。SLO的抗原性极强,感染此种链球菌后2~3周内,85%以上病人产生抗“O”抗体,病愈后可持续数月甚至数年,因此可作为新近链球菌感染。除此之外风湿热患者该抗体滴度较高,因此测定其含量可作辅助诊断。目前,血清抗鏈球菌溶血素O的测定已广泛应用于风湿病、急性腎炎等与鏈球菌感染有关疾病的診断。
在对病人检测是否患有风湿病的时候,常检测的是病人血清中ASO的含量。正常人的ASO值常在500 U以下,但当患有风湿病的时候,ASO的值明显升高。因此测定ASO的含量对判定病人是否患有风湿病是一个重要的指标[6]。因而制备出高纯度的检测抗原SLO对制备ASO检测试剂盒是有非常有研究意义的。
2 材料与方法
2.1材料
E.coil DH5α菌株、E.coli BL21-DE3菌株来自实验室保存,质粒pET-32a-tev来自实验室保存,slo基因模板购买自武汉华美生物技术公司,Bam H I和Xho I酶购买自Fermentas,T4DNA聚合酶购买自TaKaRa,DNA纯化回收试剂盒购买自TIANGEN,质粒小抽提取试剂盒购买自道普生物科技有限公司。
2.2方法
2.2.1 PCR获取目的基因
以购买自武汉华美公司的人源SLO基因作为模板,设计引物,上游引物序列为GAATTC-CTTGCTCCTAAAGAAATGCC,下游引物序列为CTCGAG-TCACTTATAAGTAATCGAACC(倾斜字体表示BamHI与XhoI的酶切位点),以人源SLO基因作为模板进行PCR,94℃30s,52℃30s,72℃2min,30个循环。
2.2.2载体的构建
用限制性内切酶BamHI与XhoI分别酶切载体pET-32a-tev以及PCR产物,37℃酶切3h,将酶切后的质粒与PCR产物分别进行胶回收。将回收后的载体与PCR产物按1:3比例混合[7],室温放置10min,转化DH5α,涂含有氨苄青霉素的平板,挑取单克隆提质粒,送公司(华大基因)测序。
2.2.3重组蛋白的表达与纯化[13]
将构建好的,测序正确的重组载体转化BL21-DE3,涂含有氨苄青霉素的平板,随后挑取单克隆接种于含有氨苄青霉素的LB培养基中,于37℃,220rpm培养至OD600值为1.0左右时,加入IPTG (异丙基-β-D-硫代半乳糖苷,终浓度0.5mmol/L),18℃诱导过夜,8000rpm离心15min收菌。
将收集的菌体用缓冲液A(20mM Tris-HCl,pH8.0+100 mM Na⁃Cl+10mM咪唑)重悬,用高压均质机(AVESTIN,)15000psi破四遍,4℃条件下20000rpm离心30min。离心后上清与沉淀经SDSPAGE检测,蛋白以可溶形式存在。收集上清,过膜(0.22μm),表达载体pET-32a-tev,带有组氨酸标签,表达的目的蛋白前端含有TEV的酶切位点。过膜后上清,用蛋白纯化仪(AKTA explorer100, GE Healthcare)过亲和层析柱(HisTrap HP 5ml,GE Healthcare),用缓冲液B(20mM Tris-HCl+pH8.0+100mM NaCl+500mM咪唑)梯度洗脱。采用SDS-PAGE以及Western-blot对纯化蛋白进行检测。
2.2.4 TEV酶切去除标签
用TEV酶切割重组蛋白His-tev-SLO使标签蛋白His与目的蛋白SLO分开。将上述纯化好的SLO重组蛋白用0.02 mol/L PB,pH 8.0磷酸盐缓冲液透析以去除以前纯化的蛋白中的咪唑和高浓度氯化钠。按1 mg TEV酶切割100 mg目的蛋白的比例加入TEV酶,4℃冰箱酶切过夜。SDS-PAGE以及Western-blot检测标签去除。
3 结果分析
3.1目的基因PCR扩增及重组载体鉴定结果
通过PCR扩增获得目的基因片段。PCR扩增产物经1.0%琼脂糖凝胶电泳分析,结果显示slo基因片段为1700 bp左右,与理论DNA表达片段大小一致(图1a)。将扩增得到的slo基因片段pET-32a-tev质粒分别经Bam HⅠ和XhoⅠ双酶切,连接后得到的重组质粒再次双酶切鉴定,结果显示在1700 bp处存在特异性片段(图1b),构建好的质粒测序结果与NCBI登陆序列一致。
3.2蛋白纯化结果
用蛋白纯化仪过亲和层析柱,高浓度咪唑梯度洗脱,在咪唑浓度为100mM-200mM之间时出峰,12%SDS-PAGE电泳验证,可以获得纯度较高的重组SLO蛋白(见图3),在70KD处有明显的单一目的条带,经亲和层析纯化后,

图1 PCR及双酶切鉴定结果Fig.1 The Results of PCR and double restriction endonuclease M为DNA marker
每升菌液可以获得大约30mg的重组SLO蛋白,将纯化后的重组蛋白透析后,用TEV酶切,再次经过亲和层析出去His标签,得到纯度较高的重组蛋白(图2)。
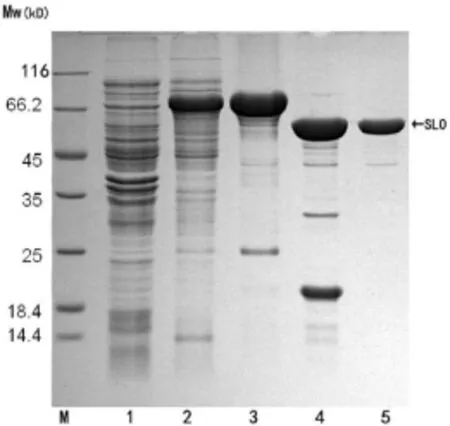
图2 His-tev-SLO纯化Fig.2 Purified of His-tev-SLO
M:Protein maker;
1:His-tev-SLO阴性对照(未加IPTG诱导);2:His-tev-SLO上清;3:His-tev-SLO纯化;4:His-tev-SLO融合蛋白酶切;5:纯化后的SLO;
3.3 Western blotting验证
纯化后SLO蛋白经12%SDS-PAGE分析后进行蛋白印迹鉴定,可见在相对分子质量约为55 kDa处出现特异性杂交带,表明为SLO蛋白(图3)。

图3 SLO免疫印记Fig.3 Western blottingof SLO预染Marker 1:对照2:实验
4.讨论
本文通过对SLO原核表达载体的构建、表达、纯化的研究表明:PCR扩增出的slo基因片段(1700 bp)与理论大小一致。测序结果证明pET-32a-tev-slo重组表达质粒无缺失和突变。SDS-PAGE和Western blot分析经TEV酶酶切后的His-tev-SLO后纯化的SLO的相对分子质量为55 kDa,与NCBI数据库中的结果相符。Histev-SLO重组融合蛋白经过酶切去标签得到了目的蛋白SLO。
[1]陈希,索占伟,许剑琴等.细菌溶血素的分类及代表性溶血素研究进展[J].中国农学通报,2008,24(8):16-22.
[2]Calandra GB,et al:Cellular streptolysin S-related hemolysins of group A Streptococcus C203S[J].Infect Immun,1975,12(4):750-753
[3]Alouf JE:Streptococcal toxins(streptolysin O,streptolysin S, erythrogenic toxin)[J].Pharmacol Ther,1980,11(3):667-717
[4]Gonzalaz M R,Bischofberger M,Pernot L,et al.Bacterial pore⁃forming toxins:the whole story?[J].Cell Mol life Sci,2008,65(3): 493-507
[5]Thelestam M,et al:Clostridium difficile toxin B induces apop⁃tosis in intestinal cultured cells[J].Infect Immun,1980,29(3):863-872
[6]钟兰,蔡玉玲.免疫透射比浊法对ASO及RF试剂的应用性能评价[J].海南医学,2010,21(22):55-56.
[7]Feng Na,Hou Xiaoqiang.Prokaryotic Expression and Purifica⁃tion of Mouse MacrophageMigration Inhibitory Factor Gene[J]. Chin JBiologicals,2009,22(2):132-135.
——一道江苏高考题的奥秘解读和拓展

