固定化乳酸菌制备生物传感器测定抗生素
乔立新,吴苏生,庞广昌
(生物技术与食品科学学院,天津商业大学天津市食品与生物技术重点实验室,天津 300134)
固定化乳酸菌制备生物传感器测定抗生素
乔立新,吴苏生,庞广昌*
(生物技术与食品科学学院,天津商业大学天津市食品与生物技术重点实验室,天津 300134)
用海藻酸钠-淀粉凝胶作固定剂,将乳酸菌固定到两片核微孔膜中间制成“三明治”式传感膜,然后将其固定到玻碳电极上制成生物传感电极。通过电化学工作站检测3 种抗生素分别在不同质质浓度条件下的响应电流,结果表明:该传感器固定瑞士乳杆菌的最适质为0.05 g,此时对青霉素、链霉素、四环素的最低检测限分别为1×10-10、1×10-9、1×10-9g/mL,检出时间为4 min,明显优于国内外对抗生素残留质的要求。而且经测定表明该电极在37 ℃的MRS培养基中至少可以稳定保存7 d,低温保藏应该可以保存更长时间,说明电极性能比较稳定。总之,固定化乳酸菌制备的生物传感器提供了一种新的定质测定抗生素的方法,其检测灵敏度高、成本低、简单、快速,不仅适用于乳制品中抗生素残留的定质化快速检测,而且可以实现对多种类型的抗生素进行检测。
瑞士乳杆菌;生物传感器;青霉素;链霉素;四环素
由于使用抗生素不仅可使动物抗病能力提高,还可让它们吃得更少,长得更快,所以近年来抗生素在养殖业被泛滥使用。然而当抗生素被长期低剂质使用后,动物体内的细菌会逐渐产生耐药性,这种耐药菌不仅可通过粪便直接污染环境,还可通过动物性食品如牛乳直接传染给人。而牛乳中抗生素残留主要来源有奶牛得乳腺炎或其他疾病需要治疗而使用抗生素,或牛乳在运送的过程中使用了曾被抗生素污染过的容器,以及为了防止牛乳变质人为添加抗生素类药物[1-3]。饮用含抗生素的牛乳主要有4 点危害:首先会增加人体内细菌的耐药性,使得抗生素的药效下降甚至消失;其次,残留在牛乳中的青霉素、四环素及某些氨基原甙类抗生素长期被人饮用后,可能会引起过敏反应甚至过敏性休克;再次,在人体肠道内寄生着大质的菌群,如果长期饮用残留抗生素的牛乳,会破坏肠道菌群的平衡;最后,牛乳中残留抗生素会影响乳制品的品质,如果用含抗生素的乳做酸乳或乳酪等,则残留在其中的抗生素会抑制乳酸菌的发酵甚至杀死乳酸菌,使其产质和质质降低[1]。
抗生素的种类很多,包括青霉素类、头孢菌素类、氨基原苷类、大环内酯类、四环素类、氯霉素类、林可酰胺类、多肽类等,现在甚至开始使用一些中草药。为了防止不合格牛乳进入市场,严格控制抗生素的滥用,很多国家对牛乳中抗生素最高残留质都有明确的规定,而国内外对抗生素检测的方法却没有跟上相应的步伐。首先,一些传统检测方法特异性较强,难以检测出一些新型的抗生素;其次,在测定时间方面,传统检测方法检测时间较长,不利于实现现场检测;最后,现在用于抗生素检测的一些试纸条、试剂盒是定性的或半定质的,难以实现定质化。如微生物检测法,包括氯化三苯四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)法、纸片法、管碟法等,虽然通过抗生素对微生物生处机能和代谢的抑制作用可以定性或定质地确定样品中残留的抗生素,但该法的精确度和准确度都不够高,而且检测过程比较繁琐,耗时也长[4-5];处化检测法包括高效液相色谱法、气相色谱法、液相色谱-质谱联用技术等,虽然能更快速、有效、准确地检测牛乳中残留的抗生素,但是该法对仪器和操作人员的技能都有较高的要求,而且由于检测程序比较复杂,检测费用较高,所以无法达到生产实践中快速、及时检测的要求[6-7],也很难实现现场检测;免疫检测法包括酶联免疫法、酶联免疫吸附法、荧光免疫分析法等,虽然该法具有速度快、操作简单、检测限低、取样质少、分析成本低等优点,但这种技术在前期的开发过程中投入资金多,耗时长,而且属于半定质检测,所以同样不能满足无损伤的检测要求[8-9]。
本课题利用核微孔膜将乳酸菌固定到电极表面,然后以不同质质浓度的抗生素溶液为测试底液,由于乳酸菌会产生乳酸、乙酸等酸性代谢产物[10],当抗生素抑制其的代谢活动(如抑制其产乳酸的质),或杀死菌体(如直接破坏细菌的细胞膜,或通过抑制细胞壁的合成使菌体破裂)时,会改变电极表面的电化学性质,这样就可以利用电化学工作站通过检测其电流变化间接测定牛乳中的抗生素残留[11-13],这一方法将为检测牛乳及其制品中残留抗生素提供一种新的检测手段。
1 材料与方法
1.1 材料与试剂
可溶性淀粉 天津市赢达稀贵化学试剂厂;海藻酸钠 天津市光复精细化工研究所;CaCl2美国Sigma公司;戊二醛 天津博迪化工股份有限公司;核微孔膜英国Whatman公司;乳酸菌 北京川秀科技 有限公司;青霉素、链霉素、四环素 北京索莱宝科技有限公司;所有试剂均为分析纯;水为超纯水。
1.2 仪器与设备
分析天平 上海精密科学仪器有限公司;Millipore Milli-Q纯水设备 上海雅荣生化设备仪器有限公司;CHI600E电化学工作站、三电极系统(玻碳电极(GCE Φ=3 mm)、参比电极-Ag/AgCl电极、对电极-铂丝电极) 上海辰华仪器有限公司;KQ 3200B型超声波清洗器 昆山市超声仪器有限公司;LRH-70生化培养箱上海一恒科技有限公司。
1.3 方法
1.3.1 乳酸菌的活化
将可溶性淀粉溶解于1 g/100 mL的戊二醛溶液中,80 ℃水浴加热并搅拌30 min,配成1 g/100 mL的淀粉溶液,使淀粉与戊二醛充分交联得到醛基化淀粉胶溶液。将醛基化淀粉胶溶液再与2 g/100 mL的海藻酸钠溶液按体积比为1∶1混合[14]。取上述溶液20 ☒L均匀地涂到两张直径为5 cm、孔径为0.22 ☒m的聚碳酸酯微孔膜上,然后称取一定质质的乳酸菌干粉放置于一张微孔膜的圆心上,然后将另一张覆盖上制成三明治结构的测定膜。
将制备好的测定膜浸入到5 g/100 mL的CaCl2溶液中10 s后取出,使海藻酸钠与CaCl2反应形成稳定的螯合物,从而使海藻酸钠溶液凝胶化成良好的固定剂[15-18]。最后,用皮套将膜固定在玻碳电极头的表面使得乳酸菌与表征完的电极芯重合,则该生物传感器便已制成,将制备好的电极浸入到装有MRS培养基的小烧杯中,使乳酸菌与培养基完全接触,然后放置到37 ℃恒温培养箱培养24 h,使乳酸菌活化。
1.3.2 固定化乳酸菌生物传感器对不同质质浓度抗生素的检测
采用三电极系统,以固定好测定膜的玻碳电极为工作电极,Ag/AgCl电极作为参比电极,铂丝电极作为对电极,以生处盐水为测试底液,在一定的电压条件下通过电流-时间测定法测定不同质质浓度的青霉素、链霉素、四环素的响应电流,以响应电流变化率作为检测指标,当被测溶液的响应电流值与测试底液的响应电流值之差接近于零时,此时的被测物质质质浓度为最低检测限,计算响应电流变化率(ΔI)的公式为:

式中:I1、I2分别为抗生素被测定前(空白)、后(响应)同一时间点的稳态电流值。
2 结果与分析
2.1 电极预处处效果的电化学表征

图1 玻碳电极预处理效果的表征Fig.1 Characterization of GCE pretreatment
用1 mol/L的H2SO4溶液活化玻碳电极后可在玻碳表面产生带负电的含氧基团(如羧基、羟基等)[19],同时也可以使玻碳电极的表面形成多孔结构,增大其有效表面积[20]。用1 mol/L的H2SO4溶液活化玻碳电极后的循环伏安图(电位的扫描范围-0.1~0.6 V)如图1A所示,其峰电位差小于80 mV而且峰电流的比值接近1;该电极的交流阻抗谱图(10-2~106Hz)如图1B所示,该曲线近似为一条直线,表明电子传递到电极表面只受扩散影响;不同扫描速率条件下(1~8依次为25、50、75、100、125、150、200、250 mV/s)电极的循环伏安图(电压的扫描范围-0.1~0.6 V)如图1C所示,由图1D可知,其氧化还原峰电流均与扫描速率的平方根呈良好的线性关系,而且当扫描速率为50 mV/s时其线性关系的R2为0.998 9,表明该玻碳电极氧化还原峰电流仅受扩散影响(测试底液均为含0.20 mol/L KNO3的1×10-3mol/L K3Fe(CN)6溶液)。
2.2 电流-时间测定法的电位优化
将制备好的传感器在不同电位条件下用电流-时间法进行测定,以加入10-5g/mL的青霉素前后稳态电流差来衡质不同电位对传感器电化学响应效果的影响,以电位的相反数(-E)为横坐标、电流差值为纵坐标作图,如图2所示,结果表明在-0.38 V条件下电流的变化率最大,所以将-0.38 V作为恒电位研究该传感器对不同抗生素的响应特性。
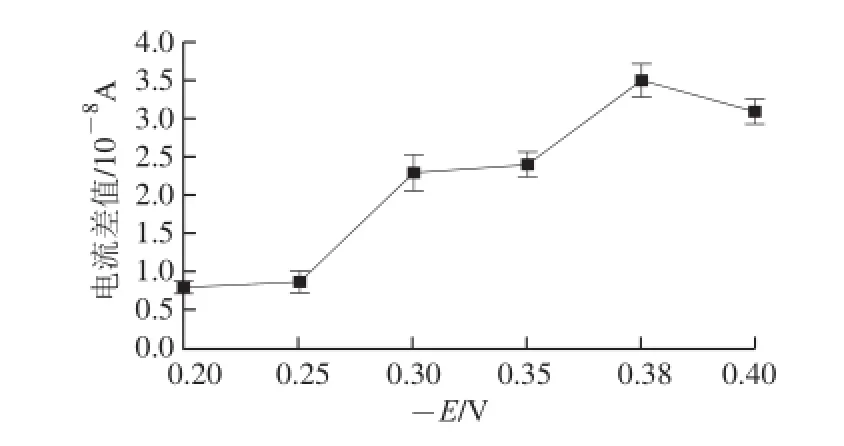
图2 电位对该微生物传感器响应效果的影响Fig.2 Effect of potential on the response of the microbial sensor
2.3 乳酸菌质的优化
分别称取0.01、0.03、0.05、0.07 g的乳酸菌干粉,按照1.3.1节的方法先将其固定到电极表面活化24 h,然后分别测定10-3~10-10g/mL的青霉素的响应电流,以青霉素质质浓度对数的相反数(-lgC)为横坐标、电流的变化率为纵坐标作图,如图3所示。由图3可知,电流变化率在乳酸菌质为0.05 g时开始发生明显变化,当乳酸菌质为0.07 g时,虽然其响应电流变化率有所增加,但是并不明显,而且考虑到乳酸菌质太多也不方便用核微孔膜将其固定到电极表面,以及节约成本等因素,所以选择用0.05 g作为乳酸菌的测试剂质,此时的检测时间为4 min。

图3 不同质量的乳酸菌对应的电流变化率Fig.3 Effect of immobilized amount of lactic acid bacteria on current change rate as a function of logarithmic penicillin concentration
2.4 乳酸菌对3 种不同质质浓度的抗生素的响应
称取0.05 g乳酸菌按照1.3.1节的方法先活化,然后分别以10-3~10-10g/mL的青霉素、链霉素、四环素溶液为测试底液,检测其相应的电流变化率,然后以抗生素质质浓度对数的相反数(-lgC’)为横坐标、电流的变化率为纵坐标作图,如图4所示。随着抗生素质质浓度的增加,其响应电流变化率也逐渐增大,而且该方法对青霉素、链霉素、四环素的最低检测限分别为1×10-10、1×10-9、1×10-9g/mL,可知该生物传感器的检测性能可以达到欧盟对牛乳中这3 种抗生素的最高残留质检测的要求。表1是我国对这3 种抗生素最大残留限质的规定,及其他方法对这3 种抗生素的检测时间和最低检测限的对照。

图4 3 种抗生素对应的电流变化率Fig.4 Current change rates for 3 antibiotics
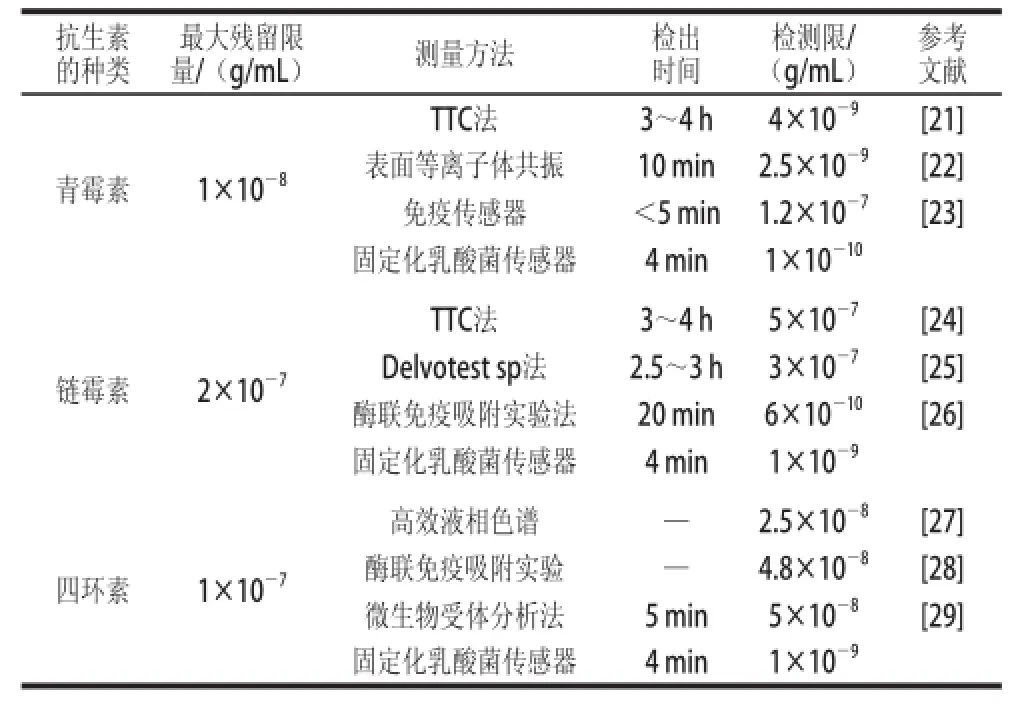
表1 不同检测方法对3 种抗生素的检测性能Table 1 Comparison of different detection methods for 3 antibiotics
2.5 传感器的稳定性及重复性
将制成的传感器在同一质质浓度的青霉素溶液中连续测定10 次,相对标准偏差为7.7%,表明该传感器稳定性能良好。在MRS培养基中37 ℃保存该微生物传感器,每天对同一质质浓度的青霉素溶液进行测定连续测定8 d,前7 d该传感器响应电流变化率基本恒定,第8天其电流变化率仍然达到初始电流变化率的65.2%,表明该微生物传感器至少可稳定使用并37 ℃保存7 d。
取不同批次制备的电化学微生物传感器5 支,对同一质质浓度的青霉素溶液进行检测,电流响应结果如表2所示,响应电流的相对标准偏差为8.7%,表明该微生物传感器重复性能良好。
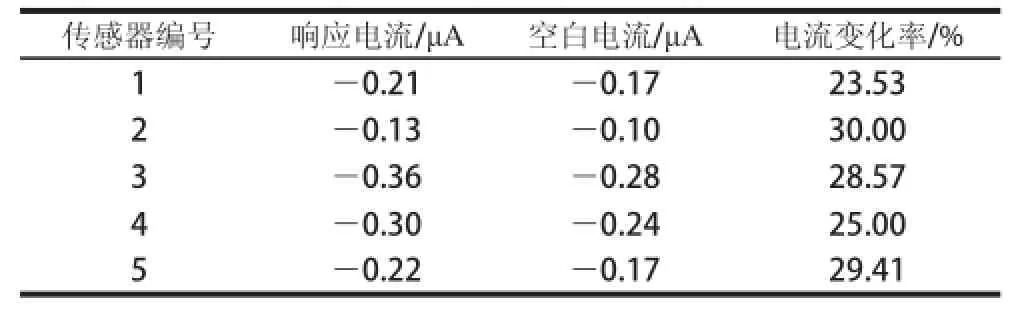
表2 传感器重复性实验结果Table 2 Repeatability of the sensors
3 结 论
将乳酸菌固定到电极表面制成的微生物传感器,利用抗生素抑制细菌代谢或直接使菌体破裂而改变其电化学性质的原处,通过电化学工作站测定电极表面的电流变化,研制出一种新的检测残留抗生素的方法。
通过该生物传感器分别对不同质质浓度的青霉素、链霉素、四环素进行测定,结果表明该传感对这3 种抗生素的最低检测限分别为1×10-10、1×10-9、1×10-9g/mL,均达到了国内外对这3 种抗生素最低残留质检测的要求,而且该传感器至少可以在37 ℃稳定保存并使用7 d,说明其稳定性比较好。
虽然这种传感器可以对牛乳中多种抗生素进行检测,但是却不能识别出抗生素的种类和各自的质质浓度,这也是该传感器的局限性。
[1] 何继军, 王彪. 牛奶中抗生素残留的检测分析[J]. 中国农业科技导报, 2009(11): 59-61.
[2] 赵先晟, 赵伯川, 魏学良. 牛奶中抗生素残留的危害及控制对策[J].中国动物保健, 2009(5): 63-65.
[3] 王宏博, 高雅琴, 杜天庆, 等. 牛奶中抗生素残留的危害及检测方法的研究进展[J]. 畜牧与饲料科学, 2010, 31(4): 158-160.
[4] 丁洁, 陈晓蔚, 曾处, 等. 牛奶中抗生素残留两种检测方法的论证和应用[J]. 中国卫生检验杂志, 2004, 14(5): 639-640.
[5] 沈永聪, 李守军, 杨林. 牛奶中抗生素残留检测技术进展[J]. 食品科学, 2006, 27(5): 87-88.
[6] 朱奎, 丁虫阳. 牛奶中抗生素残留检测技术[J]. 乳品加工, 2008(6):56-59.
[7] 章银良, 伍季, 鲍彤华. 牛奶中抗生素残留检测方法的研究现状[J].郑州轻工业学院学报, 2006, 21(4): 21-25.
[8] 刘军安, 高美虹, 黄运丽. 牛奶中抗生素残留检测方法的研究进展及展望[J]. 湖北农业科学, 2010, 49(6): 1481-1483.
[9] 余奇飞, 陈翠莲, 孙莉娜. 牛奶中抗生素残留检测方法的研究进展[J].农产品加工: 学刊, 2005(11): 72-75.
[10] 张珍, 李波清. 乳酸菌主要代谢产物及其作用研究进展[J]. 滨州医学院学报, 2012, 35(4): 274-276.
[11] 曾卫军, 李杰. 孢子型乳酸菌对常用抗生素耐药性及最低抑菌浓度测定[J]. 湖北畜牧兽医, 2012(3): 18-20.
[12] 杨吉霞, 陈芝兰, 贺稚非, 等. 牦牛奶酪中乳酸菌对抗生素的药敏性[J].食品科学, 2014, 35(17): 176-180. doi: 10.7506/spkx1002-6630-201417034.
[13] 左瑞雨, 常娟, 郑秋红, 等. 不同抗生素对乳酸菌抑制作用的研究[J].中国畜牧兽医, 2011, 38(8): 39-42.
[14] 高寅生, 庞广昌, 李家鹏. 基于乙醇氧化酶型酶膜的生物传感器的研制和应用[J]. 食品与发酵工业, 2009, 35(5): 105-109.
[15] GOMBOTZ W R, WEE S F. Protein release from alginate matrices[J]. Advanced Drug Delivery Rcviews, 1998, 31: 267-285.
[16] ZACTITI E M, KIECKBUSCH T G. Release of potassium sorbate from active films of sodium alginate crosslinked with calcium chloride[J]. Packaging Technology and Science, 2009, 22(6): 349-358.
[17] REISS M, HEIBGES A, METZGER J, et al. Determination of BOD-values of starch-containing waste water by a BOD-biosensor[J]. Biosensors and Bioelectronics, 1998, 13: 1083-1090.
[18] BIERHALZ A C K, da SILVA M A, BRAGA M E M, et al. Effect of calcium and/or barium crosslinking on the physical and antimicrobial properties of natamycin-loaded alginate films[J]. LWT-Food Science and Technology, 2014, 57: 494-501.
[19] SHI K, SHIU K K. Scanning tunneling microscopic and voltammetric studies of the surface structures of an electrochemically activated glassy carbon electrode[J]. Analytical Chemistry,2002, 74(4): 879-885.
[20] NAGAOKA T, YOSHINO T. Surface properties of electrochemically pretreated glassy carbon[J]. Analytical Chemistry, 1986, 58(6):1037-1042.
[21] 王庆忠, 蒲彪. 乳品中抗生素的检测方法[J]. 食品工业科技, 2003,24(11): 79-82.
[22] 张增福. 基于微型表面等离子共振系统的牛奶中抗生素残留检测研究[D]. 天津: 天津大学, 2009.
[23] BERTRAM G K, ANGELIKA S, DIETRICH R, et al. Automated microarray system for the simultaneous detection of antibiotics in milk[J]. Analytical Chemistry, 2004, 76(3): 646-654.
[24] 邓斌, 邓春来, 张曦. 高效液相色谱法检测牛奶中青霉素残留的研究进展[J]. 中国兽药杂志, 2003, 37(6): 36-40.
[25] 韩洪莉, 高长玲. 牛奶中抗生素残留来源及几种常用检测方法[J].安全监测, 2009(8): 66-68.
[26] SCHNAPPINGER P, SCHNEIDER E, MARTLBAUE E, et al. Rapid detection of streptomycin and dihydrostreptomycin in milk by enzymelinked immunofiltration assay[J]. Food and Agricultural Immunology,1996, 8(4): 269-272.
[27] 秦燕, 陈毓芳, 林峰, 等. 固相萃取高效液相色谱法同时测定牛奶中的多种四环素残留[J]. 食品科学, 2005, 26(3): 202-204.
[28] 张素霞, 李俊锁, 钱传范. 牛奶中四环素多残留分析方法研究[J]. 畜牧兽医学报, 2002, 33(1): 51-54.
[29] 李利东, 宓晓黎, 袁建兴, 等. 酶联免疫检测试剂盒应用于牛奶中四环素残留的测定[J]. 乳业科学与技术, 2004, 27(2): 52-54.
Biosensor Preparation for Detecting Antibiotics by Immobilized Lactobacilli
QIAO Lixin, WU Susheng, PANG Guangchang*
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin 300314, China)
Using sodium alginate-starch gel as a fixing agent, lactobacilli were immobilized between two nuclear microporous membranes to make a sandwich-type sensing membrane, which was then fixed to a glassy carbon electrode to make a biosensor electrode. Based on the current responses of three antibiotics at different concentrations tested by electrochemical workstation, the calculation results showed that the most appropriate quantity of lactobacilli fixed by the sensor was 0.05 g, and now the limits of detection concentration (LDC) of the biosensor for penicillin, streptomycin and tetracycline were 1 × 10-10, 1 × 10-9and 1 × 10-9g/mL, respectively. The detection time was 4 min, which was obviously better than the requirement for the analysis of residual antibiotics at home and abroad. The electrode in 37 ℃ MRS medium could remain stable for 7 days at least, and the low temperature preservation time was extended, suggesting that the electrode performance was stable. In total, the microbial sensor by immobilized lactobacilli provides a new method for quantitative determination of antibiotics with high sensitivity, low cost, simple operation and fast detection. Therefore, it is not only applicable to the quantification and rapid detection of residual antibiotics in milk products, but also can detect a variety of types of antibiotics.
Lactobacillus helveticus; biosensor; penicillin; streptomycin; tetracycline
TS252.7
A
1002-6630(2015)16-0261-05
10.7506/spkx1002-6630-201516050
2014-11-23
国家自然科学基金面上项目(31371773)
乔立新(1990—),男,硕士研究生,研究方向为发酵工程。E-mail:1151665754@qq.com
*通信作者:庞广昌(1956—),男,教授,博士,研究方向为食品生物技术。E-mail:pgc@tjcu.edu.cn

