响应面法优化米糠蛋白的酶解工艺
刘梁,孙维矿,赵玲,李赫宇,陈新,*
(1.武汉轻工大学生物与制药工程学院,湖北武汉430023;2.天津市益倍建生物技术有限公司,天津300457)
响应面法优化米糠蛋白的酶解工艺
刘梁1,孙维矿1,赵玲1,李赫宇2,陈新1,*
(1.武汉轻工大学生物与制药工程学院,湖北武汉430023;2.天津市益倍建生物技术有限公司,天津300457)
通过单因素试验及响应面分析法,对米糠蛋白酶解制备抗氧化性米糠肽的工艺进行优化。在单因素试验的基础上,利用响应面法优化酶解条件,以酶解时间、温度、pH为自变量,以酶解后样品对超氧阴离子自由基清除率为响应值,根据Box-Benhnken中心组合设计原理,研究3个自变量及其交互作用对样品的超氧阴离子自由基清除率的影响。通过不同酶对米糠蛋白的水解度试验,确认碱性蛋白酶为最高效水解酶,在此前提下,响应面优化的最佳酶解条件为:酶解温度50℃,酶解时间4.5 h,pH 10,此条件下,超氧阴离子自由基清除率实际值为40.27%。米糠肽的相对分子质量分布测定结果表面米肽相对分子质量分布在142u~21 281 u之间。
响应面法;抗氧化性;米糠蛋白;酶解
抗氧化剂的种类很多,然而随着人们对化学合成的抗氧化剂如BHA、BHT在食品中应用的要求越来越严格,人们把目光逐步转向天然抗氧化剂,从各种植物动物组织中提取,如茶叶中的茶多酚、大豆中的大豆异黄酮、骨骼肌中的肌肽、枸杞中的枸杞多糖、大豆蛋白分解得到的大豆肽以及慈菇、扇贝、六月霜的提取物等[1]。具有抗氧化性质的多肽类物质一般称为抗氧化活性肽[2]。目前,抗氧化活性肽的获得途径主要有三种。第一种方法是从天然植物体中提取天然活性肽,这种方法提取成本高;第二种方法是通过消化过程中产生或水解蛋白而产生,一般采用酸法水解蛋白,其工艺简单、成本低,但因氨基酸受损严重,水解难控制而较少应用;第三种方法是通过化学方法、酶法、重组技术合成[3-5]。酶法生产的产品安全性高,生产条件温和,可定位生产特定的肽,且成本低,已成为活性肽最主要的生产方法[6]。目前已采用酶法研究出多种植物性多肽,如从玉米中得到降血压肽、高值寡肽和活性肽,从花生中得到花生肽等[7-8]。米糠是大米加工的副产品,是糙米碾白过程中被碾下的皮层及少量米胚和碎米的混合物,联合国工业发展组织把米糠称为一种未充分利用的原料[9]。米糠肽是通过酶法水解米糠蛋白制备的一种生物活性肽[10]。本文基于米糠蛋白水解度筛选酶解酶种;以抗氧化性为指标,通过响应面试验优化米糠蛋白制备抗氧化活性肽的酶解工艺,为米糠抗氧化肽资源的最大效益化利用提供理论依据。
1 材料和方法
1.1 试验材料与试剂
米糠蛋白(水分9.6%,蛋白质70.96%,脂肪2.22%,灰分2.53%):湖北洪森集团;碱性蛋白酶(酶活6 000 u/mg)、酸性蛋白酶(酶活6 000 u/mg)、中性蛋白酶(酶活6 000 u/mg):合肥博美生物科技有限责任公司;复合蛋白酶(Protamex)、风味酶(Flavourzyme):Novo Nordisk公司;三羟甲基氨基甲烷、邻苯三酚、氢氧化钠:国药集团化学试剂有限公司;氯化钠、盐酸、三氯乙酸和三氯化铁:天津市大茂化学试剂。
1.2 仪器和设备
PHS-2C型精密酸度计:上海雷磁仪器厂;RE52-99型旋转蒸发仪:上海亚荣生化仪器厂;LXJ-Ⅱ型离心沉淀机:上海医用分析仪器厂;SHB-Ⅲ型循环水式多用真空泵:郑州长城科工贸公司;电热恒温水浴锅:巩义市英峪予华仪器厂;752N型紫外可见分光光度计:上海光谱仪器有限公司;Waters 600液相色谱:Waters公司;AL204-01电子天平:梅特勒-托利多仪器有限公司;835-50氨基酸自动分析仪:日本Hitachi公司。
1.3 方法
1.3.1 水解度为指标进行酶种的选择
不同蛋白酶水解米糠蛋白:分别采用碱性蛋白酶、风味酶、中性蛋白酶和复合酶四种蛋白酶水解米糠蛋白250min,米糠蛋白以10%浓度溶解在200mL去离子水中,水解条件分别是:①碱性蛋白酶:pH 9.0,[E]/[S]48 AU/kg,45℃;②中性蛋白酶:pH 7.0,[E]/[S] 20AU/kg,50℃;③中性蛋白酶:pH 7.0,[E]/[S]10000LAPU/ kg,45℃;④复合蛋白酶:pH7.0,[E]/[S]30AU/kg,45℃。水解结束后立即把酶解液放入95℃以上热水中15 min中止酶解反应,灭酶后的水解液冷却至室温,用2mol/LNaOH调pH 7.0,10 000 r/min冷冻离心20min,上清液经浓缩后冷冻干燥备用。
蛋白质水解度(DH)的测定:在中性及碱性条件下采用pH-stat法,水解度的计算公式为:DH(%)=B× Nb×1/α×1/MP×1/htot×100%。式中∶B为碱液体积,mL; Nb为碱液的当量浓度,(mol/L);α为α-氨基的解离度(根据具体情况而定);MP为底物中蛋白质的含量,g;Htot为底物蛋白质中的肽键总数,(mmol/g);试验采用米糠白为原料,取htot=8.40。
1.3.2 抗氧化性为指标进行酶解工艺参数的优化
1.3.2.1 酶解工艺中单因素实验
酶解pH:本试验酶解pH分别选择为7、8、9、10、11、12,在酶解时间120min,在盐酸浓度为2mol/L,酸解液料比为1 m L/mg,酶解温度50℃的条件下,计算米糠蛋白水解物对超氧自由基的清除率。
酶解温度:本试验酶解温度分别选择为40、45、50、55、60、65℃,酶解时间120min,盐酸浓度为2mol/L,酸解液料比为1mL/mg,计算米糠蛋白水解物超氧自由基清除率。
酶解时间:本试验酶解温时间分别选择为3、4、5、6、7、8 h,在盐酸浓度为2mol/L,酸解液料比为1mL/mg,酶解温度为50℃,计算米糠蛋白水解物超氧自由基清除率。
1.3.2.2 酶解工艺的响应面优化试验
分析上述单因素实验数据,根据单因素实验得出的各因素最适范围,对酶解温度、pH、酶解时间3个因素设计响应面优化试验,以超氧自由基清除率为指标确定最佳酶解条件。
1.3.2.3 超氧阴离子自由基清除能力测定方法
pH 8.2,浓度50mmol/L的Tris-HCl缓冲液2.8mL中加入0.1 mL蒸馏水,于25℃保温10min,然后加入0.1mL于25℃预温的60mmol/L连苯三酚(空白管样品用0.1mL,10mmol/L的盐酸代替,测样品用0.1mL,50mmol/L提取液),总体积为3.0m L,在420 nm处测得总吸光度为A1,样品吸光度A2,空白对照吸光度A3。O2-清除率/%=A1-(A2-A3)/A1×100%。
1.3.2.4 米糠肽相对分子质量分布测定
采用Waters600(配2487紫外检测器和M32工作站)高效液相色谱仪,选择Tskgel G2000SW×L相对分子质量分级范围100Da~10 000Da的色谱柱,以乙腈/水/三氟乙酸(45/55/0.1体积比)为洗脱液,以细胞色素C(Mw12500)、抑肽酶(Mw6500)、杆菌酶(Mw1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mw451)和乙氨酸-乙氨酸-乙氨酸(Mw189)为相对分子质量标准品。流动相为乙晴/水/TFA 45/55/0.1,检测波长为220 nm,流速0.5mL/min,柱温为30℃。
1.3.2.5 米糠蛋白和米糠肽的氨基酸组成分析
将样品置于水解管中,加入6mol/L的盐酸溶液,真空封口。在110℃下水解24 h,冷却后定容、过滤、蒸干,加入0.02mol/L的盐酸溶液,放置30min,采用氨基酸自动分析仪测定除色氨酸以外的氨基酸含量。
2 结果与讨论
2.1 不同蛋白酶对米蛋白的水解进程曲线
蛋白酶在水解蛋白质时,对底物有特异性要求(见表1)。不同蛋白酶作用于同一种蛋白质,会产生不同的酶解产物,分别选用碱性蛋白酶、风味蛋白酶、复合蛋白酶和中性蛋白酶对米蛋白进行水解,根据氢氧化钠的用量,由公式计算出不同时间的水解度,绘成图形见表1。
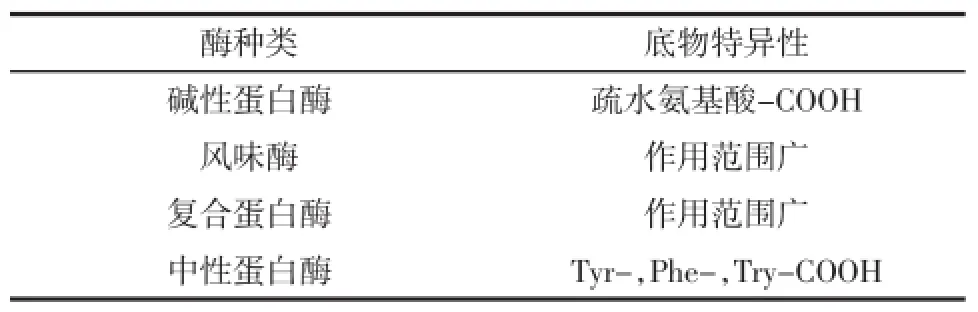
表1 四种蛋白酶的底物特异性Table1 The substrate specificity of four proteases
表1中数据显示,碱性蛋白酶对米蛋白的水解效果明显好于其他三种蛋白酶。碱性蛋白酶作用范围广,对疏水性氨基酸-COOH具有底物特异性,从水解进程曲线来看,碱性蛋白酶对米蛋白有较好的水解作用,远比其他几种蛋白酶的水解作用强,主要是因为碱性蛋白酶的纯度和活力较高。中性蛋白酶主要作用于苯丙氨酸和色氨酸-COOH参与形成的肽键,对米糠蛋白的作用非常弱,反应240min后水解度仅为7.0%。复合蛋白酶和风味酶虽然作用范围广,但在此条件下对米糠蛋白作用也较弱,复合蛋白酶对米糠蛋白的作用稍强可能是前者纯度和活性较高或对底物的特殊要求不同而造成。根据试验结果,选用碱性蛋白酶水解米糠蛋白,并对其水解条件进一步优化研究。
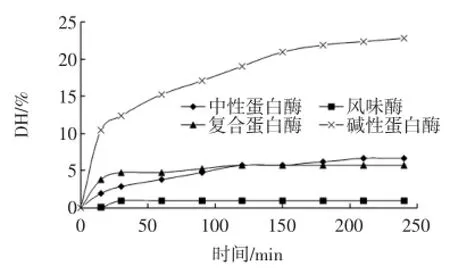
图1 不同蛋白酶对米蛋白的水解进程Fig.1 The hydrolysis process of rice protein in different protease
2.2 抗氧化性为指标进行酶解工艺参数的优化
2.2.1 水解工艺单因素试验
酶解温度对米糠水解物抗氧化活性影响:本试验酶解温度分别选择为40、45、50、55、60、65℃,在酶解时间120 min,盐酸浓度为2 mol/L,酸解液料比为1 mL/mg的条件下,计算米糠蛋白水解物对超氧自由基的清除率。碱性蛋白酶酶解米糠蛋白在不同温度下酶解物的超氧自由基清除能力如图2所示。

图2 酶解温度(A)、时间(B)、pH(C)对米糠水解物抗氧化活性影响Fig.2 The influence of reaction conditions on the antioxidant activity of rice bran hydrolysate.A(T),B(Time),C(pH)
随着酶解温度的升高,米糠肽抗氧化活性逐渐增强,55℃时米糠多肽对超氧自由基的清除效率都达到最高。温度对酶催化反应的影响,主要体现在酶稳定性和酶促反应上。一定的温度变化范围内,温度上升加快了反应速度,使超氧自由基的清除效果增强,并在55℃达到最大。继续升高温度,超氧自由基的清除效果明显降低,这是因为温度过高导致酶活性降低,多肽中抗氧化活性基团暴露相对减少。故选择酶解温度为55℃。
酶解时间对米糠蛋白水解物抗氧化活性影响:本试验酶解温时间分别选择为3、4、5、6、7、8 h,在盐酸浓度为2 mol/L,酸解液料比为1 mL/mg,酶解温度为50℃的条件下,计算米糠蛋白水解物对超氧自由基的清除率。碱性蛋白酶酶解米糠蛋白在不同酶解时间下酶解物的超氧自由基清除能力变化如图2所示。随着酶解时间的延长,米糠蛋白水解物对超氧自由基的清除率缓慢上升后又趋逐渐于平缓。由此得出,酶解时间对米糠水解物超氧自由基清除率效果的影响很小。为了节约成本,选择酶解时间4 h为最佳。
酶解pH对米糠水解物抗氧化活性影响:本试验酶解pH分别选择为7、8、9、10、11、12,在酶解解时间120min,盐酸浓度为2mol/L,酸解液料比为1mL/mg,酶解温度50℃的条件下,计算米糠蛋白水解物对超氧自由基的清除率。碱性蛋白酶酶解米糠蛋白在不同酶解pH下酶解产物的超氧自由基清除率变化如图2所示。pH在6到10范围内,米糠蛋白水解产物对超氧自由基的清除效果逐渐增强,pH为10时,米糠水解产物对超氧自由基清除效果达到最大。当pH大于10时,超氧自由基清除率逐渐降低,说明pH过大或过小都会抑制碱性蛋白酶的酶解活性。碱性蛋白酶对pH值的适应性,可能与其酶活性中心含有的羧基有关。酶的最适pH会受到各种因素的影响,如底物的浓度、种类及所处环境等,所以最适pH只有在一定条件下才有意义。故选择最佳pH为10。
2.2.2 响应面优化试验设计
在单因素试验基础上,采用响应面设计试验之中心组合试验Box-Behnken设计方案。以超氧自由基清除率为指标,优化米糠水解物活性成分抗氧化最佳提取工艺。选定显著影响超氧自由基清除效果的三个因素:酶解温度、酶解时间、酶解pH,为参考因素,分别以+1、0、-1分别代表自变量的高、中、低水平,对自变量进行编码,见表2。

表2 Box-Behnken响应面设计试验因素与水平Table2 Variables and levels in Box-Behnken in design expert
2.2.2.1 响应面优化试验结果
采用Design-Expert.v8.0.6软件对响应面试验数据进行线性拟合和方差分析,考察因素显著性,根据回归方程,响应面曲线图,等高线图,分析各因素交互作用的显著性,得出试验结果,见表3。
通过分析表3,可得各因素与超氧自由基清除率的二次多项式模型Y=38.24+2.43A-0.41B+2.86C-1.15AB-1.65AC-0.23BC-4.56A2-2.23B2+1.62C2。式中,Y为超氧自由基清除率的预测值,A、B、C分别代表-酶解温度,酶解时间,酶解pH的编码值,见表4。

表3 Box-Behnken响应面设计试验设计与结果Table 3 The results in Box-Behnken in design expert
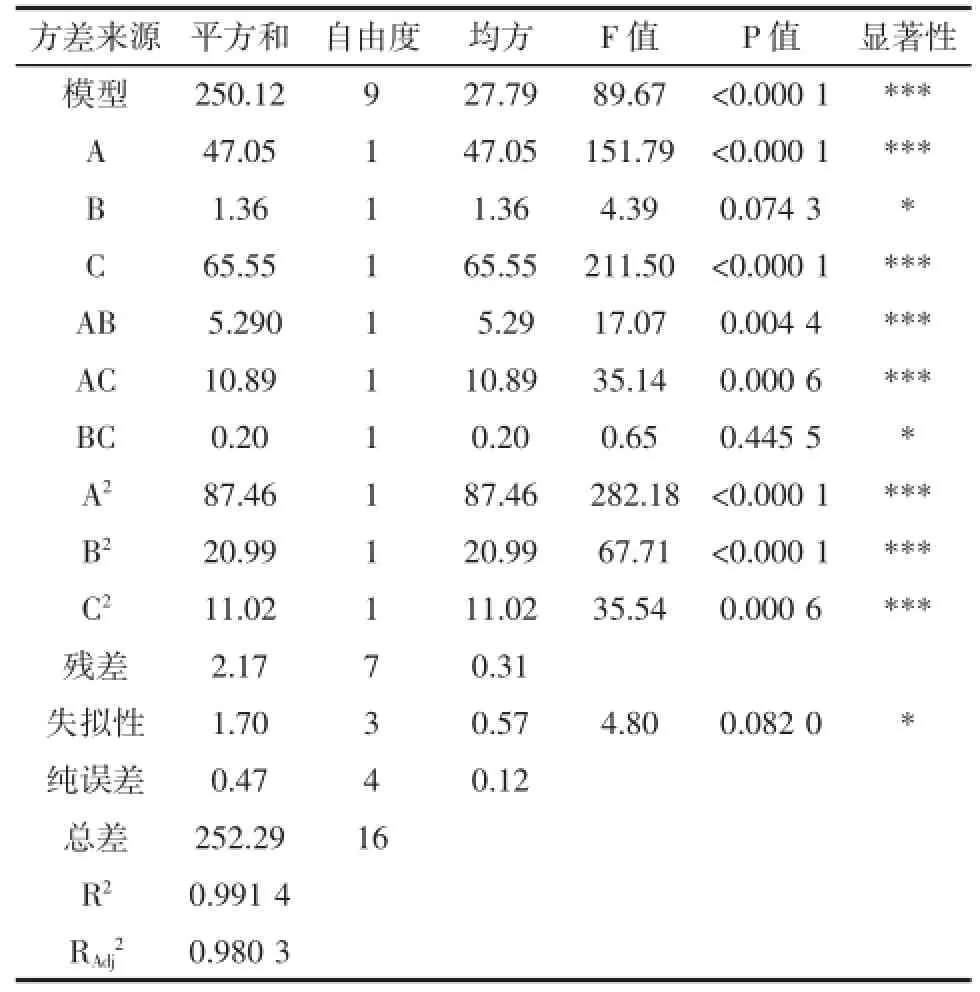
表4 拟合二次多项式模型的方差分析Table4 The quadratic multinomial variance analysis of the model
由表4可以看出:A、C、AC、AB、A2、B2、C2因素对米糠水解物超氧阴离子自由基清除率有显著的作用。清除效果显著性大小依次为C>A>B。F检验反应的是回归模型的有效性,方程复相关系数的平方R2= 0.991 4,说明该模型显著性好,失拟性大于0.05差异不显著,说明方程误差小。Radj2=0.980 3,说明软件建立的模型能够反映98.03%响应值的变化,较好反映提取条件对米糠水解物超氧阴离子自由基清除率大小变化规律,故用响应面法优化该工艺。
2.2.2.2 响应面优化试验分析
由方程作响应面曲面图如图3所示。
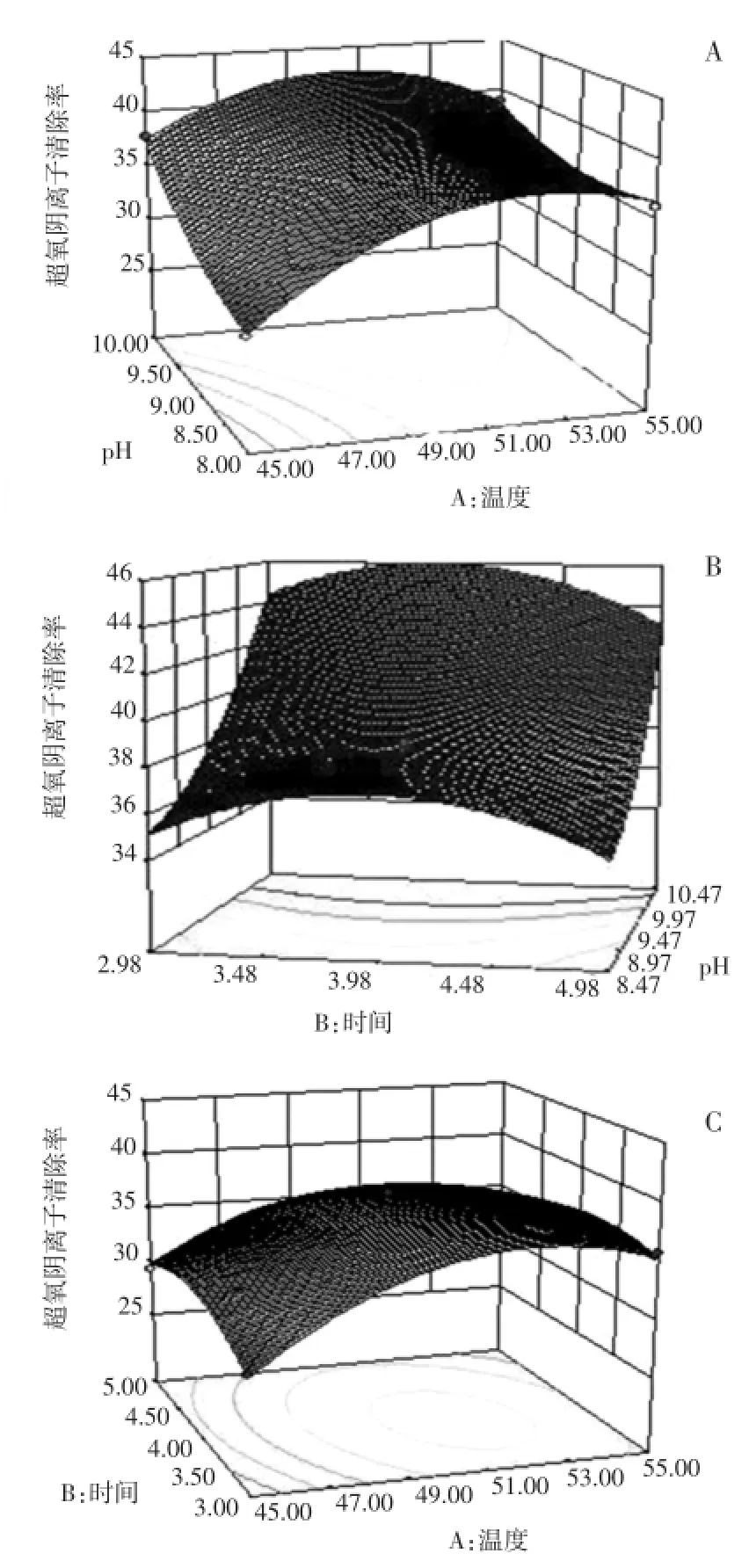
图3 酶解反应条件参数相互作用响应面曲面图;A,温度与pH;B,时间与pH;C,温度与时间Fig.3 The response surface image of reaction condition parameters.A,pH and temperature、B,Time and pH、C,Temperature and time.
(1)本试验中酶解温度与pH相互作用极其显著(P=0.000 6<0.01),将酶解时间固定在零水平,可以得到酶解温度与pH相互作用结果对米糠水解物超氧阴离子自由基清除率大小影响极大;(2)酶解时间与pH相互作用不是很显著(P=0.074 3>0.05),将酶解温度固定在零水平,可以得到酶解时间与pH相互作用结果对米糠水解物超氧阴离子自由基清除率大小影响一般;(3)酶解时间与酶解温度相互作用极为显著(P= 0.004 4<0.01),将pH固定在零水平,可以得到酶解时间与酶解温度相互作用结果对米糠水解物超氧阴离子自由基清除率大小影响极大。
2.2.2.3 米糠肽超氧阴离子自由基清除率的响应面分析与优化结果讨论
通过酶解温度(A)、酶解时间(B)、pH(C)及其交互作用对米糠水解物的超氧阴离子自由基清除率的影响分析得出:pH对米糠水解物超氧阴离子自由基清除率的影响最为显著,表现为曲线较陡;酶解温度对米糠超氧阴离子自由基清除率的影响也十分显著,表现为曲线较陡;而酶解时间相应表现为曲线较为平滑,且随其数值的增加或减少,响应值没有显著性变化。在酶解时间(B)值为0水平时,酶解温度(A)、pH(C)有着明显的交互作用,在pH(C)值为1水平时,酶解时间(B)为0水平,酶解温度(A)为0水平时,响应值达到最大值。
通过响应面优化米糠水解物超氧阴离子自由基清除效果最佳酶解工艺条件:酶解温度52.71℃,酶解时间4.37 h,pH 9.94。在此条件下,超氧阴离子自由基清除率预测值40.7225%。为了检验响应面设计试验可靠性,根据实际的操作条件对酶解最佳工艺进行修正:酶解温度50℃,酶解时间4.5 h,pH10,在此条件下,超氧阴离子自由基清除率实际值40.273 5%。实际值与预测值差异较小,说明响应面优化得到的酶解工艺条件可靠。
2.2.2.4 米肽相对分子质量分布的测定
图4是米肽的体积排阻高效液相色谱图,回归方程是lgMw=7.24-0.242T,相关系数R=0.995 0,表明各相对分子质量对数与各标样的洗脱时间成很好的相关性,可以准确地测定米肽的相对分子质量分布。
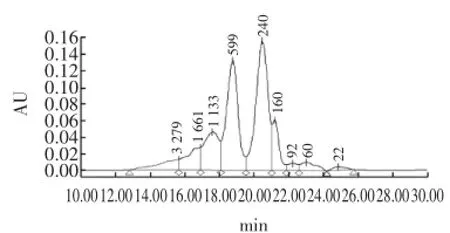
图4 米糠肽的SE-HPLC图谱Fig.4 The SE-HPLC spectra of rice bran peptides
从图4中可以看出,米肽的相对分子质量分布在142 u~21 281 u之间,主要集中在142 u~1413 u之间,其具体的分布情况见表5所示。
从表5中可以看出,相对分子质量分布在142 u~329 u之间的肽含量最高,为34.21%;其次是相对分子质量分布在329 u~738 u和738 u~141 3u之间的肽,含量分别为27.80%和12.39%;相对分子质量分布在1 413 u~2 836 u和2 836 u~2 1281 u之间的肽最少,含量分别为6.96%和5.42%。结合抗氧化功能条件的筛选结果,说明本条件酶解可得到具有较好的抗氧化活性短肽肽,由于目前所发现具有特殊生理功能的肽类物质其相对分子质量一般在1 000 u以下,与本实验结果一致。

表5 米糠肽的相对分子质量分布Table5 Molecular weight distribution of rice bran peptides
2.2.2.5 米肽和米蛋白的氨基酸组成
米肽和米蛋白的氨基酸组成见图5。

图5 米糠肽和米糠蛋白的氨基酸组成Fig.5 Amino acid composition of rice bran peptides and protein
图5表明,米肽的氨基酸组成跟米蛋白差别不大。氨基酸分布较均匀,谷氨酸含量最高,为16.35%;其次为精氨酸和天冬氨酸及亮氨酸,分别为11.09%、9.46%和7.06%,四种氨基酸含量之和为45%左右;丝氨酸、甘氨酸、丙氨酸、缬氨酸、苯丙氨酸和赖氨酸,含量之和为35%左右。
3 结论
以水解度为指标,研究了碱性蛋白酶、中性蛋白酶、复合蛋白酶和风味酶对米蛋白的水解作用,结果表明碱性蛋白酶对米蛋白的水解作用最强,其次为中性蛋白酶和复合蛋白酶,风味酶作用最弱,因此选定碱性蛋白酶水解米蛋白制备米肽。以抗氧化性为指标,利用响应面回归分析法对米糠中水解物超氧阴离子自由基清除实验条件进行了研究,着重考察了pH、温度及提取时间3个因素对米糠中活性肽超氧阴离子自由基清除率的影响,通过响应面优化米糠肽超氧阴离子自由基清除效果最佳酶解工艺条件:酶解温度52.71℃,酶解时间4.37 h,pH9.94。根据实际对试验条件进行修正得到试验最佳条件为:酶解温度50℃,酶解时间4.5 h,pH10,在此条件下,超氧阴离子自由基清除率实际值40.27%。氨基酸组成分析结果发现米肽的氨基酸组成跟米蛋白类似,因此米肽可以在食品中广泛使用。米肽的相对分子质量分布测定结果发现,米肽相对分子质量分布在142 u~21 281 u之间,主要集中在142 u~1 413 u之间,而具有特殊生理功能的肽类物质其相对分子质量一般在1 000 u以下。
[1]包斌,德力格尔桑,许勤.抗氧化肽的研究进展[J].内蒙古农业大学学报,2004,25(1):121-124
[2] 周小理,李红敏.植物抗氧化(活性)肽的研究进展[J].食品工业, 2006(3):11-13
[3]张昊,任发政.天然抗氧化肽的研究进展[J].食品科学,2008,29 (4):443-447
[4]王嘉榕,腾达,田子罡,等.功能性抗氧化肽制备与机制研究进展[J].天然产物研究与开发,2008,20:371-375
[5]程云辉,王璋,许时婴.酶解麦胚蛋白制备抗氧化肽的研究[J].食品科学,2006,27(6):147-151
[6]程云辉,曾知音,郭建伟,等.抗氧化肽的酶法制备及其构效关系的研究进展[J].食品与机械,2009,25(6):174-180
[7] 张强,阚国仕,陈红漫,等.酶解玉米蛋白粉制备抗氧化肽[J].食品工业科技,2005,26(6):109-111
[8]吴瑕,江连洲,王鑫,等.大豆蛋白酶水解物抗氧化活性的研究[J].中国粮油学报,2010,25(11):37-42
[9]秦微微,金婷,宋学东,等.米糠深加工产品的研究与应用[J].农产品加工·学刊,2013(12):61-63
[10]张强,周正义,马玉涵,等.米糠肽抗氧化活性的研究[J].中国粮油学报,2008,23(5):9-12
Optim ization of the Enzymolysis Technology of Rice Bran Protein by Response Surface Methodology
LIU Liang1,SUN Wei-kuang1,ZHAO Ling1,LI He-yu2,CHEN Xin1,*
(1.School of Biological and Pharmaceutical Engineering,Wuhan Polytechnic University,Wuhan 430023,Hubei,China;2.Tianjin Ubasichealth Nutrition Co.,Ltd.,Tianjin 300457,China)
The enzymolysis technology of the protein from rice bran was optimized by the single factor experiment combined with response surface methodology.On the basis of single factor experiments,enzymatic hydrolysis time,temperature,pH were set as the argument value,and the rate of superoxide anion free radical scavenging by enzymolysis sample was set as the response value.According to the Box-Benhnken central composite design theory,the influence of three independent variables and their interactions on the superoxide anion free radical scavenging rate was studied.The alkaline protease was confirmed the most efficient hydrolase through the hydrolysis of different enzymes test.The optimum technology was confirmed by response surface methodology:extraction time 4.5 h,enzymolysis temperature 50℃and pH 10.Under these conditions,the superoxide radical scavenging rate of rice bran protein was 40.27%.And the molecular weight of rice bran peptide was between 142 u-21 281 u.
response surface methodology;antioxidant activity;rice bran protein;enzymolysis
10.3969/j.issn.1005-6521.2015.03.019
2014-11-28
刘梁(1981—),男(汉),讲师,博士,研究方向:食品功能因子研究。
*通信作者

