芪冬活血饮对急性肺损伤大鼠TLR4/NF-κB炎症信号通路的影响
洪辉华,杨珺超,高润娣,赵玮,朱渊红,蔡宛如
(1.浙江中医药大学附属第一医院 呼吸科,浙江 杭州 310006;2.浙江中医药大学附属第二医院 呼吸科,浙江 杭州 310005)
·论 著·
芪冬活血饮对急性肺损伤大鼠TLR4/NF-κB炎症信号通路的影响
洪辉华1,杨珺超1,高润娣1,赵玮1,朱渊红1,蔡宛如2
(1.浙江中医药大学附属第一医院 呼吸科,浙江 杭州 310006;2.浙江中医药大学附属第二医院 呼吸科,浙江 杭州 310005)
目的:通过观察芪冬活血饮对脂多糖所致大鼠急性肺损伤(ALI)的干预作用,明确芪冬活血饮的保护作用并探讨其作用机制。方法:将50只SD大鼠随机分为空白组,模型组,高、中、低剂量中药治疗组5组。气道内滴注脂多糖建立急性肺损伤模型。中药治疗组以芪冬活血饮灌胃,空白组及模型组以0.9%氯化钠溶液灌胃。各组大鼠造模后24 h处死,收集标本。结果:①芪冬活血饮可以减轻肺损伤大鼠肺泡结构破坏,肺水肿及炎性细胞浸润。②ALI大鼠肺泡灌洗液肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-10水平增高,芪冬活血饮降低TNF-α、IL-1β水平,升高IL-10水平,高剂量组与低剂量组比较差异有统计学意义(P<0.01)。③ALI大鼠Toll样受体-4(TLR4)、核转录因子-κB(NF-κB)p65蛋白及mRNA表达增加,芪冬活血饮可减少TLR4、NF-κB p65蛋白及mRNA表达,并有一定的剂量相关性。结论:芪冬活血饮对LPS诱导的大鼠ALI有保护作用,其机制与抑制TLR4/NF-κB p65炎症信号通路,降低促炎细胞因子TNF-α、IL-1β水平,升高抗炎细胞因子IL-10水平有关。
急性肺损伤;Toll样受体-4;核转录因子κB;细胞因子
急性肺损伤/急性呼吸窘迫综合征(acute lung injury/acute respiratory distress syndrome,ALI/ARDS)是一种呼吸系统急危重症,是指由心源性以外的各种肺内外致病因素导致的急性、进行性低氧性呼吸衰竭。目前认为肿瘤坏死因子-α(tumornecrosis factor-alpha,TNF-α)、白细胞介素(interleukin,IL)-1β、一氧化氮(nitric oxide,NO)等促炎症递质大量释放,IL-10、IL-13等抗炎递质分泌相对不足,导致体内促炎/抗炎递质严重失衡是ALI发生发展的主要机制[1-2]。
TLR4/NF-κB炎症信号通路对ALI促炎/抗炎递质平衡起关键的调控作用。炎症反应的本质是宿主识别外界致炎信号并进行适应性应答的过程。Toll样受体(Toll-like receptors,TLRs)是免疫细胞识别病原微生物致炎组分,启动炎症反应的重要模式识别受体(pattern recognition receptors,PRRs),其中脂多糖(lipoplolysaccharide,LPS)所致的炎症反应主要由TLR4负责识别。TLR4与LPS结合后,经可通过多种途径调控核转录因子-κB(nuclear factor-κB,NF-κB)活化,活化的NF-κB上调TNF-α、IL-1β、IL-8等促炎细胞因子的表达,致使体内炎症失衡最终导致ALI发生发展[3-5]。
在中医理论和实践上,ALI属于热毒瘀结、气阴两虚病症,课题组在清热解毒、祛瘀通腑、益气养阴为主的治疗原则上,采用黄芪、麦冬、虎杖、当归等药物组成“芪冬活血饮”,前期研究已经证实“芪冬活血饮”能减少促炎症递质TNF-α、内皮素-1、肺表面活性蛋白A分泌,增加抗炎递质IL-10分泌,纠正促炎/抗炎递质失衡,对ALI大鼠具有良好的保护作用[6-9]。然而,芪冬活血饮调控炎症递质释放的机制尚不明确。
本研究拟观察芪冬活血饮对ALI大鼠肺组织TLR4、NF-κB p65蛋白及mRNA和肺泡灌洗液TNF-α、IL-1β、IL-10水平的影响,明确芪冬活血饮对TLR4/ NF-κB炎症信号通路的影响,探讨其调控炎症反应的机制。
1 材料和方法
1.1 实验动物 健康雄性SD大鼠50只,清洁级,体 质量(200±20)g,由浙江中医药大学动物实验中心提供。
1.2 供试药品 芪冬活血饮(黄芪20 g、麦冬12 g、虎杖20 g、当归12 g)药材由浙江省中医院中药房提供,由浙江中医药大学制剂室制成质量体积比1:1汤剂,灭菌处理后,-4 ℃低温保存备用。
1.3 主要试剂 LPS(coli 055:B5)(批号:L2880)购自Sigma公司。大鼠TNF-α ELISA试剂盒(批号: RT20135528B)、大鼠IL-1β ELISA试剂盒(批号: RT20138526B)、大鼠IL-10 ELISA试剂盒(批号:RT20131025B)购自RND公司。免疫组织化学二步法Envision试剂盒(批号:26F1779A)购自DAKO公司,NF-κB p65免疫组织化学试剂盒(批号:SC-372G211)、TLR4免疫组织化学试剂盒(批号:SC-30002A2510)、DAB显色液(批号:08M1779A)均购自santacruz公司。Trizol Reagent(批号:40950732) 购自Bio Basic公司;RTPCR定量试剂盒(批号:DRR041A),cDNA合成反转录试剂盒(批号:CK101D), DNA Marker(批号:DL 2000)均购自TAKARA公司。
1.4 主要仪器 石蜡切片机(德国Leica公司HM 340E型),酶标分析仪(北京朗普新技术有限公司DNM-9602型),荧光显微镜摄像机(日本OLYMPUS公司BX20型),定量PCR仪器(美国ROCHE公司ABI 7500型),台式高速冷冻离心机(Eppendorf公司Certrifuge 5417R型),电泳系统(Bio-RAD公司 Mini-Proten Tetra System型),凝胶成像仪(Bio-RAD公司ChemiDoc XRS+System型)。
1.5 模型建立 各组大鼠均经异氟烷雾化麻醉,在距大鼠环状软骨约0.5 cm处作大小约0.3 cm切口,分离至气管;将LPS配置成3 mg/mL溶液,经针筒按照1.5 mg/kg剂量缓慢注入大鼠气管中,然后将大鼠左右上下摇晃,使LPS均匀分布于肺组织中。空白组采用等量0.9%氯化钠溶液气管内滴注。
1.6 实验分组及给药 健康雄性SD大鼠50只按随机数字表法分成5组,即空白组,模型组,低、中、高剂量芪冬活血饮治疗组(简称低、中、高剂量组),每组10只。低、中、高剂量组造模前24、12 h及造模后12 h分别以4、8和16 mL/kg芪冬活血饮灌胃,模型组和对照组各时间点以8 mL/kg 0.9%氯化钠溶液灌胃。造模后24 h腹腔注射戊巴比妥溶液麻醉大鼠(剂量为3 mL/kg),处死动物采集标本。
1.7 肺泡灌洗液 暴露颈部气管及两肺,左肺用于肺泡灌洗。结扎右主支气管,经由颈部气管插入5.5号静脉注射针至左主支气管,用无菌手术缝合线由气管食管间隙绑扎气管及静脉注射针,使其固定并密封。注射针接5 mL针筒注入3 mL 0.9%氯化钠溶液见左肺膨起,轻轻按摩左肺30 s,再用20 mL 针筒缓慢回抽,反复3次,回收率在50%以上。回收液分装入离心管中,低速离心机3 000 r/min离心15 min,上清液-80 ℃冰箱保存备用。ELISA法测TNF-α、IL-1β、IL-10水平。操作参照说明书。
1.8 肺组织 开胸取右肺,取右下肺置痰杯-80 ℃冰箱保存PCR测定用。余肺中性缓冲甲醛(pH 7.4)固定24 h后,石蜡包埋切片。其中各组取2只用于HE染色,剩余大鼠肺组织行免疫组织化学检测。
①经常规HE染色,光镜下观察各组肺组织病理变化。
②以免疫组织化学二步法检测肺组织TLR4、NF-κB p65的蛋白表达,在细胞浆内或细胞核内出现黄、棕色颗粒为阳性细胞。并参照文献[10] 计算免疫组织化学积分:将阳性细胞按染色强度打分,无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分(染色深浅需与背景比较);再将阳性细胞所占的百分比打分,0分为阴性,1分为阳性细胞小于等于10%,2分为11%~50%,3分为51%~75%,4分为大于75%;两者的乘积为免疫组织化学表达积分。
③RT-PCR法检测肺组织TLR4、NF-κB p65mRNA表达。肺组织液氮保存,采用Trizol一步法试剂盒 提取肺组织细胞总RNA,经琼脂糖凝胶电泳鉴定总RNA纯度、完整性,紫外分光光度仪定量后,取总RNA 反转录为cDNA。根据美国NCBI数据库提供的mRNA全基因序列,采用Primer 5.0引物设计软件和引物设计原则进行PCR引物的设计,由上海生物工程有限公司合成。引物序列:cav-1的上游引物为5’-GATT GCTCAGACATGGCAGTTTC-3’,下游引物为5’-CACTCGAGG TAGGTGTTTCTGCTAA-3’,扩增片段长度135 bp;NF-κB p65上游引物为5’-GGACTGCCGGGATGGCTTCTAT-3’,下游引物为5’-GCTTGCTCCAGGTCTCGCTTCTT-3’,扩增片段长度108 bp;18-s的上游引物为5’-GAATTCCCAGT AAGTGCGGGTCATA-3’,下游引物为5’-CGAGGGCCTC ACTAAACCATC-3’,扩增片段长度为105 bp。进行PCR 反应。电泳分离、显色成像。以DNA maker为标准, Marker为TAKARA DL 2000,根据扩增产物片段大小来鉴定目的基因片段,以18-s光度值为内参考,以待测基因与18-s的比值为待测基因的相对表达量,目的基因的相对表达水平以相对表达量(2-△Ct× 104)进行分析。PCR反应条件:95 ℃,1 min;40个循环:95 ℃,10 s;64 ℃,25 s(收集荧光)。
1.9 统计学处理方法 模型组大鼠有2只在实验结束前死亡,统计处理时去除各组与模型组相同编号大鼠数据。采用SPSS17.0统计软件。所有数据以±s表示,计量资料各组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理学比较 空白组大鼠肺呈均匀淡粉红色,包膜光滑,弹性好,表面未见病损灶;光镜下肺组织结构完整,肺泡结构清晰,肺泡间隔无水肿,肺泡腔内未见水肿液,偶见肺间质白细胞少量浸润。模型组大鼠肺体积显著增大,呈暗红色,包膜下充血水肿明显,弹性降低,表明可见斑片出血;光镜下肺泡结构破坏,肺泡内广泛积液水肿,肺泡间隔增厚,肺泡变小伴出血。各剂量治疗组肺包膜下充血水肿均较模型组减轻,镜下肺泡结构不同程度破坏,肺泡内有炎症细胞浸润,但程度均轻于模型组。见图1。
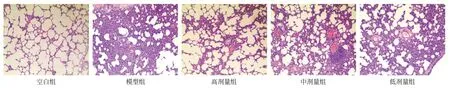
图1 各组肺组织HE病理图片(HE,×100)
2.2 各组大鼠肺泡灌洗液细胞因子比较 空白组TNF-α、IL-1β、IL-10含量均最低,与其余各组比较差异均有显著统计学意义(P<0.01)。模型组TNF-α、IL-1β含量最高,而IL-10含量均低于各治疗组;和低剂量组比较差异均无统计学意义,与中剂量组、高剂量组比较差异均有统计学意义。见表1。
三治疗组TNF-α、IL-1β含量比较,低剂量组最高,高剂量组最低。高剂量组与其余两组比较差异有统计学意义,低剂量组与中剂量组比较差异无统计学意义。三治疗组中IL-10含量低剂量组最低,高剂量组最高。低剂量组与中、高剂量组比较差异有显著统计学意义(P<0.01);中、高剂量组间比较差异无统计学意义(见表1)。
表1 各组大鼠肺泡灌洗液细胞因子比较(n=8,±s,pg/mL)
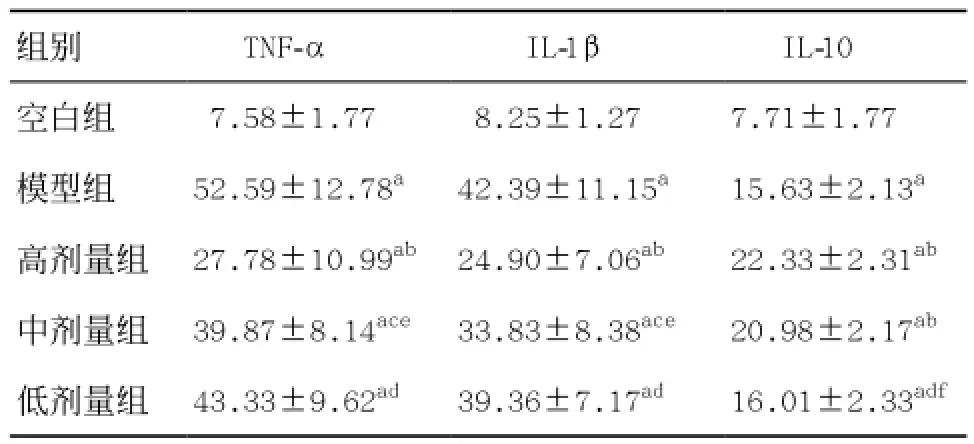
表1 各组大鼠肺泡灌洗液细胞因子比较(n=8,±s,pg/mL)
与空白组比:aP<0.01;与模型组比:bP<0.01,cP<0.05;与高剂量组比:dP<0.01,eP<0.05;与中剂量组比:fP<0.01
2.3 各组大鼠免疫组织化学TLR4、NF-κB p65蛋白表达及积分比较 空白组可见少许肺泡上皮细胞及气道上皮细胞NF-κB p65阳性表达,但染色程度低,其余细胞未见表达;模型组及各剂量组NF-κB p65阳性细胞广泛分布在气道黏膜上皮细胞、血管内皮细胞、浸润的中性粒细胞及巨噬细胞等炎症细胞中,在炎性细胞胞浆和细胞核内均有明显表达,各剂量组NF-κB p65阳性细胞染色程度及阳性细胞百分比均低于模型组,其中高剂量组低于低剂量组。见图2。

图2 各组肺组织NF-κB p65蛋白表达情况(Envision,×200)
空白组可见少许血管内皮细胞及肺泡上皮细胞TLR4阳性表达,染色程度低,其余细胞基本未见表达;模型组和各剂量组TLR4主要表达在血管内皮细胞、肺泡上皮及少量的炎症细胞上,模型组表达程度较NF-κB p65低,但染色程度及阳性细胞比例仍明显高于其余各组;高剂量组低于低剂量组。见图3。
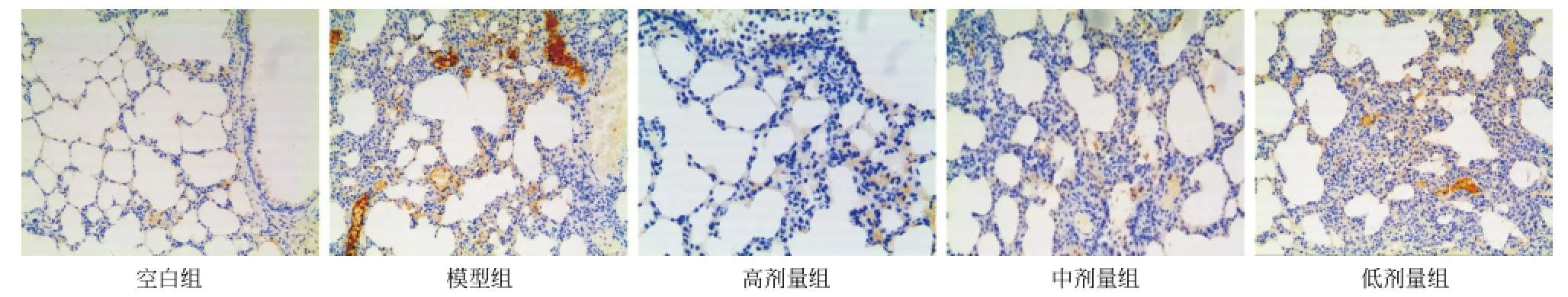
图3 各组肺组织TLR4蛋白表达情况(Envision,×200)
免疫组织化学TLR4、NF-κB p65积分:均为空白组最低,模型组含量最高。空白组和其余各组比较差异均有显著统计学意义(P<0.01);模型组NF-κB p65积分和低剂量组比较差异无统计学意义,与中、高剂量组比较差异均有显著统计学意义(P< 0.01);模型组TLR4积分与中、低剂量组比较差异无统计学意义,与高剂量组比较差异有统计学意义(P=0.026)。见表2。
表2 各组大鼠肺组织免疫组织化学积分比较(n=6,±s)
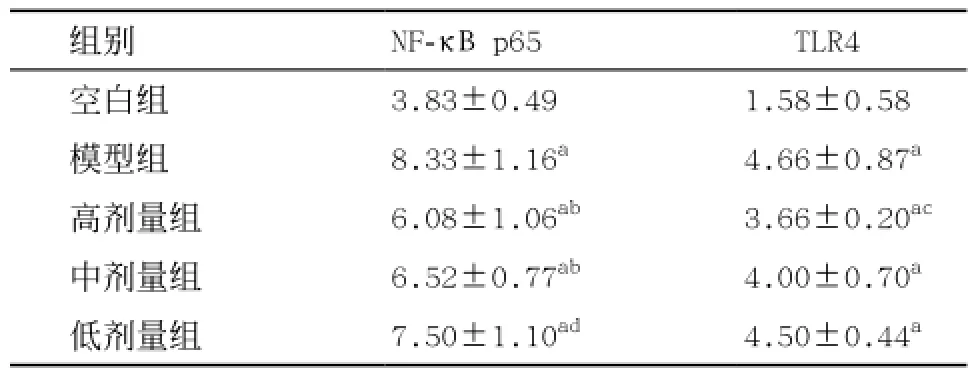
表2 各组大鼠肺组织免疫组织化学积分比较(n=6,±s)
与空白组比:aP<0.01;与模型组比:bP<0.01,cP<0.05;与高剂量组比:dP<0.01
高、中、低剂量组间TLR4、NF-κB p65积分比较,均为低剂量组最高,高剂量组最低。三组间比较,除NF-κB p65积分低、高剂量组比较差异有统计学意义(P<0.01),余两两比较差异均无统计学意义。见表2。
2.4 各组大鼠TLR4、NF-κB p65 mRNA相对表达量比较 TLR4、NF-κB p65 mRNA相对表达量均为空白组最低,模型组最高。TLR4空白组和其余各组比较差异均有显著统计学意义,模型组和中、高剂量芪冬活血饮组比较差异有统计学意义(P<0.01),模型组与低剂量芪冬活血饮组比较差异无统计学意义。NF-κB p65模型组和其余各组比较差异均有统计学意义(P<0.01)。NF-κB p65空白组和中、高剂量组比较差异无统计学意义,与低剂量组比较差异有统计学意义(P<0.01)。
高、中、低剂量组间TLR4、NF-κB p65 mRNA相对表达量比较,低剂量组最高,高剂量组最低。三组间比较,低剂量组与中、高剂量组比较差异有统计学意义,高剂量组与中剂量组比较差异无统计学意义。见图4、表3。
图4 各组肺组织mRNA表达结果
表3 各组大鼠肺组织mRNA相对表达量比较(n=8,±s 2-△Ct× 104)
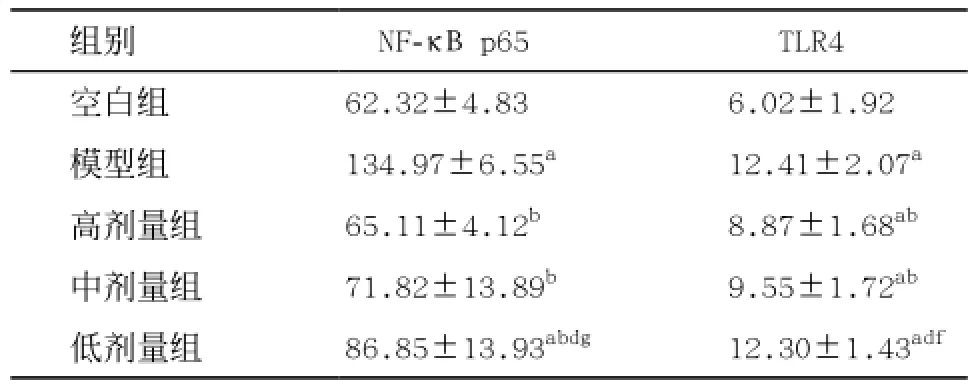
表3 各组大鼠肺组织mRNA相对表达量比较(n=8,±s 2-△Ct× 104)
与空白组比:aP<0.01;与模型组比:bP<0.01;与高剂量组比:dP<0.01,eP<0.05;与中剂量组比:fP<0.01,gP<0.05
3 讨论
ALI/ARDS是一种呼吸系统急危重症,以肺微血管通透性增加引发的弥漫性肺间质和肺泡腔水肿及炎性细胞浸润为主要病理改变[1]。模型组大鼠肺泡结构破坏,肺泡内广泛积液水肿伴出血,大量炎症细胞浸润,各芪冬活血饮治疗组损伤程度均有不同程度的减轻,其中以高剂量组效果最为明显。这表明采用LPS气道内滴注方法复制大鼠肺损伤模型成功,芪冬活血饮对其有保护作用,且剂量越高保护作用越强。
革兰阴性杆菌感染释放的LPS是导致ALI的最主要原因[11]。进入体内的LPS被PRRs识别并实现炎 症信号传导,导致TNF-α、IL-1β、NO等促炎递质大量 分泌,IL-10、IL-13等抗炎递质分泌相对不足,致使 体内促炎/抗炎递质失衡是ALI发生发展的关键环节。其中TNF-α起关键作用,IL-1β起协同作用。TNF-α可刺激巨噬细胞、内皮细胞等效应细胞大量分 泌IL-1β、IL-8等促炎细胞因子及血小板激活因子、 前列腺素、NO等次级炎症递质;而IL-1β可增强组织 细胞对TNF-α的敏感性,并刺激TNF-α、IL-8、E-选择素、P-选择素等其他炎症递质合成分泌[2,12-13]。两者相互促进,启动炎症级联反应导致AIL/ARDS。而LPS在刺激TNF-α、IL-1β等促炎递质分泌同时,也刺激IL-10、IL-4等抗炎递质的分泌。IL-10是体内重要的抗炎递质,可直接抑制TNF-α和IL-1β的合成分泌及过度激活重建体内炎症递质及抗炎递质的平衡[14]。
TLR4/NF-κB通路是启动细胞内炎症信号传导的经典通路,在LPS所致的急性肺损伤中起着重要作用。目前已经明确TLR4是识别LPS并介导其炎症信号传导的最主要的PRRs。TLR4与LPS结合后,主要经由髓样分化因子88(mycloid differentiation factor 88,MyD88)途径逐级传递信号至肿瘤坏死因子受体相关因子6(TNF receptor-associated factor-6 TRAF6),活化后的TRAF6与下游转化生长因 子-β激活激酶1[transforming growth factor-β (TGF-β)activated kinase-1 TAK1] 、TAK1结合蛋白1、2、3(TAK1-binding protein TAB)形成复合物,磷酸化NF-κB抑制因子(inhibitor of NF-κB,IκB),导致IκB降解激活NF-κB[3-4,15-16]。通常所说的NF-κB是指在NF-κB/Rel家族成员中具有主要生物活性的p50/p65异源二聚体,激活后的NF-κB迅速移位至细胞核内,大量上调IL-1β、TNF-α、IL-6、IL-8等促炎细胞因子大量表达[5]。
各治疗组TNF-α、IL-1β较模型组低,IL-10较模型组高,表明芪冬活血饮既能降低TNF-α、IL-1β等促炎细胞因子水平,又能增加抗炎细胞因子IL-10水平,从而减轻肺组织损伤。再次证实芪冬活血饮能调控ALI大鼠促炎/抗炎递质平衡,对肺损伤大鼠具有保护作用[6-9]。三治疗组间比较,高剂量组与低剂量组比较差异均有统计学意义,表明随剂量的增加,其调控炎症递质平衡作用增强。
模型组TLR4、NF-κB p65蛋白及mRNA表达均较空白组增加,且差异均有显著统计学意义,提示LPS可明显刺激ALI大鼠肺组织TLR4、NF-κB p65蛋白及mRNA表达。TLR4、NF-κB p65免疫组织化学积分模型组与高剂量组比较差异均有统计学意义,而与低剂量组比较差异无统计学意义,提示随剂量增加芪冬活血饮降低ALI大鼠TLR4、NF-κB p65蛋白表达作用增强。TLR4、NF-κB p65mRNA表达中、高剂量组与模型组差异均有显著统计学意义,表明中高剂量芪冬活血饮均能明显抑制TLR4、NF-κB p65mRNA表达,两者比较差异无统计学意义,与低剂量组比较差异均有统计学意义,提示在中、低剂量后芪冬活血饮抑制TLR4、NF-κB p65mRNA表达的作用随剂量增加而增强,但中等剂量后其作用程度并不随剂量增加而增强。
以上结果表明芪冬活血饮对LPS诱导的大鼠ALI有保护作用,其机制与抑制TLR4/NF-κB p65炎症信号通路,降低促炎细胞因子TNF-α、IL-1β水平,升高抗炎细胞因子IL-10水平纠正炎症失衡有关。
[1] American Thoracic Society.Round Table Conference.Acute lung injury[J] .Am J Respir Crit Care Med,1998,158(2): 675-679.
[2] Puneet P,Moochhala S,Bhatia M.Chemokines in acute re-spiratory distress syndrome[J] .Am J Physiol Lung Cell Mol Physiol,2005,288(1): L3-L15.
[3] Takeda K,Kaisho T,Akira S.Toll-like receptors[J] .Annu Rev Immunol,2003,21(4): 335-376.
[4] Barton GM,Medzhitov R.Toll-like receptor signaling path ways[J] .Science,2003,300(6): 1524-1525.
[5] Sun Z,Andersson R.NF-κB activation and inhibition: a review[J] .Shock,2002,18(2): 99-106.
[6] 蔡宛如,洪辉华,骆仙芳,等.芪冬活血饮对油酸致大鼠急性肺损伤干预作用的实验研究[J] .中华中医药杂志,2008,23(9): 830-832.
[7] 蔡宛如,洪辉华,骆仙芳,等.芪冬活血饮对油酸致大鼠内皮素-1水平的影响[J] .浙江中医药大学学报,2008,32 (2): 158-160.
[8] 李志军,丁志山,董雷,等.芪冬活血饮对急性肺损伤大鼠肺表面活性蛋白A在肺与大肠表达的影响及相关性研究[J] .中华中医药杂志,2013,28(3): 698-702.
[9] 李敏静,李志军,郑继生,等.急性肺损伤时大鼠各组织SP-A的变化及其相关性研究[J] .中华中医药杂志,2013,28(4): 933-937.
[10] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J] .中国癌症杂志,1996,6(4): 229-231.
[11] Bone RC.The pathogenesis of sepsis[J] .Ann Intern Med,1991,115(6): 457-469.
[12] Van der Poll T,Lowry SF.Tumor necrosis factor in sepsis: mediator of multiple organ failure or essential part of host defense?[J] .Shock,1995,3(1): 1-12.
[13] Kolb M,Margetts PJ,Anthony DC,et al.Transient expres-sion of IL-1beta induces acute lung injury and chronic re-pair leading to pulmonary fibrosis[J] .J Clin Invest,2001,107(12): 1529-1536.
[14] Shanley TP,Vasi N,Denenberg A.Regulation of chemo-kine expression by IL-10 in lung inflammatory[J] .Cytokine,2000,12(7): 1054-1064.
[15] Medzhitov R.Toll-like receptors and innate immunity[J] .Nat Rev Immunol,2001,1(2): 135-145.
[16] T Kawai,S Akira.Toll-like receptor downstream signaling [J] .Arthritis Res Ther,2005,7(1): 12-19.
(本文编辑:吴健敏)
The effect of Qidong Huoxue Decoction on TLR4/NF-κB inflammatory signaling pathway in acute lung in- jury rats
HONG Huihua1,YANG Junchao1,GAO Rundi1,ZHAO Wei1,ZHU Yuanhong1,CAI Wanru2.
1.De- partment of Respiration,the First Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou,310006; 2.Department of Respiration,the Second Affiliated Hospital of Zhejiang Chinese Medical University,Hangzhou,310005
Objective:To investigate the protective effect of qidonghuoxue decoction (QD) on acute lung injury (ALI) in rats induced by lipopolysaccharide (LPS),and to explore the mechanism.Methods:Fifty SD rats were divided into five groups randomly: control group,model group,high-dose QD group,medium-dose QD group,low-dose QD group.The ALI model was established by intratracheal instillation of LPS.QD was administrated via esophagus to rats in QD groups; NS was substitution in control and model groups.All rats were executed 24 h after modeling,bronchoalveolar lavage fluid (BALF) and lung tissue were collected.Results:①HE staining showed that QD could reduce alveolar damage,pulmonary edema and inflammatory cells infiltration in rats with ALI.②TNF-α,IL-1β,IL-10 levels were increased in rats with ALI,QD decreased the levels of TNF-α and IL-1β,increased the level of IL-10,there was significant difference between the high-dose and lowdose group (P<0.01).③The protein and mRNA expression of TLR4/NF-κB p65 both increased in rats with ALI,while QD reduced the expression,and the effect was kind of dose-related.Conclusion:QD has a protective effect on ALI induced by LPS in rats,its mechanism is related to inhibit TLR4/NF-kB p65 signaling pathway,decrease IL-1β/TNF-α levels and increase IL-10 level.
acute lung injury; Toll-like receptor 4; nuclear factor-κB; cytokines
R363
A
10.3969/j.issn.2095-9400.2015.05.004
2014-09-11
国家自然科学基金资助项目(81273678);浙江省自然科学基金资助项目(LQ12H29003)。
洪辉华(1982-),男,浙江苍南人,主治医师,博士。

