银杏叶提取物对高糖环境中心肌细胞凋亡及Drp-1、Mfn-2表达的影响及其可能机制
李剑敏,吴玲,张迪,郑靖宇,戴爽,袁风菊,吴欢,彭天庆
(温州医科大学附属第一医院 病理科,浙江 温州 325015)
·论 著·
银杏叶提取物对高糖环境中心肌细胞凋亡及Drp-1、Mfn-2表达的影响及其可能机制
李剑敏,吴玲,张迪,郑靖宇,戴爽,袁风菊,吴欢,彭天庆
(温州医科大学附属第一医院 病理科,浙江 温州 325015)
目的:探讨银杏叶提取物(EGB)对高糖环境中新生大鼠心肌细胞凋亡和线粒体凋亡途径中线粒体分裂蛋白1(Drp-1)、融合蛋白2(Mfn-2)、Bax、Bcl-2和Caspase-3表达的影响。方法:体外分离SD乳鼠心肌细胞,分别用低糖(LG组)、低糖+EGB(LG+EGB组)、高糖(HG组)和高糖+EGB(HG+EGB组)培养基培养心肌细胞。分别用流式细胞仪检测心肌细胞的凋亡率,用Western blot和/或RT-PCR分别检测心肌细胞Drp-1、Mfn-2、Bax、Bcl-2和Caspase-3的表达。结果:与LG组相比,HG组心肌细胞凋亡率、Drp-1、Bax、Caspase-3表达和Bax/Bcl-2比值均显著升高,差异均具有统计学意义(P<0.05),而Bcl-2、Mfn-2表达均降低,差异均具有统计学意义(P<0.05);与HG组相比,HG+EGB组心肌细胞凋亡率、Drp-1表达、Bax、Caspase-3、Bax/Bcl-2比值均显著降低,差异均具有统计学意义(P<0.05),而Bcl-2表达升高,差异具有统计学意义(P<0.05),但Mfn-2的表达差异无统计学意义(P>0.05)。结论:EGB通过上调高糖环境中心肌细胞Bcl-2的表达,同时下调Drp-1、Bax和Caspase-3的表达,从而减少心肌细胞的凋亡。这可能是EGB防治糖尿病心肌病的机制之一。
糖尿病;银杏叶提取物;心肌细胞;线粒体;凋亡
银杏叶提取物(extract gingko biloba,EGB)主要成分是黄酮类和萜类内酯化合物,其中黄酮类甙已被证实是一类抗氧化剂。近年来,研究发现糖尿病心肌细胞通过脂质代谢、葡萄糖自身氧化等多种途径在线粒体内产生更多的活性氧(reactive oxygen species,ROS)[1],并证实是调控凋亡的关键因素,引起线粒体途径的凋亡[2]。新近的大量研究显示,线粒体分裂/融合蛋白(Drp-1/Mfn-2)不仅控制线粒体的形态和功能,还参与细胞线粒体途径的凋亡过程[3]。那么,在糖尿病高糖环境中心肌细胞线粒体的分裂/融合是否参与心肌细胞的凋亡,目前文献报道甚少。本研究为排除EGB在机体内药物代谢各个环节对糖尿病机体的影响,通过体外分离、培养新生SD大鼠左心室心肌细胞,用高糖培养基模拟I型糖尿病的机体环境,并用EGB干预,观察高糖环境中心肌细胞线粒体凋亡途径相关基因的表达,以期阐明EGB对糖尿病心肌病的保护机制。
1 材料和方法
1.1 主要实验试剂和药物 EGB(北京双鹤高科天然药物有限公司,批号为100718);FITC-Annexin V/ PI细胞凋亡试剂盒(北京宝赛生物技术有限公司);DMEM培养基、D-Hanks液、胎牛血清(GIBCO公司);Western blot化学发光免疫印迹法细胞凋亡相关蛋白I抗、Ⅱ抗(碧云天生物技术研究所);RT-PCR引物合成(上海生工生物工程有限公司);Trizol(Invitrogen life technologies);化学发光试剂盒(Biological Industries);MUVB-20凝胶成像分析系统(美国Ultralum公司);UV-754型紫外分光光度计(上海第三分析仪器厂);Image-Pro Plus 6.0图像分析软件(Media Cybernetics公司);流式细胞仪(FACScan型美国BD公司)。
1.2 心肌细胞的分离和培养 取SPF级健康SD出生1~2 d的乳鼠10只,用75%乙醇消毒皮肤,开胸取心脏,用无菌纱布吸干血液并剪取左心室,用预冷的50 mL D-Hanks液冲洗1次,用眼科剪碎心脏组织,再用50 mL D-Hanks液冲洗3次;去冲洗液后加0.0225 mg/mL Liberase TH的D-Hanks液3 mL,置37 ℃水浴,10 min,期间每2~3 min吹打3~5次;静置1~2 min后收集上清液到15 mL离心管,4 ℃离心(200 g 5 min);去上清液后,加入含10%胎牛血清和1%双抗的低糖DMEM(含5.5 mmol葡萄糖)培养液3 mL,悬起心肌细胞以终止消化。同上述的方法再分离心肌组织1次,共收集心肌细胞悬液6 mL。将6 mL心肌细胞悬液移至60 mm的培养皿,置37 ℃ 5% CO2培养箱,90 min后,去掉大块的杂质和贴壁的成纤维细胞,将心肌细胞转移至15 mL的离心管,悬匀并调节心肌细胞密度,以5×105/mL的细胞密度直接接种到用1%明胶处理过的12孔培养板。继续置入37 ℃ 5% CO2培养箱培养心肌细胞,24 h后更换培养液(含10%胎牛血清和1%双抗的低糖DMEM培养液),24 h后待细胞搏动良好后,开始分组实验。
1.3 实验分组 流式细胞凋亡率检测实验设低糖组(LG组)、低糖组+EGB组(LG+EGB组)、高糖组(HG组)和高糖+EGB组(HG+EGB组),每组3孔。其他实验则仅设LG组、HG组和HG+EGB组,每组4孔。LG组和HG组分别用1%双抗+10%胎牛血清+低糖DMEM(含5.5 mmol葡萄糖)和1%双抗+10%胎牛血清+高糖DMEM培养液(含25 mmol葡萄糖),LG+EGB组和HG+EGB组则分别用1%双抗+10%胎牛血清+低糖DMEM培养液+EGB和1%双抗+10%胎牛血清+高糖DMEM培养液+EGB。EGB终末浓度为100 μg/mL。置37 ℃ 5% CO2培养箱培养24 h。
1.4 方法
1.4.1 细胞凋亡率检测:用0.125%胰酶消化,预冷的PBS洗3次,Binding Buffer重悬细胞,200目筛网过筛,调整细胞浓度为1×106个/mL,检测前30 min加入FITC-Annexin V,低温避光孵育,检测前5 min加入PI。用流式细胞仪检测细胞凋亡率。
1.4.2 Western blot法检测心肌细胞Bax、Bcl-2和Caspase-3的蛋白表达:根据上述1.3实验分组,收获各组心肌细胞。用蛋白裂解液充分裂解心肌细胞,置4 ℃离心(14 000 r/min,10 min),取上清液。用BCA蛋白浓度测定试剂盒测定其蛋白含量。样品加热变性后加样,电泳分离蛋白,转膜,用5%脱脂牛奶封闭,TBS-T洗膜,I抗结合,4 ℃过夜,Ⅱ抗室温轻摇1 h后,再洗膜后加化学发光液,胶片感光成像。用计算机分析软件进行分析,以目的蛋白与内参蛋白条带累积吸光度(A)比作为反映目的蛋白表达水平的相对指标。所用I抗浓度:Bcl-2 1∶250,Bax 1∶400,Caspase-3 1∶600;Ⅱ抗浓度:1∶5 000。
1.4.3 RT-PCR技术检测Bax、Bcl-2、Caspase-3、Drp-1和Mfn-2的mRNA的表达:如上述收获心肌细胞,按Trizol试剂说明书方法提取心肌细胞总RNA。取1 μg进行RT-PCR反应。Bcl-2上游引物5’-CTGGTGG ACAACATCGCTCTG-3’,下游引物5’-GGTCTGCTGACCTC ACTTGTG-3’,产物228 bp;Bax上游引物5’-GCGA ATTGGAGATGAACTGG-3’,下游引物5’-GTGAGCGAGGC GGTGAGGAC-3’,产物366 bp;Caspase-3上游引物5’-GAAGCGAATCAATGGACTCTG-3’,下游引物5’-GCACAA AGCGACTGGATGAA-3’,产物595 bp;Drp-1上游引物5’-CGTAGTGGGAACTCAGAGCA-3’,下游引物5’-TGGA CCAGCTGCAGAATAAG-3’,产物120 bp;Mfn-2上游引物5’-CTCAGGAGCGGGTTTATTGTCT-3’,下游引物5’-TGTCGAGGGACCAGCATGTCTATCT-3’,产物412 bp;β-actin(内参1)上游引物5’-CATCTCTTGCTCGAAG TCCA-3’,下游引物5’-ATCATGTTTGAGACCTTCAACA-3’,产物318 bp;β-actin(内参2)上游引物5’-GATGG TGGGTATGGGTCAGAA-3’,下游引物5’-GGCCATCTCTTG CTCGAAGTC-3’,产物630 bp;PCR变性、退火和延伸温度分别为94 ℃、55 ℃和72 ℃,反应时间分别为30 s、30 s和60 s,共进行38个循环。循环完毕再72 ℃延伸10 min,4 ℃ 60 min。PCR产物用1.5%琼脂凝胶电泳分析。电泳后在紫外灯下拍摄照片,然后用MUVB-20凝胶成像分析系统对每一标本的PCR产物扩增的特异性片段进行灰度扫描,以β-actin密度作为参考定量标准,数值以两者之积分吸光度的比值表示。
1.5 统计学处理方法 用SPSS17.0统计软件进行统计分析。计量资料以±s表示。多组比较用单因素方差分析,均数间的两两比较用q检验,所有统计检验均采用双侧检验。P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞仪检测细胞凋亡率 LG组与LG+EGB组均有少量细胞凋亡,2组比较差异无统计学意义(P>0.05);HG组分别与LG组和LG+EGB组比较,细胞凋亡明显增多,差异有统计学意义(P<0.01);HG+EGB组较HG组细胞凋亡减少,差异有统计学意义(P<0.01)。提示高糖可诱导心肌细胞凋亡,EGB干预则减少高糖诱导的心肌细胞凋亡,见表1、图1。
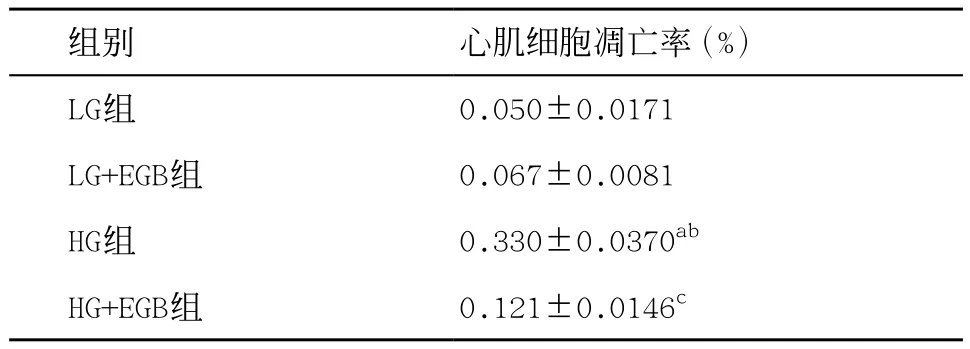
表1 EGB对高糖环境中心肌细胞凋亡的影响(n=3,±s)

图1 流式细胞检测结果
2.2 EGB对高糖环境中心肌细胞Bax、Bcl-2和Caspase-3蛋白表达的影响 与LG组相比,HG组心肌细胞Bax、Caspase-3蛋白的表达、Bax/Bcl-2比值均明显升高,差异有统计学意义(P<0.01或P<0.05),而Bcl-2表达明显降低,差异有统计学意义(P<0.01);与HG组相比,HG+EGB组心肌细胞Bax、Caspase-3蛋白的表达、Bax/Bcl-2比值均明显降低,差异有统计学意义(P<0.01或P<0.05),而Bcl-2明显升高,差异有统计学意义(P<0.01),见图2。

图2 Western blot法测定结果(n=3,±s)
2.3 EGB对高糖环境中心肌细胞Bax、Bcl-2、Caspase-3、Drp-1和Mfn-2 mRNA表达的影响 与LG组相比,HG组心肌细胞的Bax mRNA、Caspase-3 mRNA、Drp-1 mRNA的表达以及Bax/Bcl-2比值均明显升高(P<0.01或P<0.05),而Bcl-2 mRNA、Mfn-2 mRNA的表达明显降低,差异有统计学意义(P<0.01);与HG组相比,HG+EGB组心肌细胞的Bcl-2 mRNA的表达明显升高,而Bax mRNA、Caspase-3 mRNA、Drp-1 mRNA的表达以及Bax/Bcl-2比值均明显降低,差异有统计学意义(P<0.01或P<0.05),而Mfn-2的mRNA表达却没有明显的升高(P>0.05),见图3-4。

图3 各组心肌细胞Bax、Bcl-2和Caspase-3 mRNA的RT-PCR分析结果(n=3,±s)

图4 各组心肌细胞Drp-1和Mnf-2 mRNA的RT-PCR分析结果(n=3,±s)
3 讨论
本研究在体外分离培养乳鼠心肌细胞,用高糖培养基培养心肌细胞以模拟1型糖尿病模型,发现HG组心肌细胞的凋亡率明显高于HG+EGB组,提示EGB能通过减少心肌细胞的凋亡保护高糖环境中的心肌细胞。目前,线粒体凋亡通路的激活被认为在糖尿病心肌细胞凋亡的过程中起着主开关作用,而且是细胞凋亡的主要执行者,其机制涉及一系列的基因调控。Bcl-2家族是目前公认的通过线粒体信号通路来早期调控凋亡的重要基因。该家族包括抗凋亡的Bcl-2、Bcl-XL和促凋亡的Bax成员。Bcl-2基因表达的蛋白位于线粒体外膜上,而Bax基因表达的蛋白则散布于胞质中。在ROS等各种凋亡信号刺激下,Bax从细胞质迁移到线粒体外膜上,形成Bax/Bcl-2同源二聚体,Bcl-2可使Bax蛋白失活,但Bax表达过多则促进凋亡的发生,而Bcl-2表达增加则可减少或抑制细胞的凋亡。因此,在凋亡早期,Bax/Bcl-2的比值升高与否是决定细胞线粒体凋亡信号转导下行的重要因素[4]。本实验高糖模拟1型糖尿病模型,发现心肌细胞的Bax表达增加,Bcl-2的表达降低,从而Bax/Bcl-2的比值升高,则促进心肌细胞线粒体途径的早期凋亡信号转导下行;而EGB通过减少心肌细胞Bax的表达,增加Bcl-2的表达,降低Bax/Bcl-2的比值,提示EGB可抑制心肌细胞线粒体途径的早期凋亡信号转导下行。
近几年来,研究发现Drp-1/Mfn-2同样属于凋亡早期改变的蛋白,而且位于Bax的下游[3,5]。Drp-1是一个与发动蛋白相关的蛋白,在哺乳动物细胞中,Drp-1是线粒体分裂相关的主要蛋白之一。该蛋白在正常的细胞内大部分分布于胞浆中,少部分聚合在线粒体即将分裂的外膜上。与分裂蛋白相反,Mfn-2主要分布在线粒体外膜上,是与线粒体融合有关的主要蛋白之一。虽然在细胞凋亡的过程中Bax与Drp-1和Mfn-2均共定位于线粒体即将分裂的部位[5-6],但Lee等[5]进一步的研究发现Drp-1作用位于Bax转位的下游,即抑制Drp-1的表达可抑制细胞凋亡,并不影响Bax从细胞浆到线粒体外膜的转位;反之,增加Drp-1的表达则可促进线粒体的分裂增加,导致心肌细胞凋亡的发生,而抑制Mfn-2则增加细胞对凋亡信号的敏感性,甚至导致自发性的细胞凋亡[7]。另外,Yu等[8]用高糖培养不同动物的心肌细胞,发现心肌细胞ROS活性增高,线粒体分裂蛋白Drp-1过表达导致线粒体分裂增加,细胞凋亡发生。本实验观测高糖环境中心肌细胞的Drp-1和Mfn-2的基因表达,发现高糖环境中心肌细胞Drp-1的基因呈高表达,而Mfn-2的基因呈低表达。EGB可减少高糖环境中心肌细胞的Drp-1的基因表达,但并没有增加Mfn-2的基因表达。提示高糖环境中心肌细胞凋亡与心肌细胞的线粒体分裂和融合蛋白的基因表达的改变有关。EGB保护心肌细胞可能是通过调节线粒体分裂表达,上调Drp-1/Mfn-2比值有关。
事实上,Brooks等[9]进一步研究发现在细胞应激状态下,线粒体的分裂蛋白表达增加,线粒体融合蛋白表达减少,Drp-1/Mfn-2比值增加致使细胞线粒体形态结构和功能改变,尤其是线粒体通透性转运孔(mPTP)高水平开放,线粒体内Cyt-c、凋亡诱导因子等一系列凋亡效应蛋白释放到细胞浆内,引发Caspase的级联反应。目前,众多的研究者认为:Caspase的级联反应是各种凋亡途径的主要共同下游通路,其中Caspase-3被认为是细胞凋亡的过程中的终末剪切酶,一旦Caspase-3被激活,细胞凋亡则难以避免,Caspase-3表达越高,凋亡发生概率越高[10]。因此,Caspase-3的表达增加是检测细胞凋亡发生的重要指标。本实验发现高糖环境中心肌细胞Caspase-3表达明显增加,EGB干预后,心肌细胞Caspase-3的表达明显降低,提示高糖可促使心肌细胞的凋亡,EGB可有效减少心肌细胞的凋亡。这结果与本课题的心肌细胞凋亡的检测结果相符合。
因此,笔者推测:高糖环境中心肌细胞中Bax从胞浆转位至线粒体外膜,Bcl-2虽然可使Bax蛋白失活,但Bax过度表达,Bcl-2低表达,使Bax/Bcl-2的比值升高,促使早期凋亡信息转导下行。同时,线粒体分裂蛋白Drp-1表达增加,Mfn-2表达降低,进而线粒体外膜上Drp-1/Mfn-2比值增高,则改变线粒体的形态和结构,致使凋亡效应蛋白释放到细胞浆内,激活凋亡转导的共同通路即Caspase通路的级联反应,最终导致凋亡的发生[6]。EGB通过抑制Bax/Bcl-2-Drp-1/Mfn-2-Caspase-3线粒体凋亡途径的信号转导,从而保护高糖对心肌细胞的损伤。这可能是EGB对防治糖尿病心肌病的机制之一。
[1] Wang J, Wang H, Hao P, et al. Inhibition of aldehyde dehydrogenase 2 by oxidative stress is associated with cardiac dysfunction in diabetic rats[J]. Mol Med, 2011, 17(3-4): 172-179.
[2] 门秀丽, 张丽萍, 吴静, 等. 线粒体形态与细胞凋亡的关系[J]. 生理科学进展, 2012, 43(5): 356-360.
[3] Tanaka A, Youlde RJ. A chemical inhibitor of DRP1 uncouples mitochondrial fission and apoptosis[J]. Mol Cell, 2008, 29(4): 409-410.
[4] Cory S, Adams JM. The Bcl2 family: regulators of the cellular life-or-death switch[J]. Nat Rev Cancer, 2002, 2(9): 647-656.
[5] Lee YJ, Jeong SY, Karbowski M, et al. Roles of the mammalian mitochondrial fission and fusion mediators Fis1, Drp1, and Opa1 in apoptosis[J]. Mol Biol Cell, 2004, 15 (11): 5001-5011.
[6] Karbowski M, Lee YJ, Gaume B, et al. Spatial and temporal association of Bax with mitochondrial fission sites, Drp1, and Mfn2 during apoptosis[J]. J Cell Biol, 2002, 159(6): 931-938.
[7] Sugioka R, Shimizu S, Tsujimoto Y. Fzo1, a protein involved in mitochondrial fusion, inhibits apoptosis[J]. J Biol Chem, 2004, 279(50): 52726-52734.
[8] Yu T, Sheu SS, Robotham JL, et al. Mitochondrial fission mediates high glucose-induced cell death through elevated production of reactive oxygen species[J]. Cardiorasc Res, 2008, 79(2): 341-351.
[9] Brooks C, Cho SG, Wang CY, et al. Fragmented mitochondria are sensitized to Bax insertion and activation during apoptosis[J]. Am J Physiol Cell Physiol, 2011, 300(3): C447-455.
[10] Robertson JD, Orrenius S, Zhivotovsky B. Review: nuclear events in apoptosis[J]. J Struct Biol, 2000, 129(2-3): 346-358.
(本文编辑:吴健敏)
Effects of extract of Ginkgo biloba on apoptosis and the expression of Drp-1, Mfn-2 in myocardial cells induced by high glucose and its underlying mechanism
LI Jianmin, WU Ling, ZHANG Di, ZHENG Jingyu,DAI Shuang, YUAN Fengju, WU Huan, PENG Tianqing. Department of Pathology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective: To investigate the effects of Ginkgo biloba on apoptosis and the expression of Drp-1, Mfn-2, Bax, Bcl-2 and Caspase-3 in mitochondrial apoptotic pathway in neonatal rat myocardial cells induced by high glucose and underlying mechanism. Methods: Left ventricule myocardial cells of neonatal SD rats were isolated and cultured with low-glucose culture media (LG group), low-glucose culture media added EGB (LG + EGB group), high-glucose culture media (HG group) and high-glucose culture media added EGB (HG+EGB group) in vitro respectively. The ratio of apoptosis of myocardial cells was analyzed by flow cytometry. The expression of Drp-1, Mfn-2, Bax, Bcl-2 and Caspase-3 were detected with western blot and/or RT-PCR respectively. Results: Compared to the LG group, the rate of apoptosis, the expression of Drp-1 and Bax, Caspase-3 and the ratio of Bax/Bcl-2 in ventricule myocardial cells were increased in HG group significantly (P<0.05), while the expression of Mfn-2 and Bcl-2 were decreased significantly (P<0.05). Compared to HG group, the rate of apoptosis, the expression of Drp-1 and Bax, Caspase-3 and the ratio of Bax/Bcl-2 in HG+EGB group were decreased significantly (P<0.05), while the expression of Bcl-2 was increased significantly (P<0.05). But the expression of Mfn-2 had no significant difference (P>0.05). Conclusion: EGB plays an important role in attenuation cardiomyocyte apoptosis induced by high glucose via its upregulation the expression of Bcl-2 and down regulation of Drp-1 and Bax, Caspase-3 and the ratio of Bax/Bcl-2. It may be one of the underlying mechanisms for EGB to treat diabetic cardiomyopathy.
diabetes mellitus; extract of Ginkgo biloba; cardiomyocyte; mitochondria; apoptosis
R587.1
A
10.3969/j.issn.2095-9400.2015.06.002
2015-02-15
国家自然科学基金资助项目(81170204);浙江省自然科学基金资助项目(Y14H020038)。
李剑敏(1967-),男,浙江乐清人,教授。
彭天庆,教授,Email:wzpengtq@163.com。

