食品中柠檬酸快速检测试剂盒的研制
常平平,郝艳红,周遵武,万宇平*,刘 薇,钱 瑞,沈国栋
(1.北京勤邦生物技术有限公司,北京102206;2.山东春雪食品有限公司,山东莱阳265200)
食品中柠檬酸快速检测试剂盒的研制
常平平1,郝艳红1,周遵武2,万宇平1*,刘 薇1,钱 瑞1,沈国栋1
(1.北京勤邦生物技术有限公司,北京102206;2.山东春雪食品有限公司,山东莱阳265200)
建立了一种酶法检测食品中柠檬酸含量的快速检测方法。将6 U L-苹果酸脱氢酶、9.13 U L-乳酸脱氢酶、0.5 mg烟酰胺腺嘌呤二核苷酸、2 mg硫酸镁、3.783 mg海藻糖、5 mg聚乙二醇6000在0.2 mL 0.082 g/m L双甘肽质量浓度下-60℃冷冻5 h,室温条件下抽真空18 h得到试剂Ⅰ,0.468 U柠檬酸裂解酶在0.2 m L水体系冷冻干燥得到试剂Ⅱ。结果表明,该方法标准曲线线性关系良好,相关系数R2=0.995,线性范围1~80 μg/L;灵敏度0.25 mg/L;检测限0.5 mg/L;各样品回收率均在90%~110%。该试剂盒方法可以在20 m in实现样品中柠檬酸的快速检测,方法灵敏度高、特异性高、快速简便,适合于食品生产企业对食品中的柠檬酸进行快速检测及对食品的质量和品质进行评价。
食品;柠檬酸;快速检测试剂盒;烟酰胺腺嘌呤二核苷酸
在食品生产过程中往往需要添加防腐剂、甜味剂、抗氧化剂、保鲜剂、人工合成色素等化学物质,它们的含量过高会对人体健康造成不利影响[1]。柠檬酸是有机酸中的第一大酸,由于其物理性能、化学性能、衍生物的性能,被广泛应用于一些食品加工领域。柠檬酸的含量对食品的味道有很大影响,并且是某些食品品质的一项重要检测指标,因此食品中柠檬酸的定性与定量分析对食品营养的研究意义重大,而且在食品生产过程的质量管理中也必不可少。目前,测定柠檬酸的方法有高效液相色谱法[2]、反相高效液相色谱法[3]、离子色谱法[4]、气相色谱法[5]、毛细管电泳法[6-7]、微分电位溶出法[8]、阻抑动力学法[8]等。高效液相色谱法灵敏度较高,但是样品前处理操作繁琐,测定周期长、实验成本高。离子色谱法由于淋洗液和柱填料的特殊性,对样品中蛋白质含量有严格限定,不适合做复杂的样品分析,而且柱子的容量小,进样量不宜太多。因此,对于含有复杂成分的食品,不适合用此方法检测柠檬酸的含量。气相色谱法由于不宜挥发或热不稳定的酸类在进样之前往往需要进行衍生化反应,导致样品的前处理比较困难且费时,成为气相色谱检测有机酸的瓶颈所在。毛细管电泳在灵敏度和重现性方面存在不足。酶法测定果汁中柠檬酸含量具有灵敏度高、专一性强、快速简便的优点,酶法测定食品中柠檬酸的原理是:柠檬酸在酶的作用下裂解,其裂解产物通过还原型辅酶Ⅰ,即烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)被还原,然后通过测定吸光度值的降低来测量NADH的消耗量,即相当于柠檬酸的量。该方法不仅适用于果汁产品,还可以用于其他多种食品中柠檬酸含量的测定[10-11]。本实验采用酶法测定果汁、茶饮料、水果、奶酪、啤酒、食用油等食品中柠檬酸的含量,并将NADH、L-苹果酸脱氢酶(malate dehydrogenase,L-MDH)、L-乳酸脱2氢酶(L-lactic dehydrogenase,L-LDH)及相应的冻干保护剂冻干作为试剂Ⅰ,将柠檬酸裂解酶(citrate lyase,CL)及相应的保护剂冻干作为试剂Ⅱ进行试验。冻干是复杂的相变过程,冻干制品在整个过程存在的各种应力,包括低温应力、冻结应力、干燥应力等,常常是直接或间接导致制品中蛋白质变性的因素,所以在冻干过程中需使用保护剂。冻干保护剂一般可分为多羟基化合物、糖、氨基酸、蛋白质、聚合物和无机盐等[12],不仅要具有保护制品生物学活性的效果,而且要具有冻干赋形作用[13],保护剂可改变生物样品冷冻干燥时的物理、化学环境,减轻或防止冷冻干燥或复水对细胞的损害,尽可能保持原有的各种生理生化特性和生物活性[14-15]。本实验建立了一种食品中柠檬酸的快速检测方法,该方法对样品的前处理简单,灵敏度高、特异性高、检测时间短,适合于食品生产企业对食品中的柠檬酸进行检测及对食品的质量和品质进行评价。
1 材料与方法
1.1 材料与试剂
纯果乐、茉莉蜜茶、红茶、绿茶、橘子、橙子、固体奶酪、青岛啤酒、鲁花花生油均购自超市。柠檬酸脱氢酶(C0897-100 UN)、L-苹果酸脱氢酶(M 1567-5 kU)、L-乳酸脱氢酶(L-2625-2.5 kU)、烟酰胺腺嘌呤二核苷酸(N2630-50 mg)、双甘肽(G1002-25 g)、谷胱甘肽(G2299-100 g)、半胱氨酸(纯度97%):美国Sigma公司;柠檬酸、七水硫酸镁、海藻糖、聚乙二醇2000、聚乙二醇6000、碳酸氢钠、氢氧化钠、氢氧化钾、盐酸、咪唑、三羟甲基氨基甲烷、甘油、乙二胺四乙酸二钠、L-酒石酸、甘露醇、硫酸铵、三氯乙酸和β-巯基乙醇均为国产分析纯。
1.2 仪器与设备
UVmini-1240紫外分光光度计:岛津企业管理(中国)有限公司;QL-901涡旋仪:海门市其林贝尔仪器制造有限公司;LGJ-18A冷冻干燥机:北京四环科学仪器厂有限公司;XP205分析天平:梅特勒-托利多国际股份有限公司;SpS2001F电子天平:龙腾电子有限公司;PHS-3E pH计:上海仪电科学仪器股份有限公司。
1.3 试验方法
1.3.1 冻干方式
各试剂单独冻干保护剂的筛选:分类别进行冻干保护剂筛选,多羟基化合物(甘露醇、酒石酸)、糖类(蔗糖、海藻糖、葡萄糖)、氨基酸(谷胱甘肽、半胱氨酸)、聚合物(聚乙二醇2000、聚乙二醇6000),调整保护剂的浓度对NADH、L-MDH、L-LDH、CL分别进行冻干。冻干前均进行可行性验证,所加保护剂不影响实验结果的条件下进行冻干实验,冻干取出后即进行吸光度值测定,并进行保存性跟踪。
试剂混合冻干保护剂及冻干体系的筛选:将NADH和L-LDH混合、NADH、L-MDH和L-LDH混合进行冻干,筛选冻干保护剂及冻干体系。
1.3.2 标准曲线制作
在5个10 m L的容量瓶中,分别准确的加入0.40 m g/m L柠檬酸标准溶液0、0.10 m L、0.20 m L、0.50 m L、1.00 m L,用蒸馏水定容至刻度,混匀放置10 min。分别取各标准溶液0.20 m L,加入1.80 m L纯水,1 m L用水复溶的试剂Ⅰ,同时做一组空白实验,即取2.00 m L纯水、1 m L用水复溶的试剂Ⅰ,混匀后静置10m in,在波长340 nm处测定吸光度值A1,加入用0.02 m L水复溶的试剂Ⅱ,混匀后静置10 min,测定吸光度值A2。
1.3.3 样品的前处理
针对不同的样品进行不同的处理,具体样品前处理方法见表1。

表1 样品前处理方法Table 1 Pretreatment methods of samples
1.3.4 各类样品中柠檬酸回收率的测定
在合适的稀释倍数下对样品进行测定,在该稀释倍数下对样品进行0.5倍、1.0倍、2.0倍柠檬酸标准溶液质量浓度的添加,测定并计算回收率。
2 结果与分析
2.1 L-MDH、L-LDH、NADH单独及混合冻干保护剂的筛选
将试剂Ⅰ中NADH、L-MDH、L-LDH单独分别在200 μL保护剂甘露醇、酒石酸、蔗糖、海藻糖、葡萄糖、谷胱甘肽、半胱氨酸、聚乙二醇2000、聚乙二醇6000等不同物质下进行冻干,冻干前后对同一浓度柠檬酸标准溶液进行测定,测定吸光度差值ΔA[ΔA=(A2-A1)标准-(A2-A1)空白]无明显差异,且随着保存时间延长,吸光度差值变化不大,则冻干保护剂效果良好;冻干后粉剂无明显气泡,规则易于复溶解则冻干保护剂效果良好;冻干后保存时间越长,冻干保护剂效果越优。
单独冻干保护剂筛选结果见表2,混合冻干保护剂筛选结果见表3。

表2 单独冻干保护剂种类、冻干后形态、冻干后保存性Table 2 Species of single cryoprotectant working reagents, lyophilized forms and preserving qualities
由表2可知,各浓度海藻糖、0.164 g/m L及0.082 g/m L双甘肽、硫酸镁、聚乙二醇6000作为保护剂的各试剂在冻干取出后形态较为规则,且保存时间相对较长,在保存中吸光度差值降低较缓慢,试剂Ⅱ(CL)在200 μL水体系下无需冻干保护剂冻干后在4℃保存3个月测定吸光度差值及形态均良好。
由表3可知,3.783 mg海藻糖+2 mg硫酸镁+5 mg PEG6000+0.082 g/m L双甘肽200 μL作为保护剂冻干NADH、MDH、L-LDH混合剂后保存性良好。该体系冻干后在4℃保存3个月测定无明显差异。由于NADH见光遇热氧化,冻干后的试剂需要避光低温保存,且冻干程度及后期的密封性均会影响试剂保存性。

表3 试剂混合冻干保护剂种类筛选、冻干后形态、冻干后保存性Table 3 Species screening of cryoprotectant mixture reagents, lyophilized forms and preserving qualities
2.2 柠檬酸标准曲线的绘制
以吸光度差值ΔA(y)为纵坐标[ΔA=(A2-A1)标准-(A2-A1)空白],柠檬酸含量(x)为横坐标,绘制标准曲线见图1。
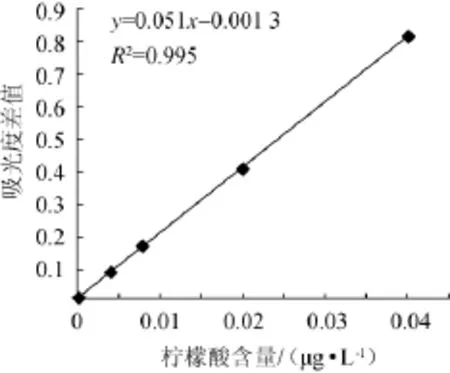
图1 柠檬酸标准曲线Fig.1 Standard curve of citric acid
由图1可知,标准曲线线性回归方程为y=0.051x-0.001 3,相关系数R2=0.995,表明二者在1~80 μg/L内线性相关。分光光度计在波长340 nm条件下测定的柠檬酸质量浓度(灵敏度)为0.25 mg/L,检测限为0.5 mg/L。
2.3 样品中柠檬酸回收率实验
对不同样本进行回收率测定时,加入柠檬酸标准品后的体积均为0.4 m L,样品中回收率实验结果见表4。

表4 加标样品中柠檬酸的回收率Table 4 Recovery rates of citric acid sam ples

续表
由表4可知,各样品回收率均在90%~110%,表明该方法准确度较好。
3 结论
将NADH、L-MDH、L-LDH及硫酸镁、海藻糖、聚乙二醇6000、双甘肽等冻干保护剂混合冻干作为试剂Ⅰ,将水体系的CL冻干作为试剂Ⅱ。利用标准曲线可推算出样品中柠檬酸含量。该方法的检测线性范围为1~80 μg/L,灵敏度为0.25 mg/L,检测限为0.5 mg/L,测定的各样品回收率均在90%~110%;试剂盒方法可以在20 m in实现样品中柠檬酸的快速检测,适合样品的批量检测。
[1]贾淑贞,李发生.实用食品添加剂手册[M].郑州:河南科学技术出版社,1996.
[2]王剑飞,闵良,张家寿,等.高效液相色谱法测定葡萄酒中的柠檬酸[J].中国酿造,2010,29(2):164-165.
[3]莫海涛,杜玉兰,黎庆涛,等.反相高效液相色谱法测定发酵饮料中有机酸和维生素C的含量[J].食品工业科技,2007,28(2):230-232.
[4]闫巍,焦霞,叶明立,等.离子色谱法测定威力酸中的有机酸[J].分析试验室,2008,27(2):38-40.
[5]杜曦,周锡兰,余录,等.葡萄及葡萄酒中有机酸测定的衍生化气相色谱法[J].酿酒,2008,35(3):82-84.
[6]王迪,张强,韩东.用毛细管电泳测定发酵液中柠檬酸的含量[J].分析与测试,2000,29(6):33-36.
[7]杜家菊,赵建飞.食品中柠檬酸检测方法的研究进展[J].山东理工大学学报,2009,23(5):98-103.
[8]蔡艳,高烨,王晓菊.食品中柠檬酸的阻抑动力学光度法检测[J].长春师范学院学报,2013,32(3):50-53.
[9]冯素玲,刘雪平,常伟华,等.阻抑动力学荧光法测定柠檬酸[J].分析试验室,2003,22(2):73-75.
[10]樊惠民,余实,谭远方.食品中柠檬酸的检测[J].食品安全质量检测学报,2011,2(4):205-208.
[11]丁辰.酶法检测果汁中柠檬酸的含量[J].中国果菜,2006(3):55.
[12]刘占杰,华泽钊.蛋白质药品冷冻干燥过程中变性机理的研究进展[J].中国生化药物杂志,2000,21(5):263-265.
[13]孙东坡,胡一桥.蛋白质冷冻干燥制品中保护剂及其保护机理[J].药学进展,2003,27(4):201-205.
[14]张一折,滕洪刚,吕帅然,等.重组HIV-1腺病毒载体活疫苗的冻干保护剂研究[J].中国生物制品学杂志,2007,20(2):104-106.
[15]蒲丽丽,刘宁,张英华,等.乳酸菌冻干保护剂及保护机理的研究进展[J].现代食品科技,2004,21(1):147-153.
Development of rapid detection kit for citric acid in food
CHANG Pingping1,HAO Yanhong1,ZHOU Zunwu2,WAN Yuping1*,LIU Wei1,QIAN Rui1,SHEN Guodong1
(1.Beijing K winbon Biotechnology Co.,Ltd.,Beijing 102206,China;2.Shandong Spring Snow Food Co.,Ltd.,Laiyang 265200,China)
s:A rapid enzymatic detection method was developed for determination of citric acid in food.Reagent I was made by L-malate dehydrogenase 6 U,L-lactate dehydrogenase 9.13 U,nicotinamide adenine dinucleotide 0.5 mg,MgSO42 mg,trehalose 3.783 mg,PEG 6000 5 mg with 0.082 g/m l Gly-Gly 0.2 m l after freezing 5 h at-60℃,and then vacuumized for 18 h at room temperature.Reagent II was made by citrate lyase 0.468 U in 0.2 m l water system by freeze drying.Results showed the correlation coefficient of standard curve was 0.995,linearity range was 1-80 μg/L,the sensitivity of method was 0.25 mg/L,the limit of detection of method was 0.5 mg/L,and the recovery rate was 90%-110%.By this method,the citrate in the sample can be rapidly detected within 20 m in.The method was simple and fast with high sensitivity and specificity,which was suitable for rapid detection of citric acid in food and evaluation of food quality.
food;citric acid;rapid detection kit;nicotinamide adenine dinucleotide
TS207.3
A
0254-5071(2015)03-0111-04
10.11882/j.issn.0254-5071.2015.03.026
2015-01-07
科技新星计划(Z141105001814116)
常平平(1984-),女,工程师,硕士,研究方向为食品分析与检测。
*通讯作者:万宇平(1982-),男,工程师,硕士,研究方向为食品安全检测技术研究。

