海藻酸钠-阿拉伯胶固定化糖化酶及其性质的研究
王 冕,王如福,焦玉双
(山西农业大学食品科学与工程学院,山西太谷030801)
海藻酸钠-阿拉伯胶固定化糖化酶及其性质的研究
王 冕,王如福*,焦玉双
(山西农业大学食品科学与工程学院,山西太谷030801)
以海藻酸钠(SA)与阿拉伯胶(GA)为载体固定化糖化酶,以酶活回收率为评价指标,在单因素试验基础上,通过响应面法优化固定化条件,得到固定化糖化酶最佳工艺条件为SA-GA质量比2.7∶1,氯化钙质量浓度6.2 g/100 m L,固化时间0.8 h,此条件下固定化糖化酶酶活回收率为67.91%。通过对固定化酶酶学性质的研究得出:经固定化的糖化酶最适反应pH值与最适作用温度均与游离酶相同,pH值为4.6,温度45℃,热稳定性及操作稳定性均优于游离酶。
糖化酶;固定化酶;海藻酸钠;阿拉伯胶
糖化酶全称葡萄糖淀粉酶(glucoamylase EC.3.2.1.3.),是由微生物分泌的具有外切酶活性的胞外酶,广泛应用于酒类和食醋的酿造等食品工业中[1-4]。海藻酸钠(sodium alginate,SA)具有温和无毒、廉价易得等优点,是当前使用最为广泛的固定化载体材料[5-7]。阿拉伯胶(gum arabic,GA)是目前最为廉价且应用广泛的亲水胶体之一,具有一定的营养学及医学价值[8],近年来受到国内外专家学者的关注,也是我国食品工业中应用最为广泛的胶体之一[9]。目前,有较多关于使用GA制备凝聚微胶囊的研究。董志俭等[10]使用羧甲基纤维素(carboxyl methyl cellulose,CMC)、GA、明胶为材料制作复合凝聚橘油微胶囊,得出CMC/GA/明胶复合凝聚橘油微胶囊具有较高的产率的结论。而将GA应用于固定化载体材料的研究鲜有报道。商品化GA主要有乳化性较强的A.sengeal型和乳化性较弱的A.seyal型两种[11-12],前者价格上相对昂贵,而传统制备微胶囊通常使用前者。本试验研究发现由于GA的低浓度高黏度的特点,所制备出的固定化酶具有较好的机械强度。
本试验使用SA-GA复合制备固定化酶载体吸附糖化酶,研究复合凝胶质量浓度、凝胶比例、氯化钙质量浓度、固化时间、酶量、吸附时间等因素对SA-GA复合胶体固定化糖化酶工艺条件的影响,通过响应面法优化固定化条件,并对固定化酶酶学性质进行研究比较,为固定化糖化酶的实际应用提供理论参考。
1 材料与方法
1.1 材料与试剂
食品级糖化酶(100 000 U/g):江苏锐阳生物科技有限公司;食品级海藻酸钠:青岛迈潮海洋科技发展有限公司;食品级阿拉伯胶:艾纳提化工科技有限公司;其他试剂为国产分析纯。
1.2 仪器与设备
TGL-20M高速台式冷冻离心机:湘仪离心机仪器有限公司;PHSJ-3F型pH计:上海精密科学仪器有限公司;BS210S万分之一电子天平:北京赛多利斯仪器系统有限公司;HH-4型数显恒温水浴锅:常州国华电器有限公司;85-2型恒温磁力搅拌器:上海思乐仪器有限公司。
1.3 方法
1.3.1 固定化糖化酶的制备方法[13]
(1)以载体溶液总体积50 m L计,称取一定量的SA、GA胶体于低于60℃时蒸馏水中溶解,混合均匀,超声波快速消泡至复合凝胶中无气泡。
(2)使用10 m L医用注射器,以约1滴/s的速度将复合凝胶滴到氯化钙溶液中,在4℃冰箱中固化,用纱布滤出载体颗粒,并用pH 4.6的乙酸-乙酸钠缓冲液冲洗3~5次除去表面的氯化钙。
(3)用滤纸吸干表面水分,放入pH 4.6的酶液中进行吸附,后用纱布滤出固定化颗粒,用缓冲液清洗,并用滤纸吸干表面的水分,制成球状颗粒,即得固定化酶,0~4℃条件下保存备用。
1.3.2 糖化酶固定化条件的优化设计
(1)复合凝胶质量浓度对固定化酶活回收率的影响:设定复合凝胶质量浓度分别为2.0 g/100 m L、2.5 g/100 m L、3.0 g/100 m L、3.5 g/100 m L、4.0 g/100 m L、4.5 g/100 m L,按照方法1.3.1制备固定化酶,测定其酶活,下同。
(2)凝胶比例对固定化酶活回收率的影响:取最适复合凝胶质量浓度,设定SA-GA质量比分别为1∶1、2∶1、3∶1、4∶1,考察其对酶活回收率的影响。
(3)氯化钙质量浓度对固定化酶活回收率的影响:取各已测指标的最适条件,设定氯化钙质量浓度分别为5.0 g/100 m L、6.0 g/100 m L、7.0 g/100 m L、8.0 g/100 m L、9.0 g/100 m L,考察其对酶活回收率的影响。
(4)固化时间对固定化酶活回收率的影响:取各已测指标的最适条件,设定固化时间分别为0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,考察其对酶活回收率的影响。
(5)给酶量对固定化酶活回收率的影响:取各已测指标的最适条件,设定给酶量分别为1 100 U/g、1 320 U/g、1 540 U/g、1 760 U/g、1 980 U/g、2 200 U/g,考察其对酶活回收率的影响。
(6)吸附时间对固定化酶活回收率的影响:取各已测指标的最适条件,吸附时间设定分别为1.0 h、1.5 h、2.0 h、2.5 h、3.0 h,考察其对酶活回收率的影响。
1.3.3 响应面优化试验设计
结合单因素试验及分析,采用Design-Expert.V8.0.6软件进行数据处理,根据Box-Benhnken中心组合试验设计原理,在单因素试验基础上,选取SA-GA质量比、氯化钙质量浓度、固化时间3个因素为试验因素,以酶活回收率(Y)为响应值,进行3因素3水平的响应面分析试验。试验设计因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface methodology
1.3.4 糖化酶活力的测定
游离糖化酶活力的测定:参考GB 8276—2006《食品添加剂糖化酶制剂》中的测定方法。
固定化糖化酶活力的测定:取一定质量的固定化酶测定其酶活力,测定方法与游离糖化酶方法相同。
糖化酶活力定义:单位质量的糖化酶在温度为40℃,pH值4.6条件下,1 h水解可溶性淀粉产生1 μg葡萄糖为1个酶活力单位(U/g或U/m L)。
1.3.5 酶活回收率及相对酶活的计算
固定化酶所显示的活力占加入酶液中酶的总活力的百分数为固定化酶的活力回收率,其计算公式:

相对酶活是指以同组最高酶活为参照,用固定化酶活力计算出的比值,设定同组酶活力最高的相对酶活为100%,其计算公式:

1.3.6 固定化蛋白酶酶学性质的研究
(1)温度对固定化酶以及游离酶相对酶活的影响:取一定量的固定化酶及游离酶,以2%可溶性淀粉为底物,不同温度条件下,pH 4.6缓冲液中保温振荡反应10 m in,测定其酶活。
(2)pH值对固定化酶以及游离酶相对酶活的影响:取一定量的固定化酶及游离酶,以2%可溶性淀粉为底物,不同pH值缓冲液中,45℃保温振荡反应10 min,测定其酶活。
(3)固定化酶以及游离酶的热稳定性:取一定量的固定化酶及游离酶在无底物的条件下,pH 4.6的缓冲液中,在不同温度条件下加热处理30 m in后,迅速冷却。45℃条件下,测定其酶活。
(4)固定化酶的操作稳定性:取一定量固定化酶,以2%可溶性淀粉为底物,在最适条件下连续进行几个批次的操作,每批次操作完成后测定固定化酶酶活力。
2 结果与分析
2.1 载体选择及固定化条件对固定化糖化酶活力的影响
2.1.1 复合凝胶质量浓度对糖化酶固定化效果的影响
复合凝胶质量浓度对固定化酶活回收率的影响结果见图1。由图1可知,随着复合凝胶质量浓度的增加固定化酶酶活回收率增加,当复合凝胶质量浓度达到3.5 g/100 m L时酶活回收率达到最大,之后随着凝胶质量浓度的增加酶活回收率开始降低,这是由于当凝胶质量浓度过大时载体表面孔隙紧密,不利于酶的吸附。因此,最适复合凝胶质量浓度为3.5 g/100 m L。

图1 复合凝胶质量浓度对固定化酶活回收率的影响Fig.1 Effects of compound gel concentration on the recovery rate of immobilized enzyme activity
2.1.2 SA-GA质量比对糖化酶固定化效果的影响
SA-GA质量比对固定化酶活回收率的影响见图2。由图2可知,随着SA-GA质量比的增加酶活回收率呈现先增加后减小的趋势,在质量比为3∶1时酶活回收率达到最大,GA所占比例较低是因其本身具有低浓度高黏度的特性,同时GA与SA混合也可产生协同作用,使黏度倍增。因此,最适SA-GA质量比为3∶1。
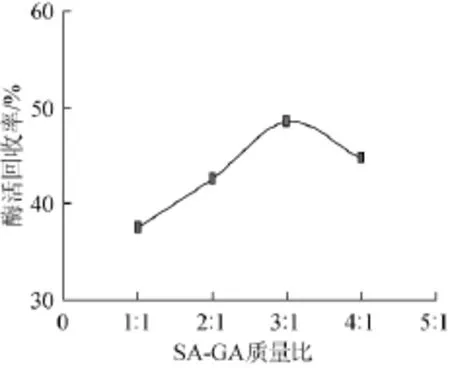
图2 SA-GA质量比对固定化酶活回收率的影响Fig.2 Effects of the SA-GA mass ratio on the recovery rate of immobilized enzyme activity
2.1.3 氯化钙质量浓度对糖化酶固定化效果的影响
氯化钙质量浓度对固定化酶活回收率的影响结果见图3。由图3可知,在氯化钙质量浓度为7.0 g/100 m L时酶活回收率达到最大,这是因为SA与氯化钙作用强弱是由于离子强度所决定,同时离子浓度会影响GA的分子结构,从而影响其效果。因此,随着离子强度的增强,作用越明显;而当强度过大时,酶活力会由于离子强度过大的影响而降低。因此,最适氯化钙质量浓度为7.0 g/100 m L。

图3 氯化钙质量浓度对固定化酶活回收率的影响Fig.3 Effects of calcium chloride concentrations on the recovery rate of immobilized enzyme activity
2.1.4 固化时间对糖化酶固定化效果的影响
固化时间对固定化酶活回收率的影响见图4。SA与氯化钙形成凝胶是由Ca2+通过SA载体微球从外向内置换Na+形成海藻酸钙,置换需要时间,但时间过长会造成高分子链结构太致密而使孔径过小。由图4可知,酶活回收率随固化时间的增加先升高后降低,最适固化时间为1.0 h。

图4 固化时间对固定化酶活回收率的影响Fig.4 Effects of immobilization time on the recovery rate of immobilized enzyme activity
2.1.5 给酶量对糖化酶固定化效果的影响
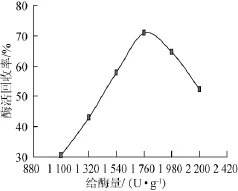
图5 给酶量对固定化酶活回收率的影响Fig.5 Effects of enzyme addition on the recovery rate of immobilized enzyme activity
给酶量对固定化酶活回收率的影响见图5。由图5可知,随着给酶量的增加,酶活回收率呈先增加后减小的趋势,这是由于一定质量的载体可吸附的酶量有限,当载体的吸附酶量达到饱和后继续增加给酶量会造成载体表面孔径被多余酶覆盖现象,从而影响固定化酶活力。因此,最适给酶量为1 760 U/g。
2.1.6 吸附时间对糖化酶固定化效果的影响
吸附时间对固定化酶活回收率的影响结果见图6。由图6可知,在吸附时间为2.0 h时,固定化酶酶活回收率达到最大值。酶吸附到载体上需要一定时间,时间过短不利于酶与载体的充分接触,当吸附达到平衡后,随着时间的增加,吸附量不会再有所上升。故选择吸附时间为2.0 h。

图6 吸附时间对固定化酶活回收率的影响Fig.6 Effects of absorption time on the recovery rate of immobilized enzyme activity
2.2 响应面优化试验
2.2.1 模型建立及显著性检验
固定化酶活回收率响应面法分析结果见表2,方差分析见表3。

表2 固定化酶响应面分析方案及结果Table 2 Design and results of response surface methodology for immobilized enzyme activity optimization
以SA-GA质量比、氯化钙质量浓度及固化时间作为响应因素,糖化酶酶活回收率为响应值Y。采用Design-Expert.V 8.0.6软件,对固定化糖化酶酶活回收率试验数据进行多元回归拟合,得出回归方程Y=14.419 59+2.870 70A+ 13.95469B+15.17371C+2.86533AB-0.85960AC+4.87894BC-3.654 19A2-2.082 20B2-25.520 77C2。

表3 响应面试验方差分析Table 3 Variance analysis of response surface methodology
由表3可知,该模型中P<0.000 1,因此方程显著,方程中B、C、AB、BC、A2、B2、C2均达到显著水平(P<0.000 1),只有A和AC未达到显著水平(P>0.0001)。说明各个具体试验因素对响应值的影响不是简单的线性关系。相关系数R为0.982 0,即响应值变化有98.20%来源于所选试验因素。方程失拟项不显著说明拟合度好。因此,回归方程可以较好地描述各因素与响应值之间的真实关系,用此方程模拟试验因素与响应值之间的关系是可行的。
2.2.2 响应面因素交互作用及优化结果
图7为凝胶比例、氯化钙质量浓度、固化时间交互作用对酶活回收率影响的响应面及等高线。等高线的形状反映因素交互效应的强弱大小,椭圆形表示两因素交互作用显著性,曲面的斜体度确定两者对响应值的影响程度[14-15]。由回归方程以及方差分析可知,AB、BC交互作用对结果影响显著,AC交互作用对结果影响不显著。
通过对回归方程求极值得到固定化糖化酶的最佳固定条件为:凝胶质量比2.72∶1,氯化钙质量浓度6.19 g/100 m L,固化时间0.84 h,此时的固定化酶预测理论酶活回收率为68.12%。采用所得条件进行验证试验,考虑到实际操作的可行性,将条件设定为凝胶质量比2.7∶1,氯化钙质量浓度6.2 g/100 m L,固化时间0.8 h。在此条件下固定化糖化酶酶活回收率为67.91%,与理论预测值相似。

图7 SA-GA质量比、氯化钙质量浓度、固化时间交互作用对酶活回收率影响的响应面图Fig.7 Response surface plots of effects of interaction between SA-GA ratio,CaCl2concentration and immobilization time on recovery rate of enzyme activity
2.3 固定化酶酶学性质的研究
2.3.1 固定化糖化酶的最适作用温度

图8 温度对游离酶和固定化酶相对酶活的影响Fig.8 Effects of temperature on relative enzyme activity of free enzyme and immobilized enzyme
由图8可知,随着温度升高,固定化酶和游离酶相对酶活先呈现上升趋势,最适作用温度均为45℃,之后随着温度的升高,酶蛋白逐渐变性从而导致酶活力降低。当温度为45℃时,固定化酶酶活力高于游离酶,之后随着温度的升高,固定化酶酶活变化幅度小于游离酶。
2.3.2 固定化糖化酶的最适反应pH值
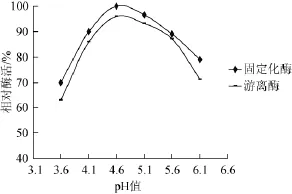
图9 pH值对游离酶和固定化酶相对酶活的影响Fig.9 Effects of pH value on relative enzyme activity of free and immobilized enzymes
由图9可知,固定化酶和游离酶的最适反应pH值均为4.6,且在相同pH值的情况下固定化酶的相对酶活均高于游离酶,证明经过固定化的糖化酶的最适反应pH值不变且稳定性有所提高。
2.3.3 固定化糖化酶的热稳定性

图10 游离酶和固定化酶的热稳定性Fig.10 The thermal stability of free and immobilized enzymes
由图10可知,随着温度的升高,固定化酶和游离酶的酶活力均有所下降,且随着温度的升高固定化酶相对酶活高于游离酶的趋势越明显,证明固定化酶的热稳定性要高于游离酶,在温度为55℃时固定化酶相对活力仍能保持在80%左右,相对酶活高于游离酶约12个百分点。
2.3.4 固定化糖化酶的操作稳定性

图11 固定化酶操作稳定性Fig.11 Operational stability o f immobilized enzymes
由图11可知,随着反应批次的增加,固定化酶酶活力有所降低,固定化糖化酶在反应4次后酶活力为原活力的50%,证明固定化酶可进行重复使用,一般最多可反复操作4次,具有一定的操作稳定性。
3 结论
本试验以SA-GA复合凝胶为载体制备固定化糖化酶的最佳工艺条件为:复合凝胶质量浓度3.5 g/100 m L,SA-GA质量比2.7∶1,氯化钙质量浓度6.2 g/100 m L,固化时间0.8 h,给酶量1 760 U/g,吸附时间2.0 h,此时固定化糖化酶酶活回收率为67.91%。
通过对固定化糖化酶与游离酶酶学性质的研究得出:固定化酶和游离酶的最适反应pH值均为4.6,最适作用温度为45℃,固定化酶的热稳定性明显优于游离酶,固定化糖化酶在反应4次后酶活力为原活力的50%,证明固定化酶可进行重复使用,具有一定的操作稳定性。表明经过固定化处理的糖化酶酶学性质优于游离酶,具有一定的应用价值。
[1]孙金旭.糖化酶用量对酱香型白酒杂油醇的影响研究[J].现代食品科技,2013,29(1):73-76.
[2]陈雄.固定化糖化酶的研究[J].中国酿造,2001,20(2):21-22.
[3]王家东,贾淑丽,王荣荣,等.固定化糖化酶-酵母菌连续发酵生高粱粉酿酒的研究[J].食品工业,2014,35(8):160-163.
[4]侯红萍,闫跃文,马玲.响应面分析法优化糖化酶与酵母菌共固定化条件[J].中国酿造,2010,29(3):116-118.
[5]DE GROOT A R,NEUFELD R J.Encapsulation of urease in alginate beads and protection from α-chymotrypsin with chitosan membranes[J].Enzyme Microb Tech,2001,29(6-7):321-327.
[6]雷生姣,潘思轶.交联海藻酸钠固定化柚(皮)苷酶[J].食品工业科技,2014(1):232-236.
[7]CHEIRSILP B,JEAMJOUNKHAW P,H-KITTIKUN A.Optimizing an alginate immobilized lipase for monoacylglycerol production by the glycerolysis reaction[J].J Mol Catal B-Enzym,2009,59(1-3):206-211.
[8]ALFTREN J,PENARRIETA J M,BERGENSTAHL B,et al.Comparison of molecular and emulsifying properties of gum arabic and mesquite gum using asymmetrical flow field-flow fractionation[J].Food Hydrocolloid,2012,26(1):54-62.
[9]胡国华.阿拉伯胶在食品工业中的应用[J].粮油食品科技,2003,11(2):7-8.
[10]董志俭,赵帅,孙丽平,等.CMC/阿拉伯胶/明胶复合凝聚橘油微胶囊的制备方法[J].中国食品学报,2013,13(6):69-76.
[11]PHILIPS G O,W ILLIAMS P A.Handbook of hydrocolloids[M].New York:CRC Press,2000.
[12]PHILIPS G O,OGASAWARA T,USHIDA K.The regulatory and scientific approach to defining gum arabic(acacia senegal and acacia seyal) as a dietary fibre[J].Food Hydrocolloid,2008,22(1):24-35.
[13]NAGANAGOUDA K.Gelatin blends with alginate:gel fibers forαgalactosidase immobilization and its app lication in reduction of non-digestible oligosaeeharides[J].Process Biochem,2005,41(8):1903-1907.
[14]梁静波,杨伟,宋震宇,等.响应面法优化固态发酵餐厨垃圾及醋糟生产蛋白饲料[J].中国酿造,2014,33(12):98-101.
[15]贺翠,王燕芳,马超,等.响应面法优化超生辅助提取昆仑雪菊原花青素的工艺研究[J].中国酿造,2013,32(8):107-111.
《中国酿造》杂志广告征订启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技月刊(国内统一刊号CN 11-1818/TS,国际标准刊号ISSN 0254-5071,广告许可证号:京宣工商广字第0033号)。全国各地邮局均可订阅,邮发代号:2-124;国外总发行:中国国际图书贸易总公司,国外发行代号:BM 1437。《中国酿造》历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊,中国科学评价研究中心(RCCSE)数据库收录期刊,中国科学引文数据库(CSCD)遴选数据库收录期刊,也是学位与研究生教育的中文重要期刊。
《中国酿造》重点报道调味品、酿酒、食品微生物、食品添加剂、发酵乳制品、生物工程技术、生物化工、生物质能源的开发利用等研究方向的新工艺、新技术、新设备、分析检测、安全法律法规及标准、保鲜与贮运技术、综合利用、质量保障体系等方面的基础理论、应用研究及综述文章。设有“研究报告”、“专论综述”、“创新借鉴”、“经验交流”、“分析检测”、“产品开发”、“酿造文化”、“海外文摘”等栏目。
《中国酿造》发行历史长、范围广、行业知名度高,广告影响面大,效果甚佳,而且价格合理,是一个理想的宣传媒体。欢迎新老广告客户来函、来电、来人联系办理广告业务,我们将提供一切方便,竭诚为您服务。
《中国酿造》是您企业品牌推广、品质提升、技术交流、产品推介的最佳平台。
邮箱:zgnzzz@163.com网站:www.chinabrewing.net.cn电话:010-83152738/83152308
《中国酿造》杂志社
Immobilized glucoamylase with sodium alginate and gum arabic and its properties
WANG Mian,WANG Rufu*,JIAO Yushuang
(College of Food Science and engineering,Shanxi Agricultural University,Taigu 030801,China)
Using sodium alginate(SA)and gum arabic(GA)as the carrier to prepare immobilized glucoamylase,on the basis of single factor experiment,using enzyme activity recovery rate as evaluation indexes,the optimal conditions for glucoamylase immobilization were optimized by response surface methodology.The optimal conditions were SA-GA mass ratio 2.7∶1,calcium chloride concentration 6.2 g/100 m l,and immobilization time 0.8 h.Under these conditions,the immobilized enzyme activity recovery rate was up to 67.91%.The enzymatic properties of the immobilized enzyme were studied,and the results showed that the optimum reaction pH and temperature of immobilized enzyme was the same as the free enzyme of pH 4.6,temperature 45℃,and both the thermal stability and operational stability of the immobilized enzyme were better than the free enzyme.
glucoamylase;immobilized enzyme;sodium alginate;gum arabic
Q814
A
0254-5071(2015)03-0024-06
10.11882/j.issn.0254-5071.2015.03.006
2015-01-16
“十二五”农村领域国家科技计划(2011AA10090401);山西省科技攻关项目(20110311042-3;20130311030-2)
王冕(1990-),女,硕士研究生,研究方向为发酵食品工艺、果蔬采后生理及贮运技术。
*通讯作者:王如福(1960-),男,教授,博士,研究方向为发酵食品工艺、果蔬采后生理及贮运技术。

