豆瓣中产磷脂酶菌株的筛选及系统发育分析
董 丹,蒋 丽,关统伟,车振明,曾 雷
(西华大学生物工程学院,西华大学微生物研究所,食品生物技术四川省高校重点实验室,四川成都610039)
豆瓣中产磷脂酶菌株的筛选及系统发育分析
董 丹,蒋 丽,关统伟,车振明*,曾 雷
(西华大学生物工程学院,西华大学微生物研究所,食品生物技术四川省高校重点实验室,四川成都610039)
以一级郫县豆瓣为原料筛选磷脂酶高产菌株,通过磷脂平板初筛和摇瓶复筛法,以磷脂酶水解圈作为筛选模型,并对产酶菌株进行了酶活力的检测及细菌16S rRNA系统发育分析。结果表明,从一级豆瓣中筛选出10株产磷脂酶菌株,其中产酶活力最高的为编号LZ8,酶活力为68.32 U/m L,经鉴定该菌株为Bacillus sonorensis,属于芽孢杆菌属,其与最高同源性菌株相似性为100%。
磷脂酶;系统发育分析;酶活力;芽孢杆菌属
磷脂酶(phospholipase,PL)是生物体内负责磷脂的代谢和生物合成的一类酶,能催化甘油磷脂的各种水解反应,根据磷脂酶水解磷脂位置的不同可分为5类:磷脂酶A1、A2、B、C、D,按其生物功能可归纳为3类:细胞膜结构的维护和修复;细胞内代谢机制和信号传导的调节;体内磷脂的消化[1]。磷脂酶不仅在生物体内具有很重要的生理功能,而且广泛应用于油脂精炼、磷脂改性、饲料添加剂和医药等方面[2]。最初的磷脂酶A1、A2和磷脂酶D等均是从蛇毒、动物的胰脏中提取,来源有限[3],满足不了市场需要。微生物种类繁多,生长周期短,易于分离和诱变,可工业化大规模培养,因此微生物磷脂酶的研究发现为其应用提供了方便的来源。迄今已有十多种产磷脂酶A的细菌得到了广泛的研究[4-6]。特别是微生物来源的磷脂酶A可以采用发酵的方法大规模生产后,对磷脂酶A1应用于植物油脱胶的研究也越来越深入[7-9]。目前,油脂加工业中采用酸炼脱胶、超级脱胶等连续式国窖工艺可将油脂中含磷量脱除到15 mg/kg以下[10],而食用油中的磷脂残留在5 mg/kg以下最理想[11],酶法已经越来越受到关注。因此获得高酶活的磷脂酶产生菌有着广阔的应用前景。然而,国内尚无商业化磷脂酶的生产,目前所使用的磷脂酶多来自进口[12]。本实验从郫县豆瓣样品中筛选磷脂酶高产菌株,这对于研究磷脂酶对豆瓣风味物质的形成所起的作用,以及未来以此改善豆瓣品质,完善豆瓣生产工艺,有着十分重要的意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
一级郫县豆瓣:四川郫县恒丰和食品有限公司,样品取回置于4℃冰箱保存,备用。
1.1.2 试剂
核酸染料(Goldview)、三羧甲基氨基甲烷(Tris碱)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、TE缓冲溶液(Tris-EDTA buffer):上海生工生物工程有限公司;蛋白胨、甘油、无水乙醇、异戊醇、磷酸氢二钾、氯化钠、硫酸镁、大豆磷脂、聚乙烯醇(polyvinyl alcohol,PVA):成都市科龙剂化工厂;Ex Taq DNA聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP):大连Takara公司;PCR产物胶回收试剂盒(离心柱):捷瑞生物工程(上海)有限公司;LecitaseRUltra:Novozyme公司。
1.1.3 培养基
富集培养基:酵母膏0.2 g,氯化钠0.5 g,磷酸氢二钠3.5 g,磷酸二氢钾1.5 g,硫酸镁0.05 g,橄榄油5 m L,调节pH至7.0,用蒸馏水定容至1 000 m L,121℃灭菌20 m in。
磷脂筛选培养基:大豆磷脂10 g,磷酸氢二钾1.0 g,氯化钠0.5 g,硫酸镁0.5 g,琼脂15.0 g,调节pH到达7.0,用蒸馏水定容至1 000 m L,121℃灭菌20 min。
摇瓶发酵培养基:蔗糖0.5 g,蛋白胨2 g,磷酸氢二钾0.2 g,磷酸二氢钾1 g,大豆磷脂1.0 g,调节pH至7.0,用蒸馏水定容至100 m L,121℃灭菌20 m in。
1.2 仪器与设备
LDZX-75KB型立式压力蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-2F型双人双面净化工作台:苏州净化有限公司;DHG-9075A型电热恒温鼓风干燥箱;DHP-9052型电热恒温培养箱:上海益恒实验仪器有限公司;TB-214型电子天平:北京赛多利斯仪器系统有限公司;PHS-3C型酸度计:方舟科技有限公司;9700型PCR扩增仪;美国应用生物系统公司。
1.3 试验方法
1.3.1 平板初筛
取采集到的一级郫县豆瓣样品10 g,用100 m L生理盐水稀释10倍,漩涡振荡混匀,取混合后的悬液5 m L加至50 m L富集培养基中,37℃、180 r/min摇床培养,2 d后取1 m L菌液用无菌水稀释,稀释梯度为10-1、10-2、10-3,取3个梯度的菌悬液分别涂布于以大豆磷脂为单一碳源的筛选平板上,置于37℃和28℃培养48 h,形成单菌落,挑选出透明圈明显的菌落,测定其水解圈半径大小,斜面编号保存。
1.3.2 摇瓶复筛
挑取能在初筛培养基上生长并能产生水解圈的菌落进行纯化分离,纯化后再接入LB培养基中培养,待长出菌落,以1%的接种量接入摇瓶发酵培养基中,30℃、180 r/min培养3 d后,发酵液在4℃条件下10 000 r/m in离心10 m in,取上清液作为粗酶液,通过测定磷脂酶活力,筛选出产磷脂酶能力较强的菌株。
1.3.3 磷脂酶活力的测定
磷脂酶活力的测定采用氢氧化钠滴定法[13],略有改动。酶活力定义为:在30℃和pH值为7.0条件下,每分钟水解磷脂产生1 μmoL游离脂肪酸所需要的酶量即为1个磷脂酶活力单位(U)。LecitaseRUltra为液体酶制剂,其磷脂酶活力表示为每1 m L酶液所得的磷脂酶活力单位,即U/m L。

式中:X为样品的酶活力,U/m L;V为滴定样品时消耗的NaOH标准溶液体积,mL;V0为滴定空白时消耗的NaOH标准溶液体积,m L;c为NaOH标准溶液的物质的量,mol/L;50为0.05 mol/L NaOH标准溶液1.00 mL相当于脂肪酸50 μmol;n为酶液样品的稀释倍数;t为测定酶活时的反应时间,m in。
操作步骤如下:一定量的底物无油磷脂、0.5%PVA溶于预定pH值的缓冲液中,用高速均质机在10 000 r/min的条件下均质3 min,得到底物溶液。取4个100 m L高型烧杯,2个作为空白瓶,2个作为样品瓶,各加底物溶液25 m L,再于空白瓶中加入体积分数95%的乙醇15 m L,于预定温度的水浴中预热5 m in,然后在各瓶中加入LecitaseRUltra酶液预定稀释倍数的稀释液1 m L(用缓冲液稀释),立即混匀计时,在预定温度的水浴中180 r/min的条件下振荡反应一定时间,于样品瓶中立即补加体积分数95%的乙醇15 m L终止反应,取出,于自动滴定仪下用NaOH标准溶液滴定,计算标准碱液平均消耗量。
NaOH标准溶液(0.05mol/L)的配制:按GB601《化学试剂标准滴定溶液的制备》配制和标定c(NaOH)=0.5 mol/L的标准溶液,使用时,准确稀释10倍。
缓冲液的配制:0.2 mol/L磷酸氢二钠溶液与0.1 mol/L柠檬酸溶液按不同比例配制,并在酶活测定的温度下进行微调以获得所需pH值的缓冲液。
大豆浓缩磷脂的处理:为获得无油的大豆浓缩磷脂,将购得的大豆磷脂进行3次以上的丙酮脱油处理,真空脱溶后获得无油大豆磷脂。
1.3.4 16S rRNA鉴定
菌株液体培养12h,DNA的提取采用改良十六烷基三甲基溴化铵(cetyl trimethyl ammonium bromide,CTAB)[14-15]法。得到的样品总DNA于-20℃保存。以提取得到的DNA为模板,细菌选择通用引物Eμ27F(5'-AGAGTTTGATCCTGGCTCAG-3');1490R(5'-GGTTACCTTGTTACGACTT-3')。反应条件:95℃、4 min;95℃、60 s,56℃、60 s,72℃、120 s,35个循环;72℃、10 min。真菌选择引物ITS4(5'-CCTCCGCTTATTGATATGC-3');ITS5(5'-GAAGTAAAAGTCGTAACAAGG-3')。反应条件:95℃、4 m in;94℃、30 s,53℃、30 s,72℃、40 s,35个循环;72℃、7 min。PCR反应体系为50 μL:10×Buffer 5 μL、dNTP 4 μL、Taq酶0.5 μL、上下游引物各1 μL、ddH2O 37.5 μL、DNA模板1 μL。PCR产物用1.4%琼脂糖凝胶电泳检测,电泳时间40 min。纯化过程按照DNA胶回收试剂盒中的步骤进行,具体步骤参照OMEGA公司E.Z.N.A.TM Gel Extraction Kit试剂盒说明。PCR产物纯化后送往生工生物工程(上海)股份有限公司测序,测序结果提交美国国家生物技术信息中心(national center of bioteehnology information,NCBI)(http://www. ncbi.nlm.nih.gov/)进行Blast进行序列分析。
2 结果与分析
2.1 菌株初筛结果
以大豆磷脂为唯一碳源进行产磷脂酶微生物的筛选,筛选平板上的水解圈大小与磷脂酶活力呈正相关,经初步筛选从一级豆瓣样品中分离得到10株磷脂酶生产菌株,测量其水解圈直径与菌落直径的比值(R),结果见表1。

表1 初筛菌株透明圈直径与菌株直径的比值Table 1 Ratios of transparent circle diameters to colony diameters of new ly screened strains
由表1可知,从一级豆瓣中分离得到10株磷脂酶产生菌株,其中有3株R值<1.5,3株介于1.5~2.0,而R值>2.0的有4株,分别为LZ1、LZ2、LZ8、LZ9。将这4株菌株进一步采用摇瓶发酵复筛,比较各菌株的产酶能力。
2.2 菌株复筛结果
将初筛的到的4株产磷脂酶活力较高菌株进行摇瓶发酵,经过4轮复筛过后,检测其酶活力的大小,检测结果如表2所示。

表2 菌株复筛酶活力情况Table 2 Strain rescreening results of enzyme activity
由表2可以看出,比较4株磷脂酶产生菌,菌株LZ8酶活力最高,为68.32U/m L。因此LZ8可作为后续研究使用菌株。
2.3 生理生化检测
菌株LZ8在平板上生长良好,表面光滑、略微凸起、淡黄色、呈黏稠状,显微镜下观察呈杆状。生理生化特性如表3所示。
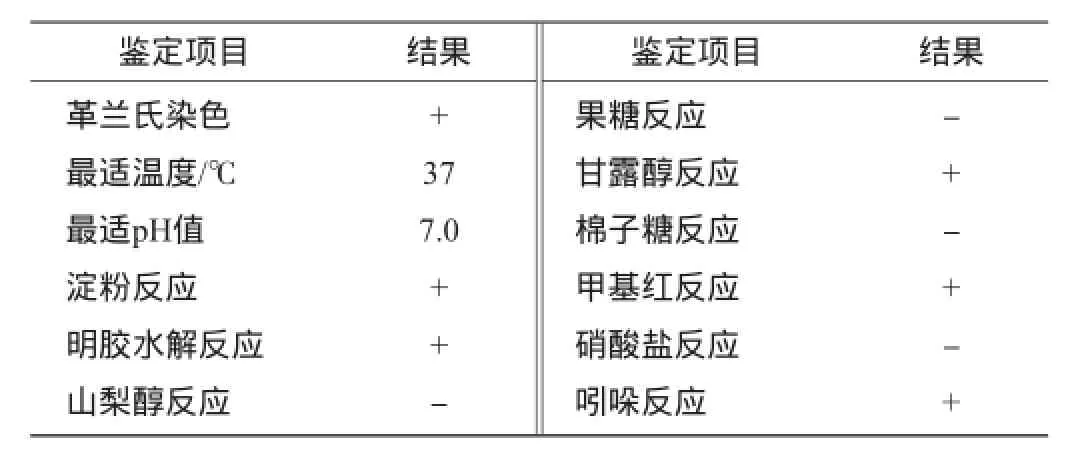
表3 菌株LZ8的生理生化特性Table 3 Physiological and biochemical characteristics of strain LZ8
2.4 菌株鉴定结果
对初筛得到的10株产磷脂酶的菌株进行16S rRNA分子鉴定,采用通用引物进行PCR扩增后,获得约1 500 bp的片断,将测序得到的序列提交至Genbank,通过BLAST与NCBI Genbank数据库中已报道序列进行同源性对比,对比结果如表4所示。构建系统发育树见图1。

表4 菌株鉴定结果Table 4 Results of strain identification
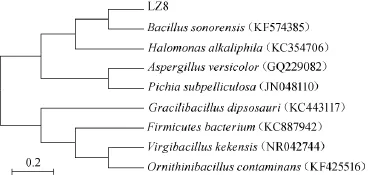
图1 LZ8的16S rRNA的系统发育树Fig.1 Phylogenetic tree of strain LZ8 based on 16S rRNA sequence analysis
从表4及图1的菌株鉴定结果可以看出,产磷脂酶的10株菌经鉴定,分属于4个属,即Bacillus、Virgibacillus、Aspergillus、Pichia,其中有7株属于芽孢杆菌属(Bacillus),1株属于毕赤酵母属(Pichia),而初筛结果中产酶活力最高的菌株LZ8属于芽孢杆菌属(Bacillus),与最高同源性相似菌株的相似度为100%。
3 结论
尽管磷脂酶已经得到了广泛的应用,但其在天然材料中的含量较低加上其理化性质存在的缺陷,导致其无法满足市场的需要,这一问题也限制了磷脂酶的应用前景。目前基因工程的发展为克服磷脂酶缺陷提供了解决方法,通过基因定点突变及定向进化有目的的改造磷脂酶基因,从而改善其稳定性和活性,对于提高磷脂酶产生菌酶活力及产量有很大的帮助,因此从分子水平对磷脂酶产生菌进行研究,将会为其工业化应用奠定良好的基础。本实验采用磷脂筛选平板初筛和摇瓶复筛,从一级郫县豆瓣中筛选得到一株产磷脂酶菌株LZ8酶活力最高。经菌株形态特征及生理生化特征,结合16S rRNA序列分析,鉴定其为Bacillus sonorensis。本研究中获得的产磷脂酶菌株LZ8,为进一步该菌株的育种及运用基因工程方法构建重组磷脂酶工程奠定良好的基础,进而实现磷脂酶的工业化生产,开阔磷脂酶的运用前景。
[1]VICTOR C,DIANA M,CARLOS T,et al.Phospholipases in food industry[J].Methods Mol Biol,2012,861:495-523.
[2]DE M L,VIND J,OXENBOLL K M,et al.Phospholipases and their industrial application[J].Appl Microbiol Biotech,2007,74(2):290-300.
[3]谷利伟,曹宪荣,赵金兰.磷脂酶法改性的研究进展[J].中国油脂,1999,24(6):60-62.
[4]RAKHIMOV M M.A new and rapid synthesis of phospholipid[J].Fiziol Rast,1989,36(3):502-504.
[5]JUNEJA L R,LEKH R.Conversion of phosphatidy1choline to phosphatidylserine by various phospholipase D in the presence of L-or D-serine biochim[J].Biophys Acta,1989,1003(3):277-283.
[6]WANG X G,QIU A Y,TAO W Y.Synthesis of phosphatidyl-glycerol from soybean lecithin with immobilized phospholipase D[J].J AOCS, 1997,74(2):87-88.
[7]李秋生,杨继国.植物油的磷脂酶酶法脱胶[J].中国油脂,2004,29(1):101-104.
[8]梁岐,王利,陶红.大豆磷脂酶水解技术研究[J].中国油脂,2003,28(7):58-60.
[9]丁乙.拟南芥花药不开裂基因(DAD1)编码一个新的磷脂酶A 1[J].植物学通报,2002,3(19):384-387.
[10]杨梅桂,周秀娟.非水化磷脂及其定量检测[J].中国卫生检验杂志,2008,18(1):71-154.
[11]NARAYANA T,KAIMAL B,VAIL S R,et al.Origin of problems encountered in rice bran oil peocessing[J].Eur J Lipid Sci Technol, 2002,104(4):203-211.
[12]YANG B O,ZHOU R,YANG J G,et al.Insight into the enzymatic degumming process of soybean oil[J].J Am Oil Chem Soc,2008,85 (5):421-425.
[13]李脉,杨继国,杨博.磷脂酶A酶活测定方法的研究[J].现代食品科技,2007,23(8):80-82.
[14]张搏.响应面法优化醋酸钙不动杆菌菌株23的脂肪酶产酶条件[J].广西科学,2008,15(4):419-423.
[15]HASAN F,SHAH A A,HAMEED A.Industrial applications of microbial lipase[J].Enzyme Microb Tech,2006,39(2):235-251.
《中国酿造》杂志广告征订启事
《中国酿造》创刊于1982年,是由中国商业联合会主管,中国调味品协会及北京食品科学研究院主办的综合性科技月刊(国内统一刊号CN 11-1818/TS,国际标准刊号ISSN 0254-5071,广告许可证号:京宣工商广字第0033号)。全国各地邮局均可订阅,邮发代号:2-124;国外总发行:中国国际图书贸易总公司,国外发行代号:BM 1437。《中国酿造》历次被评为全国中文核心期刊、中国科技核心期刊、《中国知网》重点收录期刊、《万方数据库》全文收录期刊、《中文科技期刊数据库》来源期刊、中国学术期刊网络出版总库收录期刊、美国《乌利希期刊指南》(UPD)收录期刊、英国《食品科学文摘》(FSTA)收录期刊、英国《国际农业与生物科学研究中心》(CABI)收录期刊、美国《化学文摘》(CA)收录期刊,中国科学评价研究中心(RCCSE)数据库收录期刊,中国科学引文数据库(CSCD)遴选数据库收录期刊,也是学位与研究生教育的中文重要期刊。
《中国酿造》重点报道调味品、酿酒、食品微生物、食品添加剂、发酵乳制品、生物工程技术、生物化工、生物质能源的开发利用等研究方向的新工艺、新技术、新设备、分析检测、安全法律法规及标准、保鲜与贮运技术、综合利用、质量保障体系等方面的基础理论、应用研究及综述文章。设有“研究报告”、“专论综述”、“创新借鉴”、“经验交流”、“分析检测”、“产品开发”、“酿造文化”、“海外文摘”等栏目。
《中国酿造》发行历史长、范围广、行业知名度高,广告影响面大,效果甚佳,而且价格合理,是一个理想的宣传媒体。欢迎新老广告客户来函、来电、来人联系办理广告业务,我们将提供一切方便,竭诚为您服务。
《中国酿造》是您企业品牌推广、品质提升、技术交流、产品推介的最佳平台。
邮箱:zgnzzz@163.com网站:www.chinabrewing.net.cn电话:010-83152738/83152308
《中国酿造》杂志社
Screening and phylogenetic analysis of phospholipase producing strains in fermented soybean paste
DONG Dan,JIANG Li,GUAN Tongwei,CHE Zhenming*,ZENG Lei
(Key Laboratory of Food Biotechnology in Colleges and Universities in Sichuan Province,Institute of Microbiology, College of Bioengineering,Xihuan University,Chengdu 610039,China)
In this experiment,the first class Pixian soybean paste was used to screen phospholipase-producing strain.The high phospholipase-producing strain was isolated by phospholipase screening plates and shakes flask affiliation,and identified through 16S rRNA sequence analysis.The results showed that ten phospholipase-producing strains were screened out from first class Pixian soybean paste,where the strain named LZ8 had the highest phospholipase-producing activity of 68.32 U/m l.The strain was identified as Bacillus sonorensis,of 100%homology with the highest homology strains.
phospholipase;phylogenetic analysis;enzyme activity;Bacillus
Q939.97
A
0254-5071(2015)03-0044-04
10.11882/j.issn.0254-5071.2015.03.010
2015-01-19
教育部春晖计划项目(No.13205639);食品生物技术四川省高校重点实验室(No.Szjj2013-045);四川省教育厅基金项目资助(No.13205688)
董丹(1989-),女,硕士研究生,研究方向为食品加工。
*通讯作者:车振明(1960-),男,教授,本科,研究方向为食品发酵技术。

