产四甲基吡嗪微生物菌株的选育
赵德义,汤丹丹,曹建全,王瑞明,刘 雪*
(1.山东景芝酒业股份有限公司,山东安丘262119;2.齐鲁工业大学山东省微生物工程重点实验室,山东济南250353)
产四甲基吡嗪微生物菌株的选育
赵德义1,汤丹丹2,曹建全1,王瑞明2,刘 雪1*
(1.山东景芝酒业股份有限公司,山东安丘262119;2.齐鲁工业大学山东省微生物工程重点实验室,山东济南250353)
从中温大曲中分离筛选了一株产四甲基吡嗪的菌株MJS183,以葡萄糖为主要碳源,37℃、200 r/min摇瓶培养120 h,四甲基吡嗪产量达11.42 g/L,并用气相色谱-质谱联用对发酵液成分进行分析。结果表明,代谢主产物为四甲基吡嗪。根据菌落形态特征、生理生化特性试验及16S rDNA序列分析,该菌株鉴定为枯草芽孢杆菌(Bacillus subtilis)。为获得纯度较高的四甲基吡嗪,对菌体和蛋白质去除率进行了研究。结果表明,添加0.8 g/L的壳聚糖,37℃、200 r/m in振荡30 min后静置,上清液经0.22 μm滤膜抽滤,滤液4℃自然结晶,提纯得到的晶体呈白色针状。联合使用气质联用色谱、傅里叶变换红外分光光度计对晶体进行定性分析,检测结果表明该晶体为四甲基吡嗪。
四甲基吡嗪;枯草芽孢杆菌;筛选鉴定;晶体分析
四甲基吡嗪(tetramethylpyrazine,TTMP)又称川芎嗪,属生物碱类,是一种含氮杂环化合物,天然存在于大豆食品、咖啡、乳制品中,具有坚果、烤面包、熟花生、榛子、可可豆的香味[1]。同时四甲基吡嗪也是酱香型、芝麻香型白酒的重要香气成分之一[2]。四甲基吡嗪不仅可以作为食品添加剂提升香气,而且作为中药川芎的活性成分在临床上也有重要的用途,现已作为一种新型钙离子拮抗剂广泛应用于心脑血管疾病、呼吸系统疾病、慢性肾功能衰竭疾病等的临床治疗[3]。
目前,四甲基吡嗪的生产主要是直接提取法、化学合成法。直接提取法是以伞形科植物川芎为原料,但四甲基吡嗪在川芎中的含量不足0.02%,且提取过程复杂[4],从而导致直接提取法成本高,无法适用于大规模工业化生产。化学合成法采用的底物不尽相同,如王向宇等[5]利用三苯基膦钯(Pd-PPh3)催化剂催化二乙酰一肟加氢反应合成四甲基吡嗪;邓泽庭等[6]以3-氨基丁酮为原料,经原料自身缩合,进一步氧化制得四甲基吡嗪。原料来源不足、工艺复杂、环境污染严重、反应条件剧烈、对设备要求高、产物非天然等问题严重制约了四甲基吡嗪的规模化生产。相比之下,生物发酵法因其原料来源丰富、产品绿色天然、成本低、反应条件温和、环境友好等诸多优势而使它成为关注的热点。1962年,KOSUGE T等[7]报道了枯草芽孢杆菌具有生物合成四甲基吡嗪的能力,此后微生物发酵法合成四甲基吡嗪的文献报道逐渐增多,产生菌主要是枯草芽孢杆菌。枯草芽孢杆菌是一种传统的酶制剂工业生产菌株,生长迅速、易于培养、不分泌内毒素,具有较好的生物安全性。本研究以曲样为材料,分离出高产四甲基吡嗪的芽孢杆菌,并以该菌的发酵液为原料,以蛋白去除率、菌体去除率为主要指标工艺,上清液经降温自然结晶、真空冷冻干燥,旨在获得纯度较高的四甲基吡嗪,得到的四甲基吡嗪晶体经气质联用(gas chromatography-mass spectrometer,GC-MS)与傅立叶红外光谱(Fourier transform infrared spectroscopy,FTIR)综合分析,纯度高于99.9%。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
中温大曲:山东景芝酒业股份有限公司。
1.1.2 主要试剂
四甲基吡嗪标样(纯度≥98.0%)、三羟基丁酮(纯度≥98.0%):中华试剂网;其他试剂均为国产分析纯。
1.1.3 培养基[8]
芽孢杆菌富集培养基:蛋白胨10g/L,酵母粉3 g/L,淀粉3 g/L,MgSO4·7H2O 0.1 g/L,KH2PO42 g/L,Na2HPO42 g/L,pH值为7.8,1×105Pa灭菌20 m in。
分离培养基:酵母粉5 g/L,蛋白胨10 g/L,NaCl 10 g/L,pH值为7.0,向该培养基中添加2%琼脂,1×105Pa灭菌20min,用于平板分离纯化。
VP培养基:葡萄糖5 g/L,蛋白胨5 g/L,磷酸氢二钾2 g/L,pH值为7.0,1×105Pa灭菌20 min。
种子培养基:同分离培养基。
基础发酵培养基:葡萄糖50 g/L,蛋白胨30 g/L,酵母粉10 g/L,磷酸氢二铵30 g/L,pH值为7.0,葡萄糖单独灭菌后加入,其余成分1×105Pa灭菌20 min。
1.2 仪器与设备
DYY-12电泳仪:北京市六一仪器厂;ChampGel5500凝胶成像系统:北京赛智创业科技有限公司;柱式细菌基因组DNA抽提试剂盒:宝生物工程(大连)有限公司;PCR所用引物:上海生工生物工程有限公司;Mutimode 8 Nanoscope V system扫描探针显微镜:德国Bruker公司;GCMS-QP2010气相色谱质谱联用仪、IRPrestige-21傅立叶变换红外光谱仪:日本岛津公司;Quanta 200环境扫描电子显微镜:美国FEI公司。
1.3 方法
1.3.1 菌株筛选[9]
(1)富集培养:称取1 g曲粉加到50 m L无菌水中(带有5粒玻璃珠),200 r/min振荡30 min,使之充分混匀,于85℃水浴锅中处理30min,静置,吸取1m L上清液加至装有50m L富集培养基的250 m L三角瓶中,37℃、200 r/m in培养过夜。
(2)分离纯化:将过夜培养的菌液适当稀释涂布,于37℃培养箱中倒置培养48 h。挑取表面不光滑,边缘不整齐的特征菌落,再次划线分离,将得到的单菌落保藏于营养琼脂斜面,待菌落长出后,4℃冰箱保藏备用。
(3)菌株初筛:KOSUGE T等[7]提出发酵体系中的四甲基吡嗪的前体物质即乙偶姻,为此,借助VP试验[10]检测乙偶姻的产量筛选四甲基吡嗪高产菌株。将菌种接种至装有10 m L VP培养基的试管中,每株一管,37℃、200 r/min培养72 h,发酵结束后检测乙偶姻的产量,挑选呈阳性反应且吸光度值高的菌株作为进一步复筛菌株。
(4)菌株复筛:将初筛菌株接种至装有50m L发酵培养基的500m L三角瓶中,37℃、200 r/m in培养120h,发酵结束后测定四甲基吡嗪的产量,挑选产量高且遗传性稳定的菌株。
1.3.2 检测方法
(1)比色法检测乙偶姻[11]
乙偶姻在碱性条件下可被氧化为2,3-丁二酮,2,3-丁二酮与带有胍基的肌酸反应,可产生粉红色复合物,甲萘酚的存在可加速此反应,该粉红色复合物在波长530 nm处有最大吸收峰,在0.3~0.9范围内吸光度值与乙偶姻的浓度呈线性关系。
(2)气相色谱-质谱联用(GC/MS)检测四甲基吡
气相色谱(GC)条件:毛细管DB-5MS(30 m×0.25 mm× 0.25 μm),进样口温度240℃,载气为高纯氦气(纯度≥99.999%),柱流量1.0 m L/m in;程序升温:70℃保持2 m in,10℃/m in升至210℃,保持2min。进样量1μL;分流比20∶1。
质谱(MS)条件:电离方式为电子电离(electron ionization,EI),离子源温度230℃,全扫描方式扫描谱图进行组分定性。
1.3.3 菌种鉴定
(1)形态及生理生化特征
按文献[12-13]中的方法对菌株进行形态特征、生理生化特征的鉴定。
(2)16S rDNA序列分析[14]
利用柱式细菌基因组提取试剂盒提取菌株总脱氧核糖核酸(deoxyribonucleic acid,DNA),利用细菌通用引物进行聚合酶链反应(polymerase chain reaction,PCR),正向引物27f为5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492r为5′-GGTTACCTTGTTACGACTT-3′,25 μL反应体系中,加入1.5 μL模板,27f、1492r各0.5 μL,三磷酸脱氧核糖核苷酸(deoxyribonucleoside-5′-triphosphate,dNTPs)(10 μmol/L)2.5 μL,10×Buffer 2.5 μL,DNA聚合酶0.5 μL,最后用ddH2O补足体系。PCR扩增程序为预变性94℃5 min,变性94℃30 s,退火54℃30 s,延伸72℃2 min,循环30次,72℃继续延伸10 min,将PCR产物送北京华大基因公司测序。
1.3.4 絮凝与抽滤结合除蛋白质、菌体
将发酵液(终pH 6.0)均分成5份,按0.6 g/L的添加量分别添加聚丙烯酰胺(阳离子型)、壳聚糖、聚乙二醇、海藻酸钠、碱式氯化铝,蒸馏水作空白,置于37℃摇床中200 r/min振荡30 min,静置,得上清液测定菌体、蛋白质含量,考察不同絮凝剂的絮凝能力。
以絮凝效果最佳的絮凝剂为考察对象,其他条件不变的情况下,向均分的6份发酵液中添加絮凝剂,使其终质量浓度分别为0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L、1.4 g/L,考察絮凝剂的最适用量。
将絮凝后得到的上清液,经0.22 μm超滤膜真空抽滤除残余蛋白与菌体。
1.3.5 降温结晶
参照文献[15-16],四甲基吡嗪溶解度降低而显著减小。将除蛋白、菌体后的上清液置于未使用过的50 m L离心管中放入4℃冰箱中静置,使其从饱和溶液中自然结晶。3 d后,得到大量晶体,蒸馏水(预先置于4℃冰箱,避免洗涤过程晶体损失)洗涤晶体,于30℃真空干燥箱内干燥,得到白色针状晶体。
1.3.6 分析方法
以空白培养基作对照,测定发酵液在波长600 nm处的吸光度值OD600nm。发酵液菌体去除率计算公式如下:
考马斯亮蓝法[17]测定蛋白质含量。发酵液蛋白去除率计算公式如下:
式中:C1为絮凝前蛋白质质量浓度,mg/L;C2为絮凝后蛋白质质量浓度,mg/L;V1为絮凝前样品体积,mL;V2为絮凝后样品体积,mL。
1.3.7 傅立叶红外光谱与气质联用对产物分析
精确称取一定量晶体溶于无水乙醇中,定容使其质量浓度为1 g/L,气质联用分析晶体的纯度,根据标准曲线计算样品中四甲基吡嗪的质量浓度。
取1mg晶体与适量KBr均匀研磨混合,压片,在4 000~400 cm-1范围扫描。对晶体产物的分子结构作进一步的分析。
2 结果与分析
2.1 菌株的筛选与鉴定

表1 筛选菌株传代培养结果Table 1 Subculture results of the screened strains
自曲粉中筛选得到196株芽孢杆菌,通过VP试验以筛选目的菌株,得到51株VP阳性菌株。对此51株菌进行摇瓶复筛,得到7株四甲基吡嗪产量突出的菌株,选此7株高产菌株连续传代培养5代,试验结果见表1。
由表1可知,筛选菌株M JS183四甲基吡嗪产量明显高于其他菌株,且在连续传代培养中,变异系数(coefficient of variation,CV)低,反映其稳定性高,因此将菌株MJS183作为目的菌株进行后续试验。
菌株MJS183于分离培养基上培养,结果见图1。由图1可知,菌落呈圆形,边缘不整齐,灰白色,表面粗糙有褶皱,黏稠能拉丝,菌落中央稍有突起,或呈火山口状。液体静置培养条件下液面形成较厚的白色菌膜。镜检发现菌株呈短小直杆状,两端钝圆,革兰氏染色阳性,有芽孢。

高度标尺:-256.3~599.5 nm,明亮区代表较高区域,暗区代表低洼区域,反映样品表面的起伏粗糙程度。a分离培养基上菌落形态(培养36 h);b原子力显微镜下菌的形态;c液体培养12 h后革兰氏染色图(10×100)
菌株MJS183的部分生理生化特性见表2。

表2 菌株MJS183生理生化特性测试结果Table 2 Physiological and biochemical characteristics of strain MJS183
由表2可知,菌株M JS183可利用的糖范围较广,如葡萄糖、果糖、麦芽糖、乳糖。能够利用柠檬酸盐,可在10% NaCl中生长,可在55℃条件下生长,与《常见细菌系统鉴定手册》的枯草芽孢杆菌模式菌株进行对照,二者的生理生化特征一致,初步判断该菌株属于枯草芽孢杆菌。
利用分子生物学方法PCR扩增获得菌株M JS183的16S rDNA序列并进行序列的测定,将测得的核苷酸序列通过NCBI-BLAST程序在GenBank数据库中进行比对,选取相关菌种的同源性高的序列,利用MEGA 5.0软件进行系统发育分析,采用Neighbor-jointing算法多序列连配分析后构建系统发育树,如图2所示。由图2可知,菌株MJS183与多株枯草芽孢杆菌达到99%,与模式菌株枯草芽孢杆菌(Bacillus subtilis)B-F06处于同一分支,结合生理生化特性试验及分子生物学鉴定,可鉴定JMS183为枯草芽孢杆菌(Bacillus subtilis)。
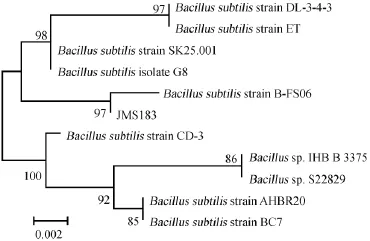
图2 基于16S rDNA基因序列同源性构建的菌株MJS183系统发育树Fig.2 Phylogenetic tree of strain MJS183 based on the 16S rDNA gene homology
2.2 菌株MJS183代谢产物的GC-MS分析
将发酵液5 000 r/min离心10min以除去菌体,取上清液与无水乙醇等体积混合后进行蒸馏,收集馏分,对馏分进行GC-MS分析,总离子流色谱图见图3,1号峰的质谱解析结果见图4。
由图3、图4可知,保留时间8.308 m in处有强峰,将此物质与标准谱图进行比对,与四甲基吡嗪标准品相似度为94%,可以确定菌株MJS183具备发酵产四甲基吡嗪的能力。
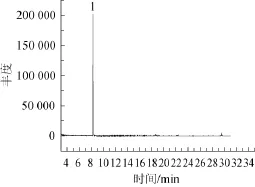
图3 菌株MJS183代谢产物的总离子流色谱图Fig.3 Total ion chromatogram of strain MJS183 metabolite

图4 菌株MJS183代谢产物(A)及四甲基吡嗪标准品(B)质谱图Fig.4 Mass spectrum of strain MJS183 metabolite(A)and tetramethylpyrazine standard(B)
2.3 发酵液的除菌、除蛋白质
取100 m L发酵液于烧杯中,分别加入一定量的聚丙烯酰胺、壳聚糖、聚乙二醇、海藻酸钠、碱式氯化铝,搅拌30 min,静置30 min后测菌体及蛋白质的去除率,结果如图5所示。取100 m L发酵液于烧杯中,添加不同量的壳聚糖,搅拌30 min,静置30 min后测菌体及蛋白质的去除率,结果如图6所示。
由图5可知,不同絮凝剂的絮凝效果差异很大,其中壳聚糖的效果最佳。菌体去除率达92.8%,蛋白质去除率近78.4%,因此选择壳聚糖作为去除发酵液中菌体和蛋白的最佳絮凝剂。
由图6可知,壳聚糖的用量对絮凝效果影响较显著,絮凝剂量过少,菌体不能完全吸附;絮凝剂量过多,饱和絮凝颗粒之间不再相互交联,很难形成大的絮凝团。将上清液(絮凝剂量为0.8 g/L时)经0.22 μm滤膜真空抽滤后,菌体去除率99.7%,蛋白去除率94.8%,但是滤孔容易堵塞,影响抽滤的效果。综合考虑菌体和蛋白的去除率,选择絮凝剂壳聚糖的最佳用量为0.8 g/L。
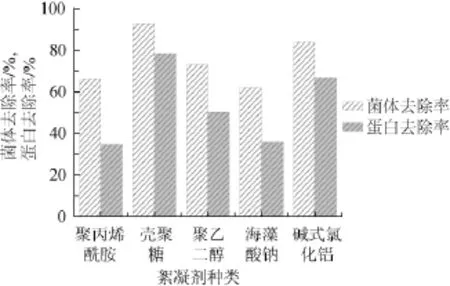
图5 不同絮凝剂对菌体、蛋白质去除率的影响Fig.5 Effect of different flocculating agent on bacteria and protein removing rate

图6 壳聚糖用量对菌体、蛋白质去除率的影响Fig.6 Effect of chitosan addition on bacteria and protein removing rate
2.4 晶体分析
发酵液上清液经0.22 μm滤膜抽滤,滤液于4℃自然结晶,得到白色针状晶体。晶体溶液经HPLC检测,呈单一、狭窄的对称峰,说明晶体组分均一。根据标准曲线的回归方程计算样品的纯度为99.98%,可知所得晶体的纯度较高。将晶体进行傅里叶红外光谱检测,结果见图7。

图7 晶体红外光谱Fig.7 Infrared spectrum of crystal
由图7可知,芳环的指纹区和特征区均存在吸收峰,说明该晶体属于芳香族化合物。1 630~1 690 cm-1之间的强峰代表了C=N双键的存在,1 450~1 650 cm-1间的峰是苯环C=C双键的特征峰,1 375 cm-1处是甲基的一个明显特征峰。结果表明,晶体的结构是含氮杂环、甲基取代的有机物。为了进一步验证,将晶体溶于无水乙醇中,进行GC-MS分析-确定经纯化得到的晶体即为四甲基吡嗪。
3 结论
本研究从中温大曲粉中筛选得到一株高产四甲基吡嗪的菌株,经过生理生化特性测试和16S rDNA鉴定为枯草芽孢杆菌(Bacillus subtilis)。经过摇瓶实验,菌株MJS183的四甲基吡嗪产量可达11.42 g/L,已达中上水平,后期通过代谢控制发酵、菌株改良等手段,四甲基吡嗪的产量还会进一步提高。本实验对纯化得到的晶体进行了HPLC、FTIR、GC/MS结合分析,可以鉴定该晶体为四甲基吡嗪,经HPLC计算其纯度为99.98%,为下一步对发酵液中四甲基吡嗪大规模提取提供了可靠的基础。
[1]MASUDA H,MIHARA S.Olfactive properties of alkylpyrazines and 3-substituted 2-alkylpyrazines[J].J Agr Food Chem,1988,36(3):584-587.
[2]FAN W L,XU Y,ZHANG Y H.Characterization of pyrazines in some Chinese liquors and their approximate concentrations[J].J Agr Food Chem,2007,55(24):9956-9962.
[3]胡国芬,王建平.川芎嗪的药理作用及临床应用进展[J].中国药物与临床,2006,6(10):773-774.
[4]杨虹,刘璐,张海菊.川芎嗪提取工艺及质量标准研究[J].中国民族民间医药,2009,18(7):24-25.
[5]王向宇,侯昭胤,陆维敏,等.二乙酰一肟催化加氢制四甲基吡嗪的研究[J].化学反应工程与工艺,2007,103(4):1208-1216.
[6]邓泽庭,陶德胜,罗荣,等.四甲基吡嗪生产方法:中国,CN20031010 2368.0[P].2006.
[7]KOSUGE T,ADACHI T,KAMIYA H.Isolation of tetramethylpyrazine from culture of Bacillus natto,and biosynthetic pathways of tetramethylpyrazine[J].Nature,1962,195:1103.
[8]李永芹,许乐乐,陈克卫.1株芽孢杆菌的筛选鉴定及其净水效果研究[J].水生态学杂志,2013,34(1):96-100.
[9]赵东,牛广杰,彭志云,等.包包曲中5株枯草芽孢杆菌的分离与初步鉴定[J].中国酿造,2010,29(8):70-73.
[10]WESTERFELD W W.A colorimetric determination of blood acetoin[J].J Biol Chem,1945,161(2):495-502.
[11]范宜晓,赵祥颖,刘建军,等.产3-羟基丁酮菌株的筛选及产物分析[J].食品与发酵工业,2012,38(11):42-46.
[12]R E布坎南,N E吉本斯.伯杰氏细菌鉴定手册[M].8版.洪俊华译.北京:科学出版社,1984.
[13]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[14]郭凤莲,陈存社.产淀粉酶枯草芽孢杆菌的16Sr RNA测序鉴定[J].中国酿造,2008,27(8):26-28.
[15]孙永跃,李淑芬,全灿.阿魏酸和川芎嗪在超临界CO2中溶解度的测定[J].高等化学工程学报,2005,19(6):839-842.
[16]XIAO Z J,XIE N Z,LIU P H,et al.Tetramethylpyrazine production from glucose by a newly isolated Bacillus mutant[J].Appl Microbiol Biotechnol,2007,73(3):512-518.
[17]刘志国.生物化学实验[M].武汉:华中科技大学出版社,2007.
Screening of tetramethylpyrazine-producing strain
ZHAO Deyi1,TANG Dandan2,CAO Jianquan1,WANG Ruiming2,LIU Xue1*
(1.Shandong Jingzhi Liquor Co.,Ltd.,Anqiu 262119,China;2.Shandong Key Laboratory of Microbial Engineering, QiLu University of Technology,Jinan 250353,China)
In this study,a tetramethylpyrazine-producing strain MJS183 was screened from medium temperature Daqu.When the strain was incubated at 37℃with a shake-flask culture of 200 r/m in for 120 h,the maximum tetramethylpyrazine concentration was up to 11.42 g/L using glucose as main carbon source.The fermentation broth was analyzed by GC-MS,and results showed that the major metabolite was tetramethylpyrazine.Strain MJS183 was identified as Bacillus subtilis based on its morphology,physiology,and biochemical characteristics as well as 16S rDNA sequence analysis.In order to obtain high pure tetramethylpyrazine,the removing technology of protein and cell from fermentation broth were studied.Results showed that the optimal condition was chitosan addition 0.8 g/L,temperature 37℃with a speed of 200 r/min for 30 m in.The supernatants were disposed by0.22 μm filter membrane ultrafiltration,and then the filtrate was crystallized at 4℃,and the purified crystal was white and aciform.The crystal was qualitatively analyzed by GC-MS and fourier transform infrared spectrometer,the detected results showed the crystal was tetramethylpyrazine.
tetramethylpyrazine;Bacillus subtilis;screening and identification;crystal analysis
Q 939.97
A
0254-5071(2015)03-0102-05
10.11882/j.issn.0254-5071.2015.03.024
2015-01-10
赵德义(1967-),男,高级工程师,本科,研究方向为发酵工程。
*通讯作者:刘雪(1986-),女,硕士研究生,研究方向为工业微生物菌种选育与鉴定。

