萌发菌HL-003胞内多糖的提取及抗氧化性研究
郑朋朋,杨晓波,李 珊,陈玉惠,敖新宇
(西南林业大学生命科学学院,云南昆明650224)
萌发菌HL-003胞内多糖的提取及抗氧化性研究
郑朋朋,杨晓波,李 珊,陈玉惠,敖新宇*
(西南林业大学生命科学学院,云南昆明650224)
采用乙醇沉淀法提取多糖,在单因素试验基础上进行正交试验,探讨萌发菌HL-003胞内多糖提取的最佳条件;分别采用Fe2+/H2O2体系和邻苯三酚自氧化法探讨多糖清除羟基自由基和氧自由基的能力。结果表明,最佳提取条件为液料比20∶1(m L∶g)、提取时间1.5 h、提取温度70℃、乙醇体积分数80%,其最佳提取率为7.63%;萌发菌HL-003胞内多糖对羟自由基和氧自由基清除作用明显,是一种良好的天然抗氧化剂。
萌发菌;多糖提取;正交试验;抗氧化性
真菌多糖是指从各种真菌的子实体或菌丝体分离提取的一类高分子化合物,是人体健康的重要营养和保健成分[1-5]。真菌多糖可应用于人类的疾病治疗和保健,具有调节机体免疫力、抗肿瘤、抗病毒、抗氧化、抗辐射、抗衰老、健胃保肝、降血糖、血脂、血压等多种功能[6-10]。胞内多糖不仅具有多方面的生物活性,且多无毒,是比较理想的药物,如昆布多糖和肝素有抗凝血作用,硫酸软骨素可防止血管硬化。除了食用菌多糖(如银耳多糖、灵芝多糖、蜜环菌多糖)外,刺五加多糖、黄芪多糖、茯苓多糖、枸杞多糖等还具有免疫功能和抗肿瘤作用[10-12]。
萌发菌HL-003是天麻种子萌发时的共生菌,为真菌界担子菌门小菇属(Mycena),属于高等担子菌[13-17]。本研究针对萌发菌HL-003胞内多糖进行提取条件优化和体外抗氧化性研究。通过对萌发菌HL-003胞内多糖提取过程中液料比、浸提温度、提取时间、乙醇体积分数4个因素进行单因素试验,在单因素试验基础上进行正交试验,从而对萌发菌HL-003胞内多糖提取工艺进行优化筛选;并对分离提取的胞内多糖进行体外抗氧化性探究。旨在探究提取萌发菌HL-003胞内多糖最优工艺条件和胞内多糖抗氧化性能力,为拓展和大规模生产萌发菌HL-003胞内多糖提供参考依据,同时也为其他的真菌胞内多糖的提取提供参考和依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
萌发菌HL-003:西南林业大学生命科学学院生化教研组提供。
1.1.2 试剂
葡萄糖、琼脂、KH2PO4、MgSO4、蒽酮、水杨酸、硫酸亚铁、Tris、邻苯三酚均为分析纯:国药集团化学试剂有限公司;正丁醇、氯仿、无水乙醇、浓硫酸、HCl、H2O2:汕滇药业有限公司。
1.2 仪器与设备
BHC-1300无菌超净工作台:江苏泰诺源生物技术有限公司;HZ-88摇床:常州普天仪器制造有限公司;BS224S电子天平、Eppendorf-5430 R离心机:德国赛多利斯公司;MLS-3750高压灭菌锅:日本Sanyo公司;RE-2000E真空旋转蒸发仪:无锡中冶结晶器有限公司;UNIC-WFZVU-480s紫外分光光度计:上海精密仪器仪表有限公司;HWS-12水浴锅:上海一恒电热恒温水浴锅;DHG-9240A电热恒温鼓风干燥箱:上海环试电子科技有限公司。
1.3 方法
1.3.1 萌发菌HL-003菌丝体的制备
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)进行菌株的活化与扩繁,之后接入马铃薯葡萄糖(potato dextrose,PD)培养基进行液体发酵培养15 d[18]。三层纱布过滤,蒸馏水反复冲洗菌丝体;菌丝体放入60℃烘箱烘干,粉碎过筛后装入广口瓶,放入干燥器备用。
1.3.2 菌体胞内多糖的提取与测定
萌发菌胞内多糖的提取流程如下:
菌丝体粉末→水提→浓缩→脱蛋白→醇析→粗多糖→蒸馏水透析12 h→精制多糖→定容待测
葡萄糖标准曲线绘制:准确称取105℃烘箱恒质量的葡萄糖10mg,溶解后定容至100m L,配成100μg/m L的葡萄糖标准液。分别准确移取0、0.2m L、0.4m L、0.6m L、0.8m L、1.0 m L标准液于试管中,用蒸馏水补水至1 m L,立即加入4.0 m L蒽酮-硫酸试剂,迅速置于冰水浴中冷却,各管加完后一起浸于沸水浴中,准确煮沸10 min后取出,用流水冷却,室温放置10 m in,在波长620 nm处测定吸光度值,运用Origin 8.0对结果进行分析,绘制葡萄糖标准曲线。
多糖含量测定:取1 m L稀释10倍后的待测溶液放入试管中(1 m L蒸馏水作空白对照),其他步骤同上。多糖提取率按照公式(1)计算:

式中:A为波长620 nm处的吸光度值;m为菌丝体粉末质量,g。
1.3.3 单因素试验
液料比对多糖提取率的影响:在浸提温度60℃,提取时间2.0h,乙醇体积分数75%条件下,分别设定液料比10∶1、20∶1、30∶1、40∶1、50∶1(m L∶g)进行单因素试验。
浸提温度对多糖提取率的影响:在液料比20∶1(m L∶g),提取时间2.0 h,乙醇体积分数75%条件下,分别设定浸提温度40℃、50℃、60℃、70℃、80℃进行单因素试验。
提取时间对多糖提取率的影响:在液料比20∶1(m L∶g),浸提温度60℃,乙醇体积分数75%条件下,分别设定提取时间1.0 h、1.5 h、2.0 h、2.5 h、3.0 h进行单因素试验。
乙醇体积分数对多糖提取率的影响:在液料比20∶1(m L∶g),浸提温度60℃,提取时间2.0 h条件下,分别设定乙醇体积分数50%、60%、70%、80%、90%进行单因素试验。1.3.4正交试验
在单因素试验的基础上选定合理的试验因素水平进行正交试验设计[21]。分别对液料比(A)、浸提温度(B)、提取时间(C)、乙醇体积分数(D)选取3个水平,运用SPSS软件进行4因素3水平正交试验,对试验结果进行软件分析,得出最佳的试验条件,正交试验的因素水平设计见表1。
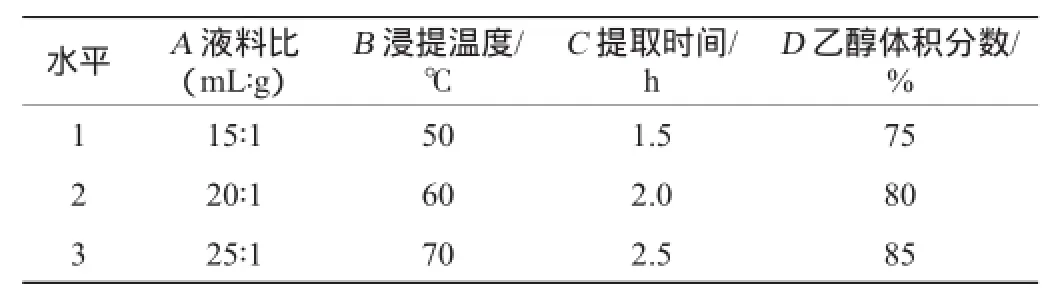
表1 多糖提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiment for polysaccharide extraction conditions optimization
1.3.5 抗氧化性试验
多糖清除·OH能力的测定:采用Fe2+/H2O2体系测定糖提取液清除·OH的能力[22-23]。分试验组和对照组,试验组分别为粗多糖和精多糖,加入不同质量浓度样品本底组,通过预实验确定待测样品浓度梯度。然后在10 m L的离心管中加入6 mmol/L水杨酸-无水乙醇和6 mmol/L硫酸亚铁各1 m L后,加入不同质量浓度的样品液1 m L(加1 m L不同质量浓度的VC溶液作为参比;加1 m L双蒸水作为空白),最后加1 m L 6 mmol/L H2O2(样品本底管加1 m L H2O),立即置37℃水浴30 min。在波长510 nm处测量吸光度值A,试验重复3次,清除率按下式计算:
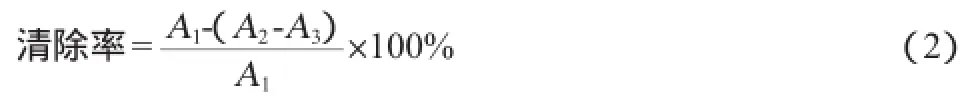
式中:A1为对照吸光度值,A2为样品吸光度值,A3为样品本底吸光度值。
多糖抑制超氧阴离子自由基(O2-·)生成能力测定:采用邻苯三酚自氧化法[20],测定O2-·清除能力[24-25]。通过预实验确定实验物浓度梯度后在试管中首先加入4.5 m L 50 mmol/L Tris-HCL缓冲液(pH 8.20,含1mmol/L二乙基三胺五乙酸),然后再加入不同浓度样品液1 m L(加入1 m L不同溶度的VC溶液作为参比)、蒸馏水3.2 m L,对照管中加4.2 m L蒸馏水,25℃水浴30 min,再加入300 μL 3 mmol/L邻苯三酚(含10 mmol/L HCl)后,立即在吸收波长325 nm处,每隔30 s记录1次吸光度值,测量时间3 min,试验重复3次。按下式计算抑制率:

式中:ΔA对照表示对照溶液吸光度值随时间变化率;ΔA样品为样品溶液吸光度值随时间变化率。
2 结果与分析
2.1 葡萄糖标准曲线的绘制
采用Origin8.0测量结果进行分析和绘图,以葡萄糖质量浓度(C)为横坐标,吸光度值(A)为纵坐标,得到标准曲线如图1所示。得到线性回归方程:A=0.003 95C-0.006 07,相关系数R2=0.998,表明线性关系良好。
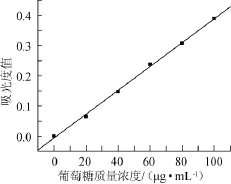
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 单因素试验
2.2.1 液料比对多糖提取率的影响
液料比对多糖提取率的影响如图2。由图2可知,液料比在10∶1~20∶1(m L∶g)时,HL-003胞内多糖的提取率随着液料比的增加而逐渐增大,当液料比为20∶1(m L∶g)时,HL-003胞内多糖的提取率达到最大值,液料比再增加,多糖提取率不再增加,表明最佳液料比为20∶1(m L∶g)。
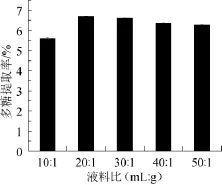
图2 液料比对多糖提取率的影响Fig.2 Effect of liquid-solid ratio on extraction rate of polysaccharides
2.2.2 浸提温度对多糖提取率的影响
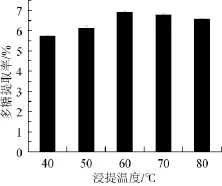
图3 浸提温度对多糖提取率的影响Fig.3 Effect of extraction temperature on extraction rate of polysaccharides
浸提温度对多糖提取率的影响如图3。由图3可知,浸提温度在40~60℃时,随浸提温度升高,HL-003胞内多糖的提取率随之增大,浸提温度为60℃时,HL-003胞内多糖的提取率达到最大,继续升高浸提温度多糖提取率有所下降,表明最佳浸提温度为60℃。
2.2.3 提取时间对多糖提取率的影响
提取时间对多糖提取率的影响见图4。由图4可知,提取时间在1.0~2.0 h时,提取时间延长,HL-003胞内多糖的提取率也随之增大,提取时间为2.0 h时,HL-003胞内多糖的提取率达到最大,继续延长时间多糖提取率有所下降,表明最佳提取时间为2.0 h。
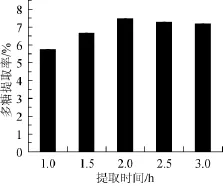
图4 提取时间对多糖提取率的影响Fig.4 Effect of extraction time on extraction rate of polysaccharides
2.2.4 乙醇体积分数对多糖提取率的影响
乙醇体积分数对多糖提取率的影响见图5。由图5可知,乙醇体积分数在50%~80%时,随着乙醇体积分数增加,HL-003胞内多糖的提取率也随之增大,乙醇体积分数为80%时,HL-003胞内多糖的提取率达到最大,继续延长时间多糖提取率有所下降,表明最佳乙醇体积分数为80%。
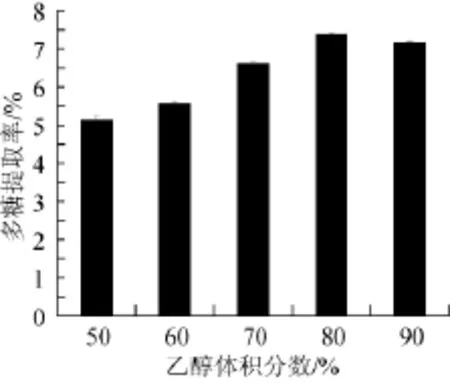
图5 乙醇体积分数对多糖提取率的影响Fig.5 Effect of ethanol content on extraction rate of polysaccharides
2.3 正交试验
分别以液料比(A)、浸提温度(B)、提取时间(C)、乙醇体积分数(D)为评价因素,多糖提取率为评价指标,正交试验结果与分析见表2。
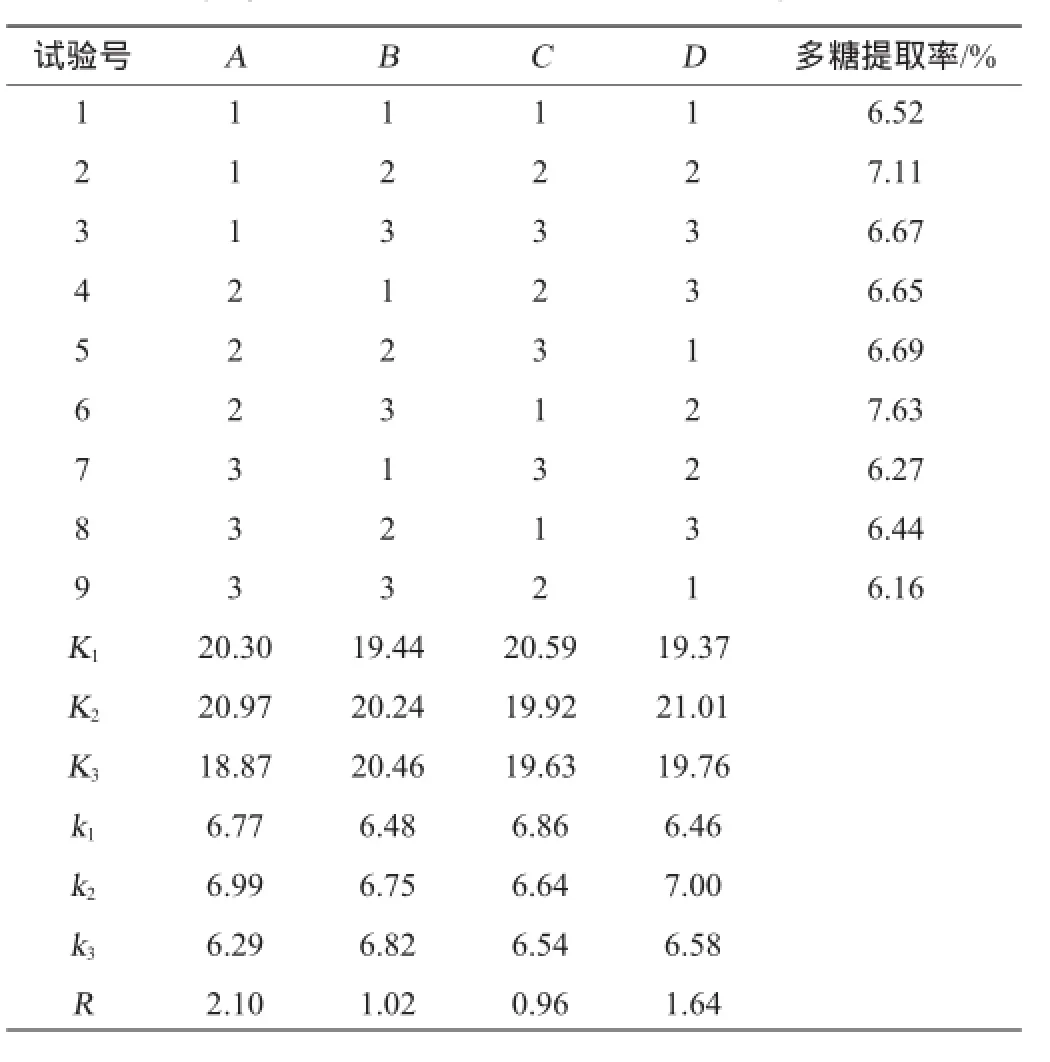
表2 多糖提取条件正交试验优化结果与分析Table 2 Results and analysis of orthogonal experiments for polysaccharides extraction conditions optimization
由表2可知,各因素对多糖提取率的影响为A>D>B>C,液料比对多糖提取率的影响最大,乙醇体积分数次之,浸提温度再次之,提取时间最小。在试验范围之内最佳优化组合为A2B3C1D2,即提取液料比为20∶1(m L∶g),浸提温度为70℃,提取时间为1.5 h,乙醇体积分数为80%。在此条件下,萌发菌HL-003多糖提取率最高,为7.63%。
2.4 多糖抗氧化性试验
2.4.1 多糖清除·OH能力
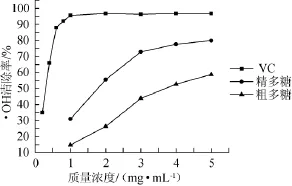
图6 多糖及VC对·OH的清除率Fig.6 Scavenging rate of polysaccharides and VC on·OH
多糖和VC清除·OH能力如图6所示。由图6可知,胞内粗多糖和精多糖都具有清除·OH的能力,其中5 mg/m L精多糖清除能力最大,可达79.7%。具有一定的清除·OH的能力。相同质量浓度下,精制多糖清除·OH的能力强于粗多糖。·OH的清除率与多糖质量浓度成正相关性即多糖质量浓度越高,清除·OH的能力也越强,与相同质量浓度的VC相比较,粗多糖、精多糖的清除·OH能力弱于VC。
2.4.2 多糖抑制O2-·生成能力
多糖和VC抑制O2-·生成能力如图7所示。由图7可知,萌发菌HL003胞内粗多糖、胞内精制多糖都具有抑制O2-·的能力,多糖纯度越高,效果越好,相同质量浓度下精制多糖对O2-·生成的抑制强于粗多糖,当精制多糖质量浓度达5mg/m L时对O2-·生成的抑制率最高,可达66.4%。但与相同质量浓度的VC相比,粗多糖、精多糖的抑制率要比VC弱。
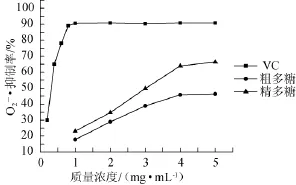
图7 多糖及VC对O2-·的抑制率Fig.7 Scavenging rate of polysaccharides and VC on O2-·
3 结论
在单因素试验的基础上进行正交试验,优化出萌发菌HL-003胞内多糖的最佳提取条件为:液料比20∶1(m L∶g),浸提温度70℃,提取时间1.5 h,乙醇体积分数80%,在此条件下,多糖提取率为7.63%。对胞内多糖的抗氧化性的研究表明,萌发菌胞内多糖具有较强的抗氧化活性,尤其是精多糖,其中5mg/m L精多糖对羟自由基的清除效率达到79.7%,抑制氧自由基的效率达到66.4%。可见萌发菌胞内多糖具有开发利用的价值。
[1]王琦.蟹味菇的营养价值及生物活性成分研究[J].食品研究与开发,2010,31(1):173-174.
[2]周小鹭.真菌多糖与人体健康[J].黑龙江生态工程职业学院学报,2009(5):72-74.
[3]OOI V E,LIU F.Immunomodulation and anti-cancer activity of polysaccharide-protein complexes[J].Curr Med Chem,2000,7(7):715-729.
[4]顾芳红,殷红,马劲.碳、氮源对猪苓菌丝生长与胞外多糖含量的影响[J].西北大学学报:自然科学版,2001,31(5):437-440.
[5]MASUDA Y,ITO K,KONISHI M,et al.A polysaccharide extracted from Grifolafrondosa enhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cancer[J].Cancer Immunol Immun,2010,59(10):1531-1541.
[6]LIU J J,HUANG T S,HSUC M L,et al.Antitumor effects of the partially purified polysaccharides from Antrodia camphorata and the mechanism ofits action[J].Toxicol Appl Pharm,2004,201:186-193.
[7]WASSER S P.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Appl Microbiol Biotechnol,2002, 60:258-274.
[8]郭欣,刘东红,叶兴乾.海洋动物中具重复序列硫酸多糖的抗凝血活性构效机理研究进展[J].中国食品学报,2013(11):116-123.
[9]郭龙,杨英来,杨涛,等.高硫代度红芪多糖硫酸酯的制备及体外抗凝血活性研究[J].药学学报,2013,48(11):1665-1670.
[10]梅天笑,王小莺,万根,等.多糖的修饰及其抗凝血活性研究进展[J].江西农业大学学报,2013,35(5):1108-1113.
[11]张文州.食药用真菌多糖的研究进展[J].食品工业科技,2014,35(15):395-399.
[12]XU W,ZHANG F,LUO Y,et al.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohyd Res, 2009,344(2):217-222.
[13]谢洪霞,王振涛,向芸庆,等.酸奶自然发酵剂“西藏灵菇”菌体微观丝状物的培养与鉴定[J].中国酿造,2009,28(2):60-61.
[14]徐锦堂,郭顺星,范黎,等.天麻种子与小菇属真菌共生萌发的研究[J].菌物系统,2001,20(1):137-141.
[15]郑晓君,叶静,管常东,等.兰科植物种子萌发研究进展[J].北方园艺,2010(19):206-209.
[16]朱泉,田甜,杨澍,等.兰科植物种子的非共生萌发研究进展[J].江苏农业科学,2009(4):205-208.
[17]郭顺星,王秋颖.促进天麻种子萌发的石斛小菇优良菌株特性及作用[J].菌物系统,2001,20(3):408-412.
[18]张艺子涵,张群,王平平.羊耳蒜菌根真菌培养条件的优化[J].北方园艺,2014(7):102-106.
[19]张文州.食药用真菌多糖的研究进展[J].食品工业科技,2014,35(15):395-399.
[20]殷东林,王锐丽,段鸿斌.蛹虫草子实体虫草多糖提取工艺的优化[J].江苏农业科学,2014,42(7):277-279.
[21]吕志强,李乔.正交试验优选桑籽中总生物碱、总黄酮及粗多糖的提取工艺[J].中国实验方剂学杂志,2014,20(14):27-30.
[22]鲍敏,曾阳.粗柄羊肚菌胞外多糖的体外抗氧作用研究[J].食用菌,2014,36(2):63-64.
[23]何钢,颜军,郭晓强,等.生何首乌多糖的单糖组成及清除羟自由基的活性测定[J].西北师范大学学报:自然科学版,2013,49(4):70-75.
[24]杨青松,赵艳.响应面法优化藏药红雪茶多糖提取工艺[J].食品工业,2013(8):44-48.
[25]赵晶丽,高红梅,于海帅.枸杞多糖对高脂血症大鼠血脂代谢及氧自由基的影响[J].中国实验方剂学杂志,2013,19(5):241-243.
Extraction and antioxidant activity of intracellular polysaccharide from germination fungus HL-003
ZHENG Pengpeng,YANG Xiaobo,LI Shan,CHEN Yuhui,AO Xinyu*
(Co llege of Life Science,Southwest Forestry University,Kunming 650224,China)
Polysaccharides were extracted by ethanol precipitation,and the optimum conditions for intercellular polysaccharide extraction from germination fungus HL-003 were determined by single factor experiment and orthogonal experiment.The hydroxyl radicals and oxygen radicals scavenging activity of polysaccharide were determined by Fe2+/H2O2system and pyrogallol autoxidation method.Results showed that the optimal extraction conditions were liquid-solid ratio 20∶1(m l∶g),extraction time 1.5 h,extraction temperature 70℃,alcohol content 80%,and the optimum extraction rate was 7.63%.Polysaccharides have strong scavenging activity on hydroxyl radicals and oxygen radicals and they are good natural antioxidant.
germination fungus;polysaccharide extraction;orthogonal experiment;antioxidant activity
TS201.2
A
0254-5071(2015)03-0071-05
10.11882/j.issn.0254-5071.2015.03.016
2015-01-19
云南省优势特色重点学科生物学一级学科建设项目(50097505)
郑朋朋(1990-),男,硕士研究生,研究方向为生物化学与分子生物学。
*通讯作者:敖新宇(1978-),男,副教授,硕士,主要从事分子生物学研究工作。

