发酵饲料用微生物的分离与鉴定
于寒松,辛迎雪,张杰,李倬林,李铁柱*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.吉林省农业科学院农产品加工研究所,吉林长春130124)
发酵饲料用微生物的分离与鉴定
于寒松1,辛迎雪1,张杰2,李倬林2,李铁柱2*
(1.吉林农业大学食品科学与工程学院,吉林长春130118;2.吉林省农业科学院农产品加工研究所,吉林长春130124)
从24份纳豆粉、鲜纳豆和豆豉中筛选出16株纳豆芽孢杆菌,从20份酒曲中筛选出14株酿酒酵母,从20份腌制酸菜中筛选出14株植物乳杆菌,并对其菌落特征、菌体形态观察和生理生化特性三方面进行对比研究和系统鉴定,旨在为开发具有复合益生菌发酵饲料的生产与应用提供实验依据。
纳豆芽孢杆菌;酿酒酵母;植物乳杆菌;分离;鉴定
相对于普通饲料,发酵饲料具有显著的优势,它一方面可以提高和改善饲料原料的营养价值消除饲料原料中的抗营养因子,另一方面可以提高动物的生产性能,减少动物疾病的发病率[1]。我国目前经批准的饲用微生物主要有乳酸菌[2-5]、芽孢杆菌[6]、酵母菌[7]、放线菌、光合细菌[8]五大类,作为益生菌的纳豆芽孢杆菌、酵母菌、植物乳杆菌因其特有的生物特性成为研究热点[9]。因此,本研究对不同来源的纳豆粉、鲜纳豆、豆豉、酒曲及酸菜中的纳豆芽孢杆菌、酵母菌、植物乳杆菌进行了筛选及鉴定研究,目的是获得性能优良可用于发酵饲料的生产菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
纳豆芽孢杆菌试验材料:24份来自江西、上海、台湾等地的纳豆菌粉、鲜纳豆、干黑豆豉样品。
植物乳杆菌试验材料:20份来自吉林、白城、延吉等地手工腌制东北酸菜样品。
酵母菌试验材料:20份来自贵州、苏州、浙江、湖北、四川等地的酒曲样品。
1.1.2 培养基[10-11]
牛肉膏蛋白胨培养基,MRS培养基,麦芽汁培养基,基础发酵培养基,马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),玉米粉培养基,麦氏培养基,脱脂牛奶培养基,V-P培养基,淀粉水解培养基,明胶液化培养基,糖类发酵培养基,醇类发酵培养基,尿素培养基,硝酸盐还原培养基,乳链球菌(Streptococcus lactis,SL)培养基,HP培养基,多价蛋白胨-酵母膏培养基(poly peptone yeast extract,PY),醋酸铅培养基,蛋白胨水培养基。
1.2 仪器与设备
BCN-1360B超净工作台:北京东联哈尔仪器制造有限公司;MLS-3780高压蒸汽灭菌锅:日本Sanyo公司;BX51光学显微镜:日本OLYMPUS公司;HZQ-Q电热恒温培养箱:上海一恒实验设备有限公司;VITEK 2 COMPACT全自动细菌及药敏分析系统:法国生物梅里埃公司;705超低温冰柜:美国ThermoElectron公司。
1.3 试验方法
1.3.1 分离与纯化
(1)纳豆芽孢杆菌的分离与纯化
在无菌条件下称取16种纳豆菌粉各0.1 g置于装有10 m L无菌生理盐水的试管,取4种鲜纳豆、4种干黑豆豉各1g置于装有100m L无菌生理盐水的三角瓶中,振荡器上充分振荡30 min,80℃水浴10 m in后,迅速冷却至室温,将此菌悬液作为原始菌液[11]。
将制备好的24份样品菌悬液,充分摇匀后用无菌生理盐水梯度稀释到10-7,各取100 μL上述10-1~10-7稀释度的菌悬液于含盐量2%的牛肉膏蛋白胨培养基平板,每处理设3个平行,涂匀稀释液。
将上述平板移至37℃恒温培养箱倒置培养24 h,观察菌落生长情况挑取具有芽孢杆菌细胞形态的单菌落进行革兰氏染色,显微镜下观察对得到的单菌落多次划线分离纯化,直至获得纯种菌。
纳豆芽孢杆菌的复筛主要是利用纳豆枯草芽孢杆菌产蛋白酶的特性,用无菌牙签沾取少许培养24 h的待测菌株,点种于脱脂牛奶培养基上,于37℃恒温培养箱中倒置培养18 h,选取菌落周围产生水解圈的菌株作为最终分离得到的菌株[12-16]。
(2)植物乳杆菌的分离与纯化
在无菌条件下称取20份酸菜各20 g切碎,分别移至180 m L无菌蛋白胨中,振荡混匀,静置数分钟,取上层清液备用。
按接种量10%将酸菜发酵液接入MRS液体培养基,30℃厌氧培养48 h,连续增殖2~3次,增殖后的样品用无菌生理盐水梯度稀释至10-7,用倾注平板法取10-5、10-6、10-7稀释度的稀释液在含钙MRS培养基平板上涂匀,再覆盖一层2%琼脂培养基制成厌氧环境,30℃倒置培养48 h,选取单菌落多次划线分离纯化直至获得纯种菌。
(3)酵母菌的分离与纯化
在无菌条件下称取20份酒曲各1 g置于装有100 m L无菌水的三角瓶中振荡摇匀制成菌悬液,将此菌悬液作为原始菌液。
将制备好的20份样品菌悬液,用无菌水梯度稀释到10-6,用倾注平板法取100 μL上述10-2~10-6稀释度的菌悬液于PDA琼脂培养基和麦芽汁琼脂培养基平板,每处理设3个平行,涂匀稀释液。
将上述平板移至28℃恒温培养箱中倒置培养48 h,观察菌落形态选定疑似酵母菌落反复进行划线分离纯化,确认后挑取单菌落到PDA斜面培养基上,28℃培养48 h后置于4℃保存备用[17-18]。
1.3.2 鉴定
(1)纳豆芽孢杆菌的鉴定
进行形态观察,将菌株划线涂布于活化培养基平板上,37℃培养24 h,观察菌落如颜色、形状、透明度、边缘、隆起形状等。进行革兰氏染色和芽孢染色,在油镜下观察菌体形状和芽孢着生情况,菌体大小用显微测微尺进行测量。
根据《伯杰细菌鉴定手册》[19]和《常见细菌系统鉴定手册》,对分离得到的菌株进行生理生化鉴定试验;而纤溶活性测定是用试验所分离的菌株制作纳豆,将制成的纳豆用蒸馏水充分洗涤后离心上清液,在纤维蛋白平板[20]加上清液10 μL,放置37℃培养15 h,观察溶解圈的形成情况从而确定菌种。
(2)植物乳杆菌的鉴定
菌种初步鉴定是采用乳酸纸层析实验,展开剂是水∶苯甲醇∶正丁醇=1∶5∶5,另加1%的甲酸,显色剂为0.04%溴甲酚蓝酒精溶液,2%分析纯乳酸和空白培养液作对照。
根据《伯杰细菌鉴定手册》将经过乳酸纸层析实验筛选出的菌株分别进行分离培养基平板上菌落形态特征的观察、革兰氏染色后显微镜下菌株形态观察、各种生理生化特征试验的观察。
(3)酵母菌的鉴定
将待测菌用稀释平板法在麦芽汁琼脂培养基和PDA琼脂培养基上28℃培养36 h,选取单个菌落观察其颜色、形状、透明度、光滑、湿润和边缘整齐等特征;细胞形态的观察是用吕氏美兰染液染色显微镜下观察;假菌丝形态是将待测菌接种于玉米琼脂平板28℃培养72 h进行观察;子囊孢子的观察是将待测菌接种于麦氏培养基斜面上,28℃培养7 d后用孔雀绿芽孢染液染色显微镜下观察[20]。
根据《酵母菌特征及鉴定手册》和《真菌鉴定手册》[21],对分离出的菌株进行生理生化试验,分析菌种的生理生化性质,应用全自动细菌及药敏分析系统及rDNA的18S序列进行菌株鉴定。
2 结果与分析
2.1 分离与纯化
纳豆芽孢杆菌的分离与纯化:在牛肉膏蛋白胨培养基平板上经过多次划线分离后,从纳豆菌粉、鲜纳豆、干黑豆豉中共分离24株菌。
植物乳杆菌的分离与纯化:在MRS固体培养基平板上经过多次划线分离后,从酸菜中共分离20株菌。
酵母菌的分离与纯化:在PDA琼脂培养基和麦芽汁琼脂培养基平板上经过多次划线分离后,从酒曲中共分离20株菌。
2.2 菌的鉴定
2.2.1 纳豆芽孢杆菌的鉴定
(1)纳豆芽孢杆菌菌落形态和显微形态观察
分离得到16株菌株N1-N16,经菌落形态观察,在牛肉膏蛋白胨培养基平板上菌落呈灰白色,近圆形,表面干燥粗糙,不透明,无光泽,中间凸起有皱褶,边缘不光滑成裂叶状,中央颜色深于边缘部分,用牙签挑取菌落有拉丝现象,在平板上菌落成树状生长,结果见图1。
显微镜下对培养24 h的菌株进行个体形态观察发现菌株为革兰氏染色呈阳性,镜下细胞形态为杆状,菌株的细胞排列多以单个、成对、长丝状或成链排列,两面钝圆,产芽孢,芽孢呈椭圆或柱状,中生或近中生且不膨大,根据以上特征可初步将此菌株归为芽孢杆菌属,结果见图2。

图1 纳豆芽孢杆菌的菌落形态Fig.1 Colonial morphology of Bacillus natto
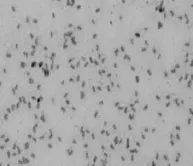
图2 纳豆芽孢杆菌的细胞形态Fig.2 Cells morphology of Bacillus natto
(2)菌株生理生化特性
根据《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》中芽孢杆菌属的鉴别特征,以枯草芽孢杆菌作为标准对照菌株,共同进行生理生化特性试验。鉴定结果(表1)表明N1等16株菌株与对照菌株生理生化特性相同,均为芽孢杆菌属,因此依据各鉴定试验的结果可初步判定16株菌株均属于纳豆菌为枯草芽孢杆菌亚种。
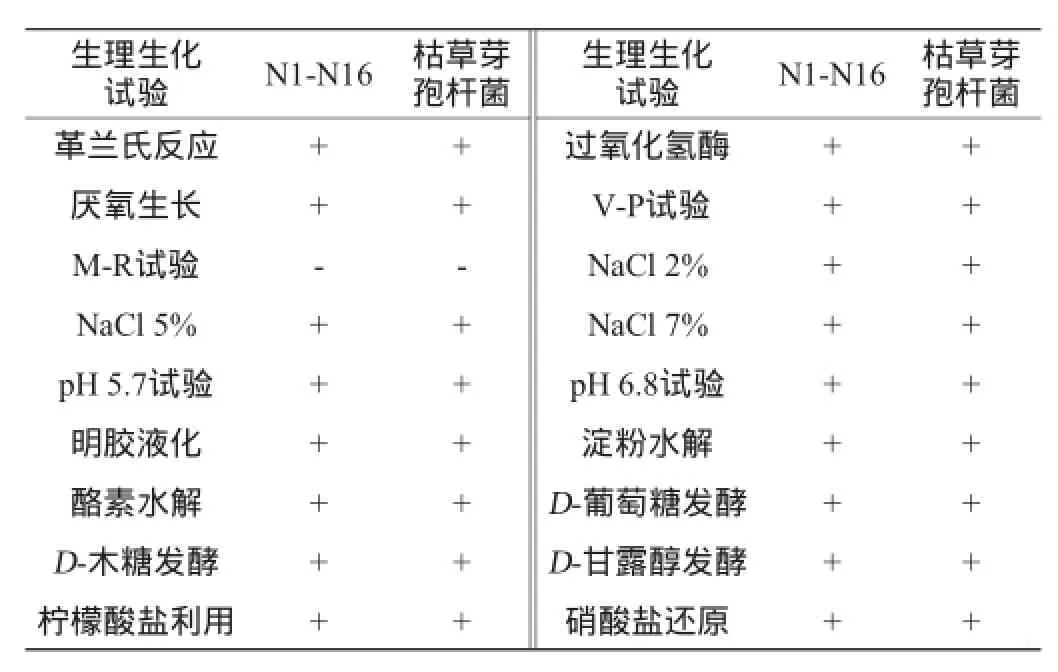
表1 菌株N1-N16鉴定结果Table 1 Identification results of strain N1-N16
2.2.2 植物乳杆菌的鉴定
(1)植物乳杆菌菌落形态和显微形态观察
分离得到14株菌株Z1-Z14,经菌落形态观察,在MRS琼脂培养基平板上菌落呈白色,圆形,中央凸起,表面光滑,边缘整齐,质地均匀,而且在挑取菌体时都有一定的黏性,结果见图3。
显微镜下对培养24 h的菌株进行个体形态观察从中挑选出透明圈明显,有明显乳酸菌菌落形态的观察发现菌株革兰氏染色呈阳性,镜下细胞形态为杆状,排列方式有单个、成对或链状排列,不产芽孢,结果见图4。

图3 植物乳杆菌的菌落形态Fig.3 Colonial morphology of Lactobacillus plantarum
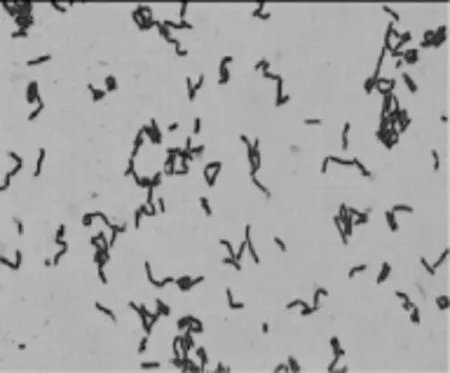
图4 植物乳杆菌的细胞形态Fig.4 Cells morphology of Lactobacillus plantarum
(2)菌株生理生化特性
根据《伯杰细菌鉴定手册》和《乳酸细菌分类鉴定及实验方法》[22]中乳酸菌的鉴别特征,并结合生理生化特性的试验。植物乳杆菌及Z1-Z14生理生化特性见表2。由表2可知,Z1等14株菌株的生理生化鉴定结果与植物乳杆菌相同,表明其均属于植物乳杆菌。

表2 菌株Z1-Z14菌株鉴定结果Tab le 2 Identification results of strain Z1-Z14
2.2.3 酵母菌的鉴定
(1)酵母菌菌落形态和显微形态观察
分离得到的14株菌株J1-J14,经菌落形态观察,在麦芽汁琼脂培养基平板和PDA培养基平板上菌落呈乳白色,圆形,表面湿润光滑,不透明,黏稠,有光泽,中间凸起明显,边缘整齐,易挑起,打开平板后可闻到较强的发酵香气,结果见图5。
显微镜下对培养48 h的菌株进行个体形态观察,镜下细胞形态为球形或卵圆形,大小均匀,无性生殖有各种出芽生殖方式,包括单端出芽,两端出芽和三边出芽,该菌株无树状假菌丝,产子囊孢子,不产掷孢子,根据以上特征可初步将此菌株归为酵母菌属,结果见图6。
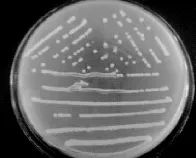
图5 酿酒酵母的菌落形态Fig.5 The colonial morphology of Saccharomyces cerevisiae

图6 酿酒酵母的细胞形态Fig.6 Cells morphology of Saccharomyces cerevisiae
(2)菌株生理生化特性

表3 菌株J1-J14鉴定结果Table 3 Identification results of strain J1-J14
根据《酵母菌特征及鉴定手册》和《真菌鉴定手册》中酵母菌的鉴别特征,结合形态学特征并进行常规的生理生化特性试验,J1等14株菌株的生理生化鉴定见表3。依据表3结果可初步判定为酵母菌,应用全自动细菌及药敏分析系统鉴定,与标准酿酒酵母菌株符合率达93%,为使鉴定更精确还通过rDNA的18S序列进行鉴定符合率达99%,从而确定菌种为酿酒酵母。
3 结论
本实验采用微生物分离纯化技术从不同纳豆、酒曲、酸菜样品中各分离24株菌、20株菌、20株菌。经形态学观察、生理生化试验和分子生物学鉴定初步确定出16株纳豆芽孢杆菌,14株植物乳杆菌,14株酿酒酵母。
[1]郑军红,孙合美,谷巍.发酵饲料在养殖业中的研究应用及发展前景[J].饲料与畜牧,2013(3):39-41.
[2]张和平.我国益生乳酸菌及益生发酵乳研究开发现状及发展对策[J].中国乳业,2009(8):50-52.
[3]赵红霞,詹勇,许梓荣.乳酸菌的研究及其应用[J].江西饲料,2003(1):9-12.
[4]LEUSCHNER R G K,BEW J,COEURET V,et al.A collaborative study of a method for the enumeration of probiotic Lactobacilli in animal feed [J].Food Microbiol,2003,20(1):57-66.
[5]黄沧海,谯仕彦,李德发,等.饲用乳酸杆菌菌种益生特性的选育[J].黑龙江畜牧兽医,2005(2):21-23.
[6]薛冬琳,殷若新,庄俊峰.饲用芽孢杆菌在当前畜牧业中的应用[J].山东家禽,2004(12):34-36.
[7]何东东,张坤生.产朊假丝酵母的发酵及功能性研究[D].天津:天津商业大学硕士论文,2010.
[8]何剑丹,龙炳清,刘长根.光合细菌的应用现状与前景[J].四川师范大学学报:自然科学版,2005,25(l):11-16.
[9]姜文侠,史连生.饲用微生态制剂-益生素[J].动物科学与动物医学,2000,17(2):57-60.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11]周长林.微生物学实验与指导[M].北京:中国医药科技出版社,2003.
[12]马明,杜金华,王因,等.一株产纳豆激酶菌株的分离筛选及鉴定[J].食品与发酵工业,2007,33(5):37-41.
[13]李立民,惠洪文,郭军,等.纳豆激酶生产菌的定向筛选[J].内蒙古农业大学学报,2002,23(4):107-109.
[14]方祥,周换彩,王忠霞,等.纳豆菌分离、鉴定及纳豆激酶高产菌株的正向选育[J].食品与发酵工业,2005,31(12):26-29.
[15]杨艳燕,李顺意,高尚,等.豆豉中纳豆杆菌的筛选和纳豆激酶的初步分离[J].沈阳药科大学学报,2001,18(6):436-438.
[16]朗亚军,隋海澜,于育玲,等.纳豆枯草杆菌的分离鉴定及发酵条件优化[J].大连轻工业学院学报,2005,24(1):12-14.
[17]李荣福.信阳民间传统米酒微生物的分离及鉴定[J].郑州工程学院学报,2004,25(4):63-64.
[18]王丽敏,李军,胡小松.苹果原料中酵母菌的分离鉴定[J].中国农业大学学报,2004,9(4):14-17.
[19]布坎南R E,吉本斯NE.伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[20]杨明,董超,史延茂,等.纤维蛋白平板法测定纳豆激酶方法的改进[J].中国酿造,2008,27(7):77-80.
[21]巴尼特,佩恩·亚罗.胡瑞卿译.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[22]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1991.
Isolation and identification of microorganism for fermented feed
YU Hansong1,XIN Yingxue1,ZHANG Jie2,LI Zhuolin2,LI Tiezhu2*
(1.College of Food Science and Engineering,Jilin Agricultural University,Changchun 130118,China; 2.Institue of Agro-Food Technology,Jilin Academy of Agricultural Sciences,Changchun 130124,China)
16 strains of Bacillus natto were screened from 24 kinds of natto powder,fresh natto and fermented soybean,14 strains of Saccharomyces cerevisiae were screened from 20 species of distiller's yeast,and 14 strains of Lactobacillus plantarum were screened from 20 kinds of pickled Chinese cabbage.The colony characteristics,bacteria morphology and physiological-biochemical characteristic were observed and identified.The experiment was in order to provide experimental basis to the production and application of composite probiotic fermented feed.
Bacillus natto;Saccharomyces cerevisiae;Lactobacillus plantarum;screening;identification
Q93-331
A
0254-5071(2015)03-0058-04
10.11882/j.issn.0254-5071.2015.03.013
2015-01-21
吉林省重大科技攻关专项(20140203014NY);国家自然科学基金青年科学基金(31101245);吉林省自然科学基金项目(20150101087JC)资助;吉林省科技发展计划项目(20140204051YY)资助
于寒松(1979-),男,副教授,博士,研究方向为食品科学。
*通讯作者:李铁柱(1978-),男,副研究员,博士,研究方向为食品微生物。

