改进的QuEChERS 方法结合液相色谱-串联质谱法测定腐竹和豆干中的二甲基黄和二乙基黄
范素芳, 李 强 , 马俊美, 李 挥, 张 岩
(河北省食品检验研究院,河北省食品安全重点实验室,河北 石家庄050091)
二甲基黄、二乙基黄为偶氮类染料,其中二甲基黄又叫对二甲氨基偶氮苯或二甲氨基偶氮苯,常作为酸碱指示剂、非水溶液滴定指示剂及用于胃液中游离盐酸的测定[1],二甲基黄还用于铱[2]、碘[3]、铜[4]等元素的测定;二乙基黄作为染剂常添加于汽油、柴油、蜡油、油墨、塑料等物质中。2014 年台湾的“毒豆干”事件将二甲基黄、二乙基黄推到了食品安全的风口浪尖,再次给我们的食品安全敲响了警钟。张协光等[5]建立了食品中苏丹橙G、二甲基黄、苏丹黑B 的固相萃取-超高效液相色谱-串联质谱方法,样品经含10% 乙醇的丙酮溶液提取,MAX 强阴离子交换固相萃取柱净化,二甲基黄的检出限为1.0 μg/kg。但该方法操作比较繁琐。更多关于二甲基黄、二乙基黄测定的方法未见报道。因此开发二甲基黄、二乙基黄快速测定的方法很有必要。
QuEChERS 方法是Anastassiades 等[6]于2003年提出。该方法具有快速、简单、便宜、高效、可靠和安全等特点。QuEChERS 方法适用于不含脂肪的食物(脂肪含量低于2%,如水果、蔬菜)和低脂肪的食物(脂肪含量2% ~20%,如牛奶、鸡蛋和油梨)[7]。近年来,QuEChERS 方法已经广泛应用于蔬菜、水果中农药残留检测及水产品中兽药的分析测定[8-10]。
本实验建立了基于QuEChERS 方法结合液相色谱-串联质谱快速测定腐竹、豆干中甲基黄和二乙基黄的方法。
1 实验部分
1.1 仪器与试剂
Q-TRAP 5500 液相色谱-质谱联用仪(AB 公司,美国),配有加热电喷雾离子源(H-ESI 源);UFLC 液相色谱系统(岛津公司,日本);Sigma 3K13 离心机(Sigma 公司,德国);涡旋仪(IKA,德国)。
乙腈(色谱纯,Fisher Scientific 公司,美国);NaCl(分析纯,北京化学试剂公司);去离子水由Milli-Q 系统(Millipore 公司,美国)制备;二甲基黄、二乙基黄标准品(纯度≥98.5%,Supelco Analytical 公司);N-丙基二乙胺(primary secondary amine,PSA,Agilent 公司,美国)。
标准溶液的配制:准确称取二甲基黄、二乙基黄标准品10.0 mg(精确至0.01 mg)于10 mL 容量瓶中,用乙腈溶解定容,配制成1 000 mg/L 标准储备液,于-20 ℃保存。用乙腈稀释标准储备液,配制质量浓度为10 mg/L 的标准工作溶液,于4 ℃保存,备用。用空白提取液稀释标准储备液,配制系列质量浓度的基质混合工作液,现配现用。
1.2 提取与净化
分别称取腐竹、豆干样品2.0 g 于50 mL 离心管中,加入5 mL 去离子水,混匀后加入10 mL 乙腈,涡旋混匀1 min;加入1.0 g NaCl、2.0 g 无水硫酸镁,涡旋混匀1 min 后于10 000 r/min 离心5 min;取1 mL 上清液于2 mL 离心管中,加入50 mg PSA,涡旋30 s,于10 000 r/min 下离心1 min;取上清液过0.22 μm 有机滤膜,滤液待测定。
1.3 LC-MS/MS 条件
1.3.1 LC 条件
采用配有Phenomenex C18分析柱(100 mm×2.1 mm,1.7 μm)的超高效液相色谱系统分离分析物,以乙腈(A)和含有0.1% (v/v)甲酸的水溶液(B)为流动相,流速为0.3 mL/min,采用梯度洗脱模式:A 相初始比例为60%,保持1 min;4 min 时A相比例线性增加至90%,保持2 min;6.1 min 时,A相比例降至60%,平衡色谱柱1.9 min。进样量为2 μL,分析时间为8 min。
1.3.2 质谱条件
H-ESI 正离子电离,源温度500 ℃;喷雾电压5 500 V;气帘气流速30 L/min;辅助气1(GS1)流速50 L/min,辅助气2(GS2)流速50 L/min。采用多反应监测(MRM)模式,监测离子及质谱参数见表1。二甲基黄和二乙基黄的化学结构及MRM 谱图见图1。

表1 二甲基黄和二乙基黄的质谱参数Table 1 MS parameters of dimethyl yellow and diethyl yellow
2 结果与讨论
2.1 QuEChERS 方法的改良

图1 二甲基黄和二乙基黄的化学结构及MRM 质谱图Fig.1 Chemical structures and MRM mass spectra of dimethyl yellow and diethyl yellow
QuEChERS 方法最初是针对水果、蔬菜等含水量高于80% 的基质开发的样品处理方法,因此处理含水量低于25% 的样品基质时需要减少称样量并添加一定体积的水以保证待分析物的提取效率[11]。本试验考察了去离子水用量分别为0、2 和5 mL,添加水平为2 μg/kg 时二甲基黄和二乙基黄的回收率,结果见表2。可见,2.0 g 腐竹、豆干样品用5 mL 去离子水浸泡后再用乙腈提取的提取效果更好。原始的QuEChERS 方法为:称取10 g 样品,加入10 mL 乙腈提取,加入4 g 无水硫酸镁和1 g 氯化钠液液分离。本试验将其改进为:在2.0 g 样品中加入5 mL 水浸泡,加入10 mL 乙腈提取,加入2.0 g 无水硫酸镁和1.0 g 氯化钠液液分离。本试验未对无水硫酸镁的用量进行进一步的优化。

表2 不同加水量对不同基质中目标物提取回收率的影响Table 2 Influence of different dosages of water added in the samples on the recoveries of the analytes in different matrices
多壁碳纳米管具有较大的比表面积,所以具有较强的吸附作用可以有效去除色素等干扰物,近年来已经开始应用于农药残留分析中[12-14]。本试验比较了PSA 与多壁碳纳米管的净化效果,其中PSA的用量为每毫升提取液50 mg,多壁碳纳米管的用量为每毫升提取液10 mg。结果表明,多壁碳纳米管对二甲基黄、二乙基黄均有吸附作用,多壁碳纳米管加入时方法的回收率低于20%,这与二甲基黄、二乙基黄的化学结构有关,而且与文献[15]结果(分析物结构中由两个以上环或者带苯并杂环的,用多壁碳纳米管净化时回收率偏低)吻合。所以试验采用PSA 分散固相萃取净化材料进行净化。
2.2 方法验证
2.2.1 基质效应
基质是样品中分析物以外的组分,与分析物共洗脱出的样品基质会干扰分析物的离子化过程,造成离子化抑制或增强,产生基质效应(ME)[16]。基质效应是Paul 和Tang[17]在1993 年研究电喷雾原理时发现的。基质效应会影响方法的检出限、定量限、准确度和精密度等[18]。
二甲基黄、二乙基黄在腐竹和豆干中的基质效应通过溶剂标准溶液和基质匹配标准溶液在线性范围内的斜率比进行评价。按下列公式计算ME:
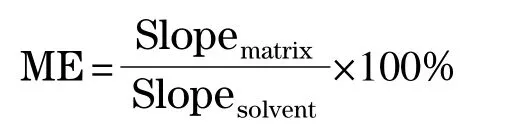
式中:Slopematrix为基质匹配标准曲线的斜率,Slopesolvent为溶剂标准曲线的斜率。
基质效应大于100% 时,表明存在离子化增强效应;基质效应小于100% 时,表明存在离子化抑制效应。二甲基黄、二乙基黄的基质效应见表3。二甲基黄、二乙基黄在腐竹、豆干中的基质效应分别为83.6%、87.2% 和79.7%、71.4%,都为离子化抑制作用,其中豆干中的离子化抑制程度高于腐竹。由于基质效应的存在,我们采用基质匹配的标准溶液来定量以抵消基质效应的干扰。

表3 分析物的保留时间、溶剂标准曲线方程、相关系数、线性范围、基质效应、检出限和定量限Table 3 Retention times,standard curve equations (matrix),correlation coefficients (R2),linear ranges,matrix effects,limits of detection and limits of quantification of the analytes
2.2.2 方法的线性方程、检出限和定量限
本实验采用基质匹配标准曲线定量以补偿基质效应。分别在腐竹、豆干空白提取液中添加标准溶液配制0.01 ~1 μg/L 范围内7 个浓度的基质匹配标准样品,以目标物的定量离子峰面积(Y)为纵坐标,以各组分的质量浓度X(μg/L)为横坐标做标准曲线。二甲基黄、二乙基黄的保留时间分别为4.76 min 和5.05 min,二甲基黄、二乙基黄的线性方程、检出限、定量限见表3。结果表明,二甲基黄在0.03~1 μg/L,二乙基黄在0.01 ~1 μg/L 范围内,两种基质中标准曲线的线性相关系数为0.999 1 ~0.999 8。二甲基黄的检出限(S/N =3)、定量限(S/N=10)分别为0.1 μg/kg 和0.3 μg/kg,二乙基黄的检出限(S/N=3)、定量限(S/N =10)分别为0.05 μg/kg 和0.1 μg/kg。添加水平为1 μg/kg 时,二甲基黄、二乙基黄在腐竹、豆干中的色谱-质谱图分别见图2 和图3。
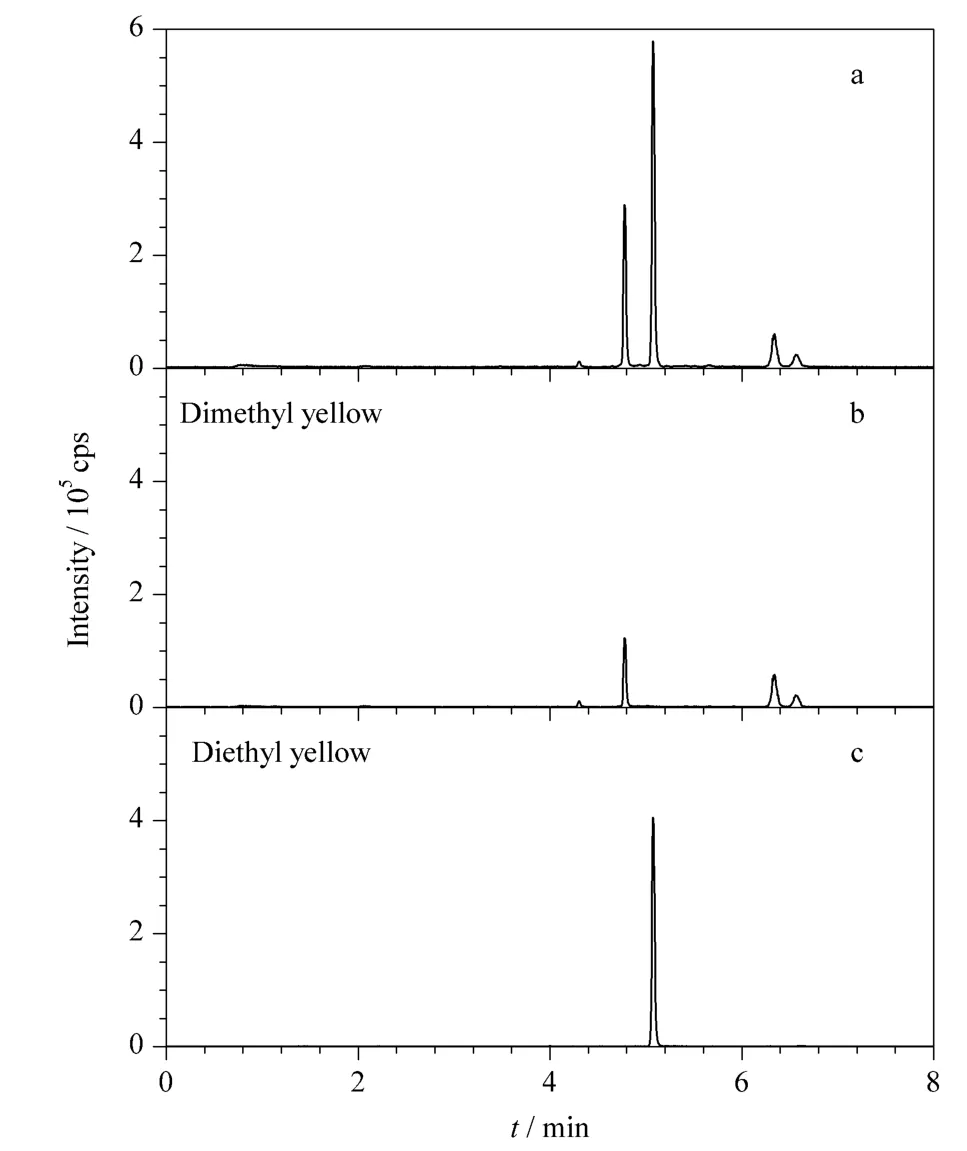
图2 腐竹中二甲基黄、二乙基黄的(a)总离子流和(b,c)MRM 谱图(添加水平1 μg/kg)Fig.2 (a)TIC and (b,c)MRM chromatograms of dimethyl yellow and diethyl yellow spiked in yuba at 1 μg/kg
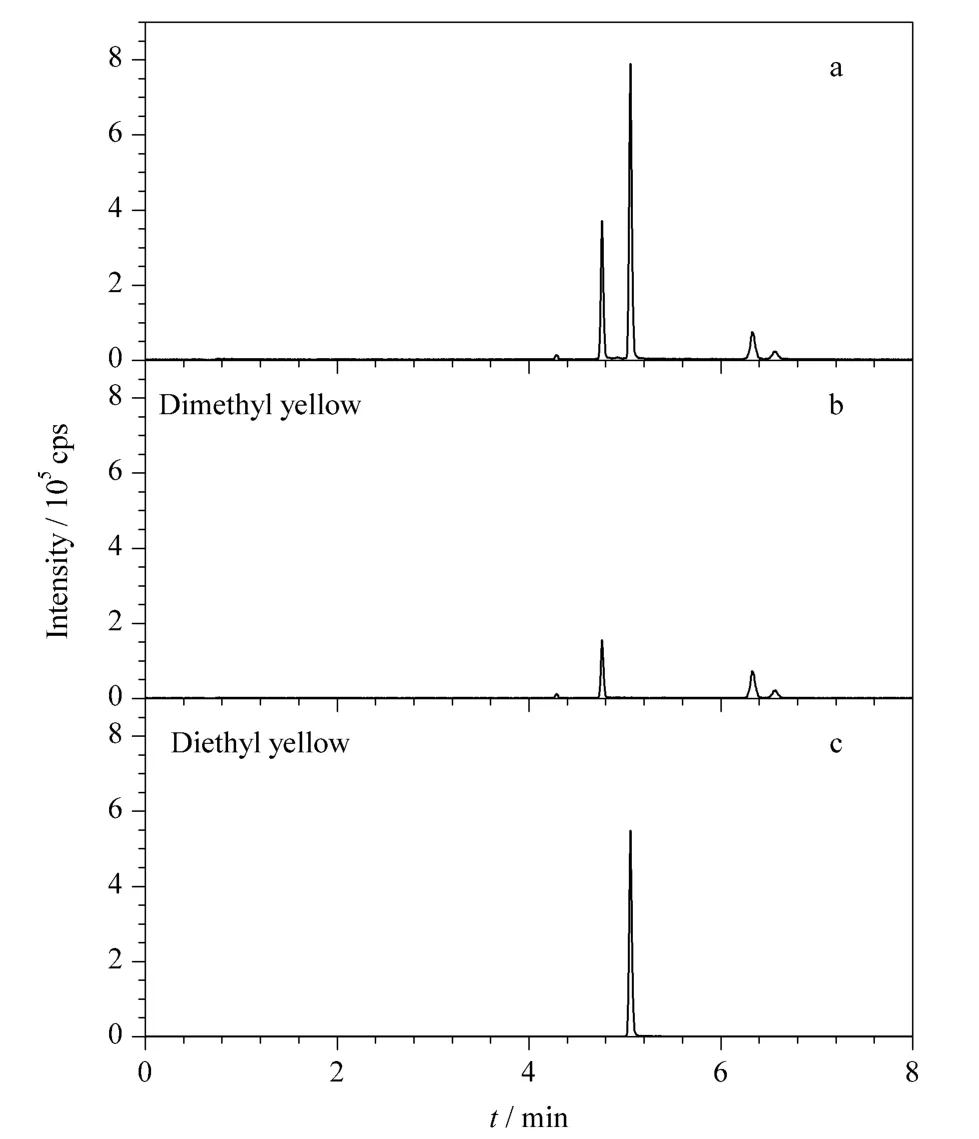
图3 豆干中二甲基黄、二乙基黄的(a)总离子流和(b,c)MRM 谱图(添加水平1 μg/kg)Fig.3 (a)TIC and (b,c)MRM chromatograms of dimethyl yellow and diethyl yellow spiked in dried beancurd at 1 μg/kg
2.2.3 准确度与精密度
方法的准确度用回收率表示。在空白基质中做添加回收试验,二甲基黄的添加水平分别为0.3、1.0 和10.0 μg/kg,二乙基黄的添加水平分别为0.1、1.0 和10.0 μg/kg,每个添加水平重复测定5次。方法的精密度用5 次平行测定的相对标准偏差(RSD)表示。二甲基黄和二乙基黄的加标回收率范围分别为73.5% ~84.5% 和70.5% ~81.2%,RSD 低于11% (见表4)。

表4 空白基质中二甲基黄和二乙基黄的加标回收率和精密度(n=5)Table 4 Recoveries and precisions of dimethyl yellow and diethyl yellow spiked in blank matrices (n=5)
2.3 实际样品的测定
采用本方法对当地超市中购买的10 个腐竹、10个豆干样品中二甲基黄、二乙基黄的含量进行了检测,结果在1 个豆干中检出二甲基黄,但含量低于定量限;其他样品中均未检出目标物。
3 结论
建立了基于改进的QuEChERS 方法结合液相色谱-串联质谱测定腐竹、豆干样品中二甲基黄和二乙基黄的方法。该方法净化效果好,准确度、精密度、检出限、定量限满足测定要求。该方法可用于腐竹、豆干中二甲基黄和二乙基黄的快速筛查和定量分析。
[1] ChemMade.com. Dimethyl yellow (中国化工制造网. 二甲基黄). (2014-05-28)[2015-02-01]. http:// baike. haosou.com/doc/6850624.html
[2] Yang M H,Yang X R,Guo J,et al. Chinese Journal of Analysis Laboratory (杨明惠,杨孝容,郭洁,等. 分析试验室),2003,22(5):76
[3] Han C X,Feng S C. Physical Testing and Chemical Analysis Part B:Chemical Analysis (韩长秀,冯尚彩. 理化检验-化学分册),2004,40(7):384
[4] Wang A X,Han C X. Metallurgical Analysis (王爱香,韩长秀. 冶金分析),2005,25(1):55
[5] Zhang X G,Zeng Y T,Li Y L. Guangdong Chemical Industry(张协光,曾泳艇,黎永乐. 广东化工),2012,39(1):109
[6] Anastassiades M,Lehotay S,Stajnbaher D,et al. J AOAC Int,2003,86(2):412
[7] Yi J H,Duan Z J,Fang G Z,et al. Journal of Chinese Institute of Food Science and Technology (易江华,段振娟,方国臻,等. 中国食品学报),2013,13(2):153
[8] Wang L Z,Zhou Y,Chen Y,et al. Chinese Journal of Chromatography (王连珠,周昱,陈泳,等. 色谱),2012,30(2):146
[9] Lin T,Shao J L,Liu X Y,et al. Chinese Journal of Chromatography (林涛,邵金良,刘兴勇,等. 色谱),2015,33(3):235
[10] Zheng L,Wu Y J,Zhao Y F,et al. Chinese Journal of Chromatography (郑玲,吴玉杰,赵永锋,等. 色谱),2014,32(8):867
[11] Liu X L,Li X S,Liu S W,et al. Chinese Journal of Analytical Chemistry (刘晓亮,李雪生,刘绍文,等. 分析化学),2014,41(4):553
[12] Liu M M,Kang S,Yao C. Chinese Journal of Pesticide Science (刘满满,康澍,姚成. 农药学学报),2013,15(1):8
[13] Zhao P Y,Wang L,Zhou L,et al. J Chromatogr A,2012,1225:17
[14] Zhao P Y,Wang L,Luo J H,et al. J Sep Sci,2012,35:153
[15] Zhao P Y,Huang B Y,Li Y J,et al. J Agric Food Chem,2014,62:3710
[16] Fan S F,Wang X P,Li P W,et al. J Sep Sci,2011,34:640
[17] Paul K,Tang L. Anal Chem,1993,65(22):972A
[18] Xiang P,Shen M,Zhuo X Y. Journal of Instrumental Analysis (向平,沈敏,卓先义. 分析测试学报),2009,28(6):753

