哺乳期大鼠甲状腺功能及自身抗体变化的研究
孙盟朝 乔潇 王帆 梁钰涵 乔欣 陈钊 张媛 林来祥
·论著·
哺乳期大鼠甲状腺功能及自身抗体变化的研究
孙盟朝 乔潇 王帆 梁钰涵 乔欣 陈钊 张媛 林来祥
目的观察正常Wistar大鼠哺乳期不同阶段甲状腺功能及自身抗体的变化规律。方法SPF/VAF级健康成年雌性Wistar大鼠40只,按随机数字法分为:对照组、哺乳早期组、哺乳中期组、哺乳晚期组,每组各10只。后3组雌鼠与雄鼠合笼成功交配后,分别于哺乳7 d、14 d、20 d对雌鼠收集尿液、股动脉放血处死,对照组与哺乳中期组同批处理。过硫酸铵消化-砷铈催化分光光度法测定尿碘浓度,化学发光免疫分析法测定总T3、总T4、游离T3、游离T4、促甲状腺激素(TSH)水平,放射免疫分析法测定甲状腺球蛋白(Tg)、甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)水平。结果与对照组相比,哺乳早期、中期、晚期组尿碘水平依次降低(χ2=17.600,P<0.05)。对照组总T3水平高于哺乳早期、中期和晚期组(F=42.613,P<0.01)。哺乳中期组总T4水平低于对照组、哺乳早期和晚期组(F=4.582,P<0.05)。对照组游离T3、游离T4水平均高于哺乳早期、中期、晚期组(F=7.264,14.434,P均<0.05)。哺乳早期、中期、晚期组TSH水平有上升趋势,且早期、中期组高于对照组(χ2=8.800,P<0.05)。哺乳晚期Tg水平高于对照组(F=3.121,P<0.01)。与对照组相比,哺乳期3组TgAb水平依次降低(F=12.556,P<0.01)。4组间TPOAb水平均无统计学差异(F=1.416,P>0.05)。结论Wistar大鼠甲状腺功能在哺乳期的变化规律与人体大致相同,但相对滞后。而甲状腺自身抗体的变化与人体相比存在差异。
哺乳期;甲状腺功能;自身抗体;大鼠
甲状腺激素具有促进机体、尤其是骨骼和中枢神经系统正常生长发育和组织分化的作用。而碘是合成甲状腺激素的基本原料。哺乳期妇女是碘缺乏的敏感人群,对于全母乳喂养的婴幼儿,碘元素的唯一来源是从母体中摄取。哺乳期碘缺乏不但会影响母体自身甲状腺功能,更会导致婴幼儿甲状腺激素合成不足,造成不可逆的智力损害。此外,母体分娩后抗体水平也会发生变化,抗甲状腺球蛋白抗体(TgAb)和抗甲状腺过氧化物酶抗体(TPOAb)已成为产后甲状腺功能异常的危险因素和监测指标。因此,哺乳期妇女的碘营养、甲状腺功能及自身免疫状态应受到特殊关注。
目前,哺乳期特异性甲状腺功能正常参考值范围的建立尚未得到足够重视,是否及何时进行激素干预仍存在争议,大鼠与人体在产后甲状腺功能变化及所致疾病的相关性尚不明确,同时也缺乏动物方面的实验研究和参考资料。因此,本实验通过研究哺乳期大鼠甲状腺功能和自身抗体的变化规律,与人体相对比,以期探讨大鼠能否作为研究以上问题的动物模型,从而为人体干预研究提供依据。
1 材料与方法
1.1 实验动物与分组 选用体重220~260 g的健康成年Wistar大鼠雌性40只,雄性10只。购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2012-0004,属SPF/VAF级动物。大鼠在天津医科大学动物中心[编号:SYXK(津)2004-0001]饲养,雌、雄分开,置于不锈钢笼具内,饲养于温度和湿度恒定的动物室内,室内平均温度26℃,平均湿度50%,光照与黑暗时间各为12 h,定期对笼具进行清洗和室内消毒,动物自由进食和饮水。大鼠均饲以普通鼠饲料(平均碘含量为300 μg/kg)、自来水(碘含量为10 μg/L)。根据大鼠平均进食量(20 g/d)及饮水量(30 ml/d)计算平均总碘摄入量为6.3 μg/d。适应性喂养10 d后,将雌鼠以随机数字法分为4组:对照组、哺乳早期组、哺乳中期组、哺乳晚期组,每组各10只。后3组雌鼠与雄鼠1∶1合笼(对照组雌鼠不参与交配,留作非哺乳期正常对照),次日晨查到阴栓记为孕0 d,后3组雌鼠分别饲养至哺乳7 d、14 d、20 d,采用代谢笼收集尿液、股动脉放血处死,对照组与哺乳中期组同批处理。股动脉血静置1 h,3 000 r/min(r=16.24 cm),离心15 min,分离血清。取材标本于-80℃保存备用。
1.2 检测指标的测定
1.2.1 大鼠尿碘水平的测定 过硫酸铵消化-砷铈催化分光光度法测定尿碘浓度。
1.2.2 大鼠甲状腺功能的测定 采用化学发光免疫分析法及德国Bayer试剂盒,测定大鼠血清总T3、总T4、游离T3、游离T4、促甲状腺激素(TSH)浓度,样品测定及数据读取处理由德国拜尔公司自动化学发光分析系统完成。
1.2.3 大鼠甲状腺自身抗体及甲状腺球蛋白(Tg)水平的测定 采用放射免疫分析法测定Tg 浓度、TgAb (P-N)/T比值、TPOAb P/T%比值,试剂盒购自北京北方生物技术研究所。

2 结果
2.1 尿碘水平 与对照组相比,哺乳早期、中期、晚期组尿碘浓度依次降低,且哺乳晚期组与对照组间差异有统计学意义(P<0.05),见表1。
2.2 甲状腺功能 哺乳早期、中期、晚期组总T3水平均低于对照组(P<0.01),且哺乳中期组低于哺乳早期组(P<0.01)和哺乳晚期组(P<0.05)。哺乳中期组总T4水平低于对照组、哺乳早期组(P<0.05)及晚期组(P<0.01)。哺乳早期、中期组游离T3水平低于对照组(P<0.01),且哺乳中期组低于晚期组(P<0.05)。与对照组相比,哺乳早期、中期、晚期组游离T4水平依次降低(P<0.01),且哺乳早期和晚期组之间差异有统计学意义(P<0.05)。与对照组相比,哺乳早期、中期、晚期TSH水平有上升趋势,且哺乳早期、中期组与对照组之间差异有统计学意义(P<0.05),见表1。
2.3 Tg及甲状腺自身抗体水平 相对于对照组,哺乳期Tg水平依次升高,哺乳晚期组明显高于对照组(P<0.01)。TgAb水平有随哺乳期延长而逐渐下降的趋势,且3组与对照组相比均有统计学差异(P均<0.01)。TPOAb水平4组间无统计学差异(P均>0.05),见表1。
3 讨论
碘是合成甲状腺激素的基本原料,分娩后母体内的碘元素不仅要满足自身需要,更要通过哺乳使新生儿获得足够的碘,因此哺乳期妇女是碘缺乏的高危人群。人类出生后头半年是大脑发育最重要、生长最迅速的时期,此时碘缺乏将造成婴幼儿不可逆的智力损害和骨骼发育障碍。研究发现,孕期和哺乳期轻度碘缺乏所引起的低甲状腺素血症,可导致小脑颗粒细胞前体增殖和浦肯野细胞树突生长发育受抑制,造成后代神经发育和运动功能障碍,这种发育的障碍即使在后期给予治疗也是不可逆转的[1]。
尿碘浓度是评价机体碘营养水平的良好指标。有研究发现,即使在平均尿碘水平达到250 μg/L的哺乳期人群中,仍有约16%的个体尿碘浓度<100 μg/L,8%的个体存在1度甲状腺肿,另有8%的个体存在2度甲状腺肿[2]。在轻度碘缺乏地区,哺乳期妇女尿碘水平明显偏低,尿碘水平在100 μg/L以下的个体可占到56.8%[3]。哺乳期妇女尿碘浓度降低与甲状腺功能减退症相关,并且尿碘浓度可独立预测长期甲状腺功能减退症;而尿碘升高则容易诱发产后甲状腺炎[4-5]。此外,母体的碘营养水平直接影响乳汁中甲状腺激素水平,而且这种影响早于母体血中甲状腺激素的变化[6]。研究表明,母乳中游离T3、T3、T4和TSH的含量与血清中的含量显著相关,游离T3的透过率高达78%,母体血中的甲状腺激素可以进入乳汁,母乳可以从一定程度上为婴儿补充机体所需的甲状腺激素[7]。美国国家科学院和甲状腺协会对哺乳期妇女每日推荐碘摄入量为 290 μg,建议哺乳期间服用碘盐或碘油以保证充足的碘摄入,使母体及其子代达到最佳的碘营养状态[8-9]。国外动物实验表明哺乳期母鼠碘缺乏时,仔鼠尿碘浓度下降,血中T4水平也会降低14%~52%,并影响其成年后大脑海马区功能[10]。本实验中,与对照组大鼠尿碘水平相比,哺乳期尿碘水平逐渐下降,且哺乳晚期组明显低于对照组。考虑哺乳期母鼠因乳汁喂养丢失碘,导致体内碘储备明显不足,这一结果与哺乳期饮食中额外补充碘剂的主张一致。
女性在孕哺期体内激素和代谢会发生一系列变化,而甲状腺功能和激素水平也会发生相应改变。妊娠时高雌激素水平刺激肝脏合成大量甲状腺结合球蛋白,使整个孕期总T3、总T4水平均高于非孕期。产后由于雌激素水平下降,甲状腺结合球蛋白合成减少,于产后3~4 d开始下降,总T3、总T4也逐渐恢复至正常水平[11]。相对于本实验,哺乳期总T3、水平总体呈下降趋势。但值得注意的是,哺乳晚期组总T3、总T4水平均明显高于哺乳中期组,分析其原因为:前期动物实验发现人绒毛膜促性腺激素(hCG)在哺乳中期的浓度高于哺乳期和哺乳晚期组。而hCG与TSH有相同的α亚单位、相似的β亚单位和受体亚单位,其与TSH水平成镜像关系,与游离T4水平呈正相关。本实验中哺乳中期升高的hCG对TSH有竞争性抑制作用,使TSH水平降低,导致总T3、总T4浓度随之下降。随着哺乳晚期hCG抑制作用的解除,TSH和总甲状腺激素出现反跳性升高。目前对妊娠期血清游离T3、游离T4及TSH水平变化的认识比较统一,即在孕期内随着孕周延长,游离T3、游离T4逐渐降低,TSH逐渐升高。哺乳期妇女甲状腺功能仍低于正常,甲状腺体积小于产时[12]。另有研究发现,孕期升高的TSH在分娩后3~4 d达到最高值,而后逐渐下降;甲状腺结合球蛋白于产后4 d左右开始下降,游离T3、游离T4水平也于此时开始上升,但至产后4个月时游离T4仍低于正常水平,且与游离T3水平呈正相关[13-14]。本实验中随哺乳期延长,TSH水平逐渐下降,游离T3水平逐渐升高,但直到晚期仍未恢复至对照组水平。各组游离T4水平有下降趋势,考虑原因为:(1)哺乳晚期hCG水平的明显降低不足以维持游离T4的继续升高。(2)哺乳期母鼠所食普通饲料引起碘摄入相对不足,导致甲状腺激素合成减少。这一甲状腺功能变化与前述母鼠因哺乳造成的碘水平降低相符。以上实验结果表明,哺乳期大鼠甲状腺激素水平与人体相比恢复趋势不明显,激素变化较人体相对滞后,因此在大鼠哺乳晚期,各激素仍未恢复至正常水平。
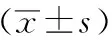
表1 各组大鼠尿碘、血清甲状腺激素、Tg及甲状腺自身抗体水平比较
注:尿碘及TSH以M表示;与对照组相比,aP<0.05,bP<0.01;与哺乳早期组相比,cP<0.05,dP<0.01;与哺乳中期组相比,eP<0.05;TSH:促甲状腺激素;Tg:甲状腺球蛋白;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体
Tg是由正常甲状腺滤泡上皮细胞合成的大分子碘化糖蛋白,相对于TSH、T3、T4,Tg能够更早、更敏感的反映机体碘营养状态[15]。本实验大鼠哺乳期Tg与对照组相比依次升高,且哺乳晚期组明显高于对照组,与尿碘水平表现相吻合,印证了母鼠产后存在碘缺乏。另一方面,Tg和甲状腺过氧化物酶作为自身免疫性疾病的抗原,可刺激机体免疫系统产生TgAb和TPOAb,这两种抗体是甲状腺自身免疫功能紊乱的重要标志。TPOAb和TgAb阳性的孕哺期妇女患临床(亚临床)甲状腺功能减退症、产后甲状腺炎等的风险大大增加,且TPOAb滴度与病情的严重程度相关。妊娠期间母体细胞免疫和体液免疫均受抑制,抗体浓度下降甚至消失,以使与母体免疫原不同的胎儿存活。分娩后抑制作用消失,自身抗体水平恢复,在产后3个月明显增加,出现暂时性免疫反弹,于产后6个月恢复到妊娠前水平。多数学者认为,正是这种免疫反弹导致甲状腺滤泡急剧破坏,临床上出现一过性甲状腺功能亢进症,继而出现甲状腺功能减退症,使甲状腺免疫异常在产后显性化[16]。本实验中,对照组、哺乳早期、中期、晚期组TgAb水平依次降低,且哺乳期各组与对照组间差异有统计学意义。但与人体相比,并未出现上述免疫反弹的现象。哺乳期各组TPOAb水平与对照组相比,差异缺乏统计学意义。考虑其原因为:自身免疫性甲状腺炎的发病受遗传、免疫系统、个体易感性和外环境等多种内外因素影响,孙富军等[17]研究表明Wistar大鼠为自身甲状腺炎非易感品系,其诱发甲状腺炎的反应及血清抗体水平变化不明显,故本实验Wistar大鼠可能不适合作为研究产后甲状腺炎等自身免疫性甲状腺疾病的动物模型,可以选取自身免疫性甲状腺炎易感品系如Lewis大鼠作为相关研究的动物载体。
综上所述,Wistar大鼠甲状腺功能与人体哺乳期变化规律大致相同,但相对滞后。大鼠哺乳期甲状腺自身抗体变化与人体相比存在差异。因此,可以考虑将大鼠作为研究哺乳期甲状腺功能异常改变及是否予以干预的动物模型,而其是否适合用于产后抗体水平变化和自身免疫性甲状腺疾病的相关研究还有待进一步验证。
[1] 王园.孕期和哺乳期轻度碘缺乏导致低甲状腺素血症损伤仔鼠小脑神经发育及其机制研究[D].沈阳:中国医科大学,2014:35-57.
[2] Morse NL.Benefits of docosahexaenoic acid, folic acid, vitamin D and iodine on fetal and infant brain development and function following maternal supplementation during pregnancy and lactation[J].Nutrients,2012,4(7):799-840.
[3] Yaman AK,Demirel F,Ermis B,et al.Maternal and neonatal urinary iodine status and its effect on neonatal TSH levels in a mildly iodine-deficient area[J].J Clin Res Pediatr Endocrinol,2013,5(2):90-94.
[4] Stuckey BG,Kent GN,Allen JR,et al.Low urinary iodine postpartum is associated with hypothyroid postpartum thyroid dysfunction and predicts long-term hypothyroidism[J].Clin Endocrinol(Oxf),2011,74(5):631-635.
[5] Yarrington CD,Pearce EN.Dietary iodine in pregnancy and postpartum[J].Clin Obstet Gynecol,2011,54(3):459-470.
[6] Todini L,Salimei E, Malfatti A,et al.Thyroid hormones in milk and blood of lactating donkeys as affected by stage of lactation and dietary supplementation with trace elements[J].J Dairy Res,2012,79(2):232-237.
[7] 张茜, 连小兰, 柴晓峰,等.甲状腺疾病患者乳汁与血清中甲状腺激素水平的关系[J]. 中国医学科学院学报,2013,35(4):427-431.
[8] Council on Environmental Health,Rogan WJ,Paulson JA,et al.Iodine deficiency,pollutant chemicals,and the thyroid:new information on an old problem[J]. Pediatrics,2014,133(6):1163-1166.
[9] Mekrungcharas T,Kasemsup R.Breast milk iodine concentrations in lactating mothers at Queen Sirikit National Institute of Child Health[J].J Med Assoc Thai,2014,97(Suppl 6):S115-S119.
[10] Fisher JW,Li S,Crofton K,et al.Evaluation of iodide deficiency in the lactating rat and pup using a biologically based dose-response model[J].Toxicol Sci,2013, 132(1):75-86.
[11] Gaberek S, Zaletel K.Thyroid physiology and autoimmunity in pregnancy and after delivery[J].Expert Rev Clin Immunol,2011,7(5):697-707.
[12] 杨丽芬,冯宝香,王珉,等.吉林省孕妇和哺乳妇女碘营养水平及甲状腺功能调查[J].中国地方病防治杂志,2012,27(6):446-449.
[13] Kurioka H,Takahashi K,Miyazaki K.Maternal thyroid function during pregnancy and puerperal period[J].Endocr J,2005,52(5):587-591.
[14] Fister P,Gaberscek S,Zaletel K,et al.Thyroid function in the third trimester of pregnancy and after delivery in an area of adequate iodine intake[J].Int J Gynaecol Obstet,2011,112(1):52-55.
[15] Ma ZF, Skeaff SA.Thyroglobulin as a biomarker of iodine deficiency: a review[J].Thyroid,2014,24(8):1195-1209.
[16] 楼寒钰,吴艺捷.产后甲状腺炎发病机制的研究进展[J].医学综述,2010,16(9):1382-1385.
[17] 孙富军,赵树君,田恩江,等.碘对易感性不同大鼠诱发自身免疫性甲状腺炎的影响[J].中国地方病学杂志,2005,24(3):251-254.
Changesinthyroidfunctionandautoantibodiesduringlactationofrats
SunMengzhao*,QiaoXiao,WangFan,LiangYuhan,QiaoXin,ChenZhao,ZhangYuan,LinLaixiang.
*KeyLaboratoryofHormonesandDevelopment,MinistryofHealth,TheInstituteofEndocrinology,TianjinMedicalUniversity,Tianjin300070,China
LinLaixiang,Email:linlaixiang2005@126.com
ObjectiveTo observe the changes of thyroid function and autoantibodies in each trimester of lactation in normal Wistar rats.MethodsForty healthy female adult SPF/VAF weaning Wistar rats were divided into 4 groups according to a random number table: control group, the early lactation group, the mid lactation group and the late lactation group, with 10 rats in each group. Female rats of the last three groups were mated with male rats. Urine samples of female rats were collected and blood samples were collected by exsanguination from femoral artery on the 7th, 14th and 20th day of their lactation, respectively. Rats in control group and mid lactation group were treated at the same time.Urinary iodine concentration(UIC) was determined by As3+-Ce4+catalytic spectrophotometry using ammonium persulfate digestion.Serum total T3, total T4, free T3, free T4and thyroid stimulating hormone (TSH) were measured by chemiluminescence immunoassay. Serum thyroglobulin (Tg), thyroglobulin antibody (TgAb) and thyroid peroxidase antibody (TPOAb) were determined by radioimmunoassay.ResultsCompared with control group, UIC in the early,mid and late lactation group were decreased in sequence (χ2=17.600,P<0.05).Total T3level of control group was increased compared with the early ,mid and late lactation group (F=42.613,P<0.01).Total T4level of the mid lactation group was decreased compared with control, early and late lactation group (F=4.582,P<0.05). Free T3and free T4level of control group were increased compared with early,mid and late lactation group (F=7.264, 14.434, allP<0.05).TSH in the early, mid, late lactation group had a trend to increase. TSH level of the early, mid lactation group were increased compared with control group(χ2=8.800,P<0.05).Tg in the late lactation group was increased compared with control group (F=3.121,P<0.01).Compared with control group, TgAb in all lactation groups were decreased(F=12.556,P<0.01).There was no significant difference of TPOAb among all groups(F=1.416,P>0.05).ConclusionThyroid function in Wistar rats is similar to that of human, but the changs lag. While there are differences of thyroid autoantibodies between lactating rats and human.
Lactation; Thyroid function; Autoantibodies Rat
(IntJEndocrinolMetab,2015,35:289-292)
10.3760/cma.j.issn.1673-4157.2015.05.001
国家自然科学基金资助项目(30671816);国家级大学生创新创业训练计划资助项目(201310062003)
300070 天津医科大学内分泌研究所,卫生部激素与发育重点实验室(孙盟朝,张媛,林来祥),基础医学院临床七年制(乔潇,王帆,乔欣,梁钰涵,陈钊),生理教研室(张媛)
林来祥,Email:linlaixiang2005@126.com
2015-03-23)

