苏云金芽胞杆菌抗癌晶体蛋白的研究进展
付祖姣, 周 琳, 李 敏, 单世平, 刘清术
(1.长沙医学院 医学检验系,湖南 长沙 410219;2.湖南省微生物研究院,湖南 长沙 410009)
苏云金芽胞杆菌抗癌晶体蛋白的研究进展
付祖姣1,2, 周 琳1, 李 敏1, 单世平2, 刘清术2
(1.长沙医学院 医学检验系,湖南 长沙 410219;2.湖南省微生物研究院,湖南 长沙 410009)
抗癌晶体蛋白(parasporins,PS)是由没有杀虫活性的苏云金芽胞杆菌产生的一种晶体蛋白,在经过蛋白酶酶解后产生的活性多肽对来自人类不同组织的癌细胞具有特异性细胞毒性,而对正常细胞具有较低毒性或不具有毒性,是一种具有很大潜力的微生物抗癌蛋白。就最近几年苏云金芽胞杆菌中已发现的抗癌晶体蛋白的种类、结构特征、细胞活性谱和杀虫机制进行简要概述。
苏云金芽胞杆菌;晶体蛋白;抗癌;细胞毒性
苏云金芽胞杆菌(Bacillusthuringiensis,Bt)是一种分布广泛的革兰阳性细菌。研究发现,它能在芽胞形成的同时产生杀虫晶体蛋白或抗癌晶体蛋白[1-2]。其中,杀虫晶体蛋白对鳞翅目、鞘翅目、双翅目等农林害虫和一些医学害虫具有特异毒杀作用。目前,能够产生杀虫晶体蛋白的Bt菌株已经广泛应用于农、林和医药害虫的生物防治[3-5]。随着对Bt研究的深入,人们在自然环境中筛选出了越来越多的Bt菌株,同时也发现了很多不具有杀虫活性的Bt菌株[6-9],这些不能产生杀虫晶体蛋白的Bt菌株却可能产生抗癌晶体蛋白。抗癌晶体蛋白是近十多年来在Bt菌株中发现的另外一类活性蛋白,该类蛋白不具有杀虫毒力,但经蛋白酶酶解后释放出的活性多肽,能够选择性识别并杀死体外培养的来自人类不同组织的癌细胞或癌变组织切片,而对正常细胞具有很小或不具有毒性[10-11]。自1999年日本学者Mizuki等首次发现第一个具有抗癌活性的Bt菌株至今[12],抗癌Bt菌株的研究不断受到研究人员的重视,在日本、越南、加拿大、马来西亚等国家相继分离到数株产生抗癌晶体蛋白的苏云金芽胞杆菌[13-16]。近年来,又有很多新的抗癌晶体蛋白被发现,几种抗癌晶体蛋白的功能机制也正在被逐步解析。目前Bt菌株产生的抗癌晶体蛋白已经发展为6个群(分别命名为PS1、PS2、PS3、PS4、PS5、PS6),19个亚类(http://parasporin.fitc.pref.fukuoka.jp/list.html)。现就Bt菌株产生的各种抗癌晶体蛋白的结构特点、功能和作用机制做一简要概述。
1 抗癌晶体蛋白结构特点
目前,已经发现15个以上的Bt菌株能产生抗癌晶体蛋白,已鉴定19个抗癌晶体蛋白,其中11个抗癌晶体蛋白属于PS1类,3个属于PS2类,2个属于PS3类,各有1个分别属于PS4、PS5和PS6类,如表1所示。19个蛋白的进化关系如图1所示。各类PS蛋白有各自不同的基本特性,包括大小、活性中心和基本结构特点,见表2所示。
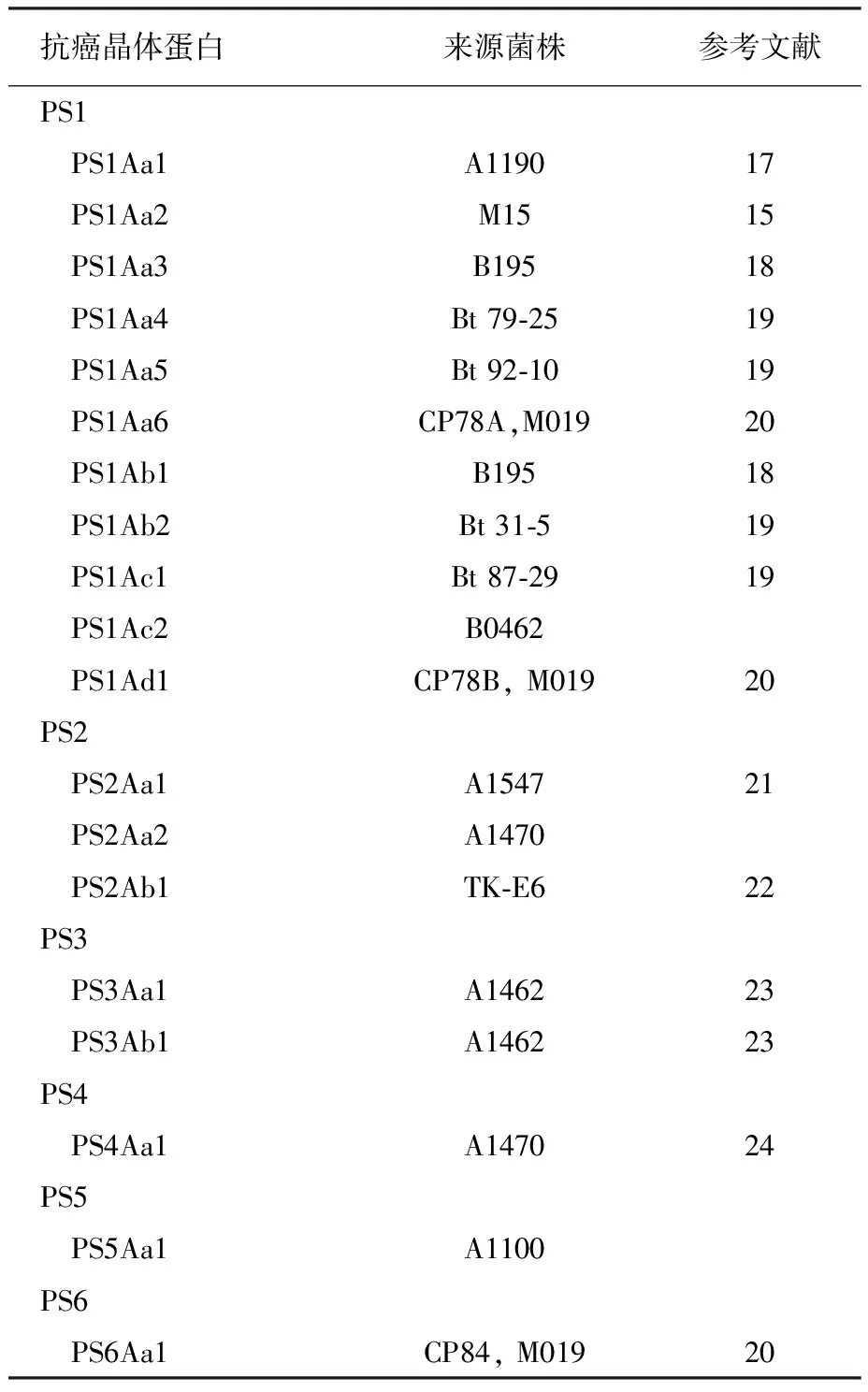
表1 抗癌晶体蛋白的种类及来源
PS1Aa1,也称为Cry31Aa1,是最早发现的一类抗癌晶体蛋白,是由Muziki等2000年从Bt A1190菌株中鉴定到。该蛋白原毒素分子量为81 ku,由723个氨基酸残基组成,具有与Bt菌株产生的杀虫晶体蛋白(Crystal Protein,简称Cry蛋白)类似的典型的3个结构域、5个保守区。但该蛋白与已经鉴定的Cry蛋白和Cyt蛋白的同源性非常低(少于25%)。
PS2Aa1,又称为Cry46Aa1,是由338个氨基酸残基组成的37 ku的多肽。与PS1Aa1不同,PS2Aa1不具有与Cry蛋白类似的典型的结构域,也没有Cry蛋白中常见的保守区。该蛋白除了与Cry15Aa具有很低的同源性外,与其他的Cry蛋白和Cyt蛋白都没有同源性。值得注意的是Cry15Aa与球形芽胞杆菌产生的2种杀蚊虫毒素Mtx2和Mtx3有很高的同源性。对PS2的活性部分进行X-衍射分析,发现该蛋白主要由很多的β-片层结构围绕一个长轴卷曲而成,与凝血素类型的β-穿孔毒素非常类似。该多肽含有3个结构域,结构域1由4个短的a螺旋夹着几个β-片层组成,可能是结合靶标的单位。另外2个结构域都由β-片层结构组成,可能与毒素的寡聚化和穿孔有关。结构域2还有个凝血素型的β-发夹结构,可能是穿孔通道。该蛋白的表面暴露了大量的丝氨酸和苏氨酸侧链,这些侧链可能在结构域1结合靶细胞后,在靶细胞上定向,直到寡聚化和膜穿孔开始形成。

图1 抗癌晶体蛋白PS1~PS6之间的系统进化树Fig.1 Dendrogram of parasporins between the PS1~PS6
PS3Aa1,又称为Cry41Aa1,由825个氨基酸残基组成,分子量93 ku,具有与Cry蛋白类似的典型的3个结构域和5个保守区,但与杀虫的Cry蛋白同源性仍然很低。PS3Aa蛋白与肉毒杆菌产生的血凝素HA-33蛋白非常类似。
PS4Aa1,又称为Cry45Aa1,由275个氨基酸残基组成,分子量31 ku。在该蛋白的一级序列中,没有发现一个常出现在Cry蛋白中的保守区,也没有发现典型的3个结构域。而且,该蛋白与其他的抗癌晶体蛋白和杀虫晶体蛋白同源性均低于30%。
PS5Aa1,由305个氨基酸残基组成,分子量34 ku。该蛋白与Bt finitimus亚种YBT-020和dakota亚种产生的杀蚊虫毒素MTX2有较高同源性(分别为36%和37%),与Cry15Aa有32%的同源性。
PS6Aa1,由753个氨基酸残基组成,分子量84 ku,与具有杀虫活性的Cry2有较低的同源性(21.9%),相似性56.4%,具有典型的3个结构域。

表2 抗癌晶体蛋白的基本特性
注:“-”代表未发现
2 抗癌晶体蛋白的活性
PS1Aa蛋白经胰蛋白酶酶解后产生15和56 ku的活性多肽,两者可能通过形成多肽二聚体对体外培养的多种癌细胞,如宫颈癌细胞HeLa、早幼粒细胞白血病细胞HL-60具有很高的细胞毒力,同时对急性淋巴细胞性白血病细胞系MOLT-4和肝癌细胞HepG2也具有较高毒力,而对正常细胞,如子宫平滑肌细胞UtSMC、淋巴细胞T-cell、肝细胞HC和胚胎肺细胞MRC5却没有任何毒力[17,25]。
PS2Aa原毒素经蛋白酶K酶解后产生30 ku的活性多肽,对急性淋巴细胞性白血病细胞MOLT-4和早幼粒细胞白血病细胞HL-60、肝癌细胞HepG2、子宫内膜癌细胞Sawano和白血病T细胞Jurkat等具有非常高的细胞毒力,而对正常肝细胞HC无毒力,但PS2蛋白对正常细胞UtSMC、T-cell和MRC5仍有低到中等的毒力[21]。
PS3Aa1蛋白经蛋白酶K在N端和C端的消化后,该毒素前体可转化为64 ku的活性多肽,对HL-60和HepG2这2种癌细胞具有中等毒力,而对其他几种检测的癌细胞和正常细胞均没有毒力[23]。
PS4Aa1蛋白经蛋白酶K在C端酶切后产生27 ku的活性多肽,对子宫内膜癌细胞Sawano、急性淋巴细胞性白血病细胞MOLT-4、早幼粒细胞白血病细胞HL-60、宫颈癌细胞TCS和结直肠癌细胞Caco-2具有较高的细胞毒力,对肝癌细胞和正常细胞UtSMC、T-cell和HC的组织切片均未表现毒性[24,28]。
PS5Aa蛋白的细胞活性谱还在研究中。
而PS6Aa经胰蛋白酶在N端消化后产生14和59 ku片段组成的73 ku的活性多肽,对人类肝癌细胞和宫颈癌HeLa细胞具有较高的毒性,对结直肠癌细胞Caco-2和正常肝细胞HC具有很低的活性[20]。
3 抗癌晶体蛋白的抗癌机制
3.1 PS1蛋白
PS1Aa蛋白发挥细胞毒性的途径主要通过诱导靶标细胞内的Ca2+浓度的迅速增加而诱发细胞凋亡[29]。根据Katayama等的研究,与具有杀虫活性的Cry蛋白不同,PS1Aa作用靶标癌细胞后不影响靶细胞膜的通透性,也不能形成膜穿孔,但在作用靶细胞1~3 min内即可引起胞内游离Ca2+浓度大势升高,使胞内蛋白和DNA合成水平整体下降,毒素作用8~10 h后可显著引发细胞病变。靶细胞对PS1Aa的敏感程度与胞内Ca2+浓度增加的程度成正比。而且,PS1Aa作用HeLa细胞8 h内可在细胞内检测到半胱天冬酶-3前体和多聚腺苷二磷酸核糖聚合酶的降解,其中细胞凋亡因子半胱天冬酶-3的浓度随着毒素作用时间延长而增大。此外,该蛋白的抗癌活性能被人工合成的三聚体G蛋白信号通道和半胱天冬酶的抑制剂抑制。这些证据强烈地说明PS1Aa蛋白可能通过诱发靶标癌细胞的凋亡而杀死癌细胞。
3.2 PS2蛋白
Kitada等对PS2蛋白的抗癌机制进行了系统研究,发现该蛋白与PS1蛋白不同,它能特异性结合于肝癌细胞的质膜,并能快速提高细胞膜通透性。当PS2蛋白作用于肝癌细胞HepG2后,能引起胞内外物质的大量出入,并能降解细胞骨架和细胞器,但不会引起线粒体和内质网内的蛋白的外流。该蛋白作用癌细胞的初步机制可能是先通过特异性结合于靶标癌细胞膜上的某种特异受体蛋白,然后在质膜上形成200 ku以上的寡聚体,引起膜通透性增加,形成膜穿孔,使胞内物质外流而导致细胞裂解[30]。值得注意的是,PS2Aa的氨基酸序列与梭菌ε毒素的氨基酸序列存在很大的同源性,后者就是通过在质膜上形成寡聚体引发膜穿孔而发挥细胞毒性的。该蛋白活性部分的X-射线衍射结构也同样支持这种假说。
3.3 PS4蛋白
Okumura等研究发现,PS4作用靶标细胞后,能诱发细胞膨胀、细胞核收缩,膨胀的细胞在24 h内会裂解。该蛋白与杀虫Cry蛋白和β-穿孔型的气单胞菌溶素同源,富含β片层结构,能在靶标癌细胞CACO-2的质膜上形成寡聚体,引发胞内外物质的互流,但不能引发细胞凋亡因子半胱天冬酶-3和半胱天冬酶-7的激活。多个实验表明PS4蛋白是个不依赖胆固醇的独特的β-穿孔毒素,它在能诱发胆固醇消耗的环式糊精的存在下依然表现细胞活性[31]。
3.4 其他抗癌晶体蛋白
PS3Aa蛋白的作用机制还不清楚,初步研究显示该蛋白作用靶标细胞1 h后即可引起细胞膨胀[23]。PS5的抗癌机制还在研究中。PS6蛋白作用靶标癌细胞HepG2和HeLa细胞后,能引起细胞膨胀并在细胞膜上形成穿孔。其作用癌细胞的机制可能与穿孔毒素一致[20]。
另有一种特殊的抗癌晶体蛋白,还未进行系统命名。该蛋白由Krishnan等从马来西亚分离的Bt18菌株产生,经胰酶酶解激活后能产生68和28 ku的蛋白质[16,32],其中,68 ku的蛋白的N端与杀虫晶体蛋白Cry24Aa和Cry25Aa有较高的相似性,而28 ku蛋白质的N端与Cry15Aa具有较高相似性,两者与已发现的PS蛋白未发现相似性。68 ku的蛋白和未进行分离的胰酶酶解片段对白细胞淋巴细胞系CEM-SS表现出了非常高的细胞毒性,但68 ku蛋白的细胞活性比未分离的酶解片段活性降低了20%左右。该蛋白作用CEM-SS细胞的机制是通过该蛋白的活性多肽与CEM-SS细胞质膜上的3-磷酸甘油醛脱氢酶特异性结合而诱导细胞凋亡,从而发挥毒杀癌细胞的作用[32]。最近的研究显示3-磷酸甘油醛脱氢酶是个多功能的酶,在细胞内及细胞膜上均有定位,与细胞癌变和细胞凋亡关系密切[33]。
4 问题与展望
1985年从Bt菌株中获得第一个杀虫晶体蛋白至今,人们已经发现了68大类Cry蛋白和3大类Cyt蛋白,共包括600多个杀虫晶体蛋白(http://www.lifesci.sussex.ac.uk/Home/Neil_Crickmore/Bt/)[34],为农林、医药害虫的生物防治提供了丰富的毒素库。Bt菌株产生的对人类癌细胞有特异细胞毒性,而对正常细胞具有无或低毒力的抗癌晶体蛋白,为癌症的治疗提供了良好选择。抗癌晶体蛋白作为一种潜在的抗癌新药,前景非常广阔。由于Bt抗癌晶体蛋白近年来才受到学术界的关注,导致发现的抗癌晶体蛋白种类相比杀虫晶体蛋白少得多。因为Bt菌株在自然环境中的广泛分布,还有大量的Bt新菌株有待分离鉴定,在这些未鉴定的Bt菌株产生的伴胞晶体中,应该存在更多不同种类、不同细胞活性谱的抗癌晶体蛋白,可为研制特异性抗癌药物提供更多、更有效的选择。
目前,科研工作者已经发现了6大类19种抗癌晶体蛋白。它们或通过诱导细胞凋亡途径,或通过在细胞膜上形成穿孔等途径而导致癌细胞死亡[21]。它们之所以能特异性识别癌细胞可能与癌细胞上特定的受体有关,但目前还只发现CEM-SS细胞膜上的3-磷酸甘油醛脱氢酶是Bt18中68 ku抗癌晶体蛋白的特异受体。其他PS蛋白是否也是通过与靶癌细胞上的3-磷酸甘油醛脱氢酶或者是其他受体结合从而识别癌细胞还有待进一步的研究。此外,PS蛋白进入癌细胞后,逐步引发癌细胞死亡的具体作用途径仍然不够明晰。进一步研究抗癌晶体蛋白作用靶细胞的分子机制,解决其可能对患者产生的免疫学反应及其他副作用,将有助于发展该蛋白成为新型微生物抗癌药物。
[1] Schnepf E, Crickmore N, Van Rie J, et al.Bacillusthuringiensisand its pesticidal crystal proteins[J].Microbiol Mol Biol Rev,1998,62(3):775-806.
[2] Ohba M, Mizuki E, Uemori A. Parasporin,a new anticancer protein group fromBacillusthuringiensis[J].Anticancer Research,2009,29:427-434.
[3] Kati H, Sezen K, Nalcacioglu R, et al. A highly pathogenic strain ofBacillusthuringiensisserovar kurstaki in lepidopteran pests[J].J Microbiol,2007,45(6):553-557.
[4] Roh JY, Choi JY, Li MS, et al.Bacillusthuringiensisas a specific, safe, and effective tool for insect pest control[J].J Microbiol Biotechnol,2007,17(4):547-559.
[5] Glare TR, O’Callaghan M.Bacillusthuringiensis: Biology, Ecology and Safety[J].Chichester: John Wiley,2000,350.
[6] Hastowo S, Lay BW, Ohba M. Naturally occurringBacillusthuringiensisin Indonesia[J].J Appl Microbiol,1992,73:108-113.
[7] Maeda M, Mizuki E, Nakamura Y, et al. Recovery ofBacillusthuringiensisfrom marine sediments of Japan[J].Curr Microbiol,2000,40:418-422.
[8] Lee DH, Cha IH, Woo DS, et al. Microbial ecology ofBacillusthuringiensis: fecal populations recovered from wildlife in Korea[J].Can J Microbiol,2003,49:465-471.
[9] Yasutake K, Uemori A, Kagoshima K, et al. Serological identification and insect toxicity ofBacillusthuringiensisisolated from the island Okinoerabu-jima, Japan[J].Appl Entomol Zool,2007,42:285-290.
[10]Kondo S,Mizuki E,Akao T, et al. Antitrichomonal strains ofBacillusthuringiensis[J].Parasitol Res,2002,88:1090-1092.
[11]Akiba T,Higuchik K,Mizuki E,et al. Nontoxic crystal protein fromBacillusthuringiensisdemonstrates a remarkable structural similarity to beta-pore-forming toxins[J].Proteins,2006,63:243-248.
[12]Mizuki E,Ohba M,Akao T,et al. Unique activity associated with non-insecticidalBacillusthuringiensisparasporal inclusions: in vitro cell-killing action on human cancer cells[J].J Appl Microbiol,1999,86:477-486.
[13]Uemori A, Maeda M, Yasutake K, et al. Ubiquity of parasporin-1 producers inBacillusthuringiensisnatural populations of Japan[J].Naturwissenschaften,2007,94:34-38.
[14]Yasutake K, Binh ND, Kagoshima K, et al. Occurrence of parasporin-producingBacillusthuringiensisin Vietnam[J].Can J Microbiol,2006,52:365-372.
[15]Jung YC, Mizuki E, Akao T et al. Isolation and characterization of a novelBacillusthuringiensisstrain expressing a novel crystal protein with cytocidal activity against human cancer cells[J].J Appl Microbiol,2007,103:65-79.
[16]Nadarajah VD, Ting D, Chan KK, et al. Selective cytotoxic activity against leukemic cell lines from mosquitocidalBacillusthuringiensisparasporal inclusions[J].Southeast Asian J Trop Med Publ Health, 2008,39:235-245.
[17]Mizuki E, Park YS, Saitoh H, et al. Parasporin, a human leukemic cell-recognizing parasporal protein ofBacillusthuringiensis[J].Clin Diagn Lab Immunol,2000,7:625-634.
[18]Uemori A, Ohgushi A, Yasutake K, et al. Parasporin-1Ab, a novelBacillusthuringiensiscytotoxin preferentially active on human cancer cells in vitro[J].Anticancer Res,2008,28:91-96.
[19]Yasutake K, Uemori A, Binh ND, et al. Identification parasporin genes in Vietnamese isolates ofBacillusthuringiensis[J].Z Naturforsch,2008,63c:139-143.
[20]Nagamatsu Y, Okamura S, Saitou H, et al. Three Cry toxins in two types fromBacillusthuringiensisstrain M019 preferentially kill human hepatocyte cancer and uterus cervix cancer cells[J].Biosci Biotechnol Biochem,2010,74(3):494-498.
[21]Ito A, Sasaguri Y, Kitada S, et al. ABacillusthuringiensiscrystal protein with selective cytocidal action to human cells[J].J Biol Chem,2004,279:21282-21286.
[22]Hayakawa T, Kanagawa R, Kotani Y, et al. Parasporin-2Ab, a newly isolated cytotoxic crystal protein fromBacillusthuringiensis[J]. Curr Microbiol, 2007, 55: 278-283.
[23]Yamashita S, Katayama H, Saitoh H, et al. Typical three-domain Cry proteins ofBacillusthuringiensisstrain A1462 exhibit cytocidal activity on limited human cancer cells[J].J Biochem,2005,138:663-672.
[24]Okumura S, Saitoh H, Ishikawa T, et al. Identification of a novel cytotoxic protein, Cry45Aa, fromBacillusthuringiensisA1470 and its selective cytotoxic activity against various mammalian cell lines[J].J Agric Food Chem,2005,53:6313-6318.
[25]Katayama H, Yokota H, Akao T, et al. Parasporin-1, a novel cytotoxic protein to human cells from non-insecticidal parasporal inclusions ofBacillusthuringiensis[J].J Biochem,2005,137:17-25.
[26]Kim H-S, Yamashita S, Akao T, et al. In vitro cytotoxicity of non-Cyt inclusion proteins of aBacillusthuringiensisisolate against human cells, including cancer cells[J].J Appl Micribiol,2000,89:16-23.
[27]Yamashita S, Akao T, Mizuki E, et al. Characterization of the anti-cancer-cell parasporal proteins of aBacillusthuringiensisisolate[J].Can J Microbiol,2000,46:913-919.
[28]Saitoh H, Okumura S, Ishikawa T, et al. Investigation of a novelBacillusthuringiensisgene encoding a parasporal protein, parasporin-4, that preferentially kills human cancer cells[J].Biosci Biotechnol Biochem,2006,70:2935-2971.
[29]Katayama H, Kusaka Y, Yokota H, et al. Parasporin-1, a novel cytotoxic protein fromBacillusthuringiensis, induces Ca2+influx and a sustained elevation of the cytoplasmic Ca2+concentration in toxin-sensitive cells[J].J Biol Chem,2007,282:7742-7752.
[30]Kitada S,Abe Y,Shimada H,et al. Cytocidal actions of Parasporin-2,an anti-tumor crystal toxin fromBacillusthuringiensis[J].J Biol Chem,2006,281(36):26350-26360.
[31]Okumura S, Saitoh H, Ishikawa T, et al. Mode of action of parasporin-4, a cytocidal protein fromBacillusthuringiensis[J].Biochim Biophys Acta,2011,1808:1476-1482.
[32]Krishnan K, Ker JE, Mohammed SM, et al. Identification of glyceraldehyde-3-phosphate dehydrogenase (GAPDH) as a binding protein for a 68 kuBacillusthuringiensisparasporal protein cytotoxic against leukaemic cells[J].J Biomed Sci,2010,17:86.
[33]Thomas WE, Ellar DJ.Bacillusthuringiensisvar israelensis crystal delta endotoxin: effects on insect and mammalian cellsinvitroandinvivo[J].J Cell Sci,1983,60:181-197.
[34]Crickmore N, Zeigler DR, Feitelson J, et al. Revision of the nomenclature for theBacillusthuringiensispesticidal crystal proteins[J].Microbiol Mol Biol Rev,1998,62(3):807-813.
Advances in Parasporins from Bacillus thuringiensis
FU Zu-jiao1,2, ZHOU Lin1, LI Min1, SHAN Shi-ping2, LIU Qing-shu2
(1.Dept.ofMed.Lab.,ChangshaMed.Uni.,Changsha410219; 2.HunanInst.ofMicrobiol.,Changsha410009)
Parasporin (PS) is a kind of crystal proteins synthesized byBacillusthuringiensisthat has no insecticidal activity, after digested by protease the zymolytically active polypeptide possessed specific cytotoxicity against human cancer cells from diferent tissues, however, having lower or non toxicity against normal cells; it is a kind of microbial anti-cancer protein with great potency. Category of the PSs that have been discovered inB.thuringiensisin recent years, their structural features, cytoactive spectrum, and insectcidal mechanism were briefly summarized in this paper.KeywordsBacillusthuringiensis; crystal protein; anti cancer; cytotoxicity
湖南省教育厅项目(12C0519)
付祖姣 女,讲师。现从事微生物分子生物学及应用研究。E-mail:fzjp2004@hotmail.com
2014-05-05;
2014-06-18
Q939.124
A
1005-7021(2015)01-0095-06
10.3969/j.issn.1005-7021.2015.01.018