马铃薯叶片基因组DNA提取方法比较研究
李建武,巩迎春
(1.甘肃省农业科学院马铃薯研究所,甘肃 兰州 730070;2.农业部西北旱作马铃薯科学观测实验站,甘肃 渭源 748201;3.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
马铃薯(Solanum tuberosum L.)是茄科(Solanaceae)茄属(Solanum)马铃薯组(Tuberarium)双子叶草本植物,可一年一季或一年两季栽培,普通马铃薯是马铃薯亚组中能形成地下块茎的一年生草本四倍体作物。由于受到同源四倍体遗传复杂性的限制,马铃薯遗传规律极为复杂,常规杂交育种效率较低,近年来在分子水平方面开展了大量的研究。DNA的分离提取是进行植物分子生物学研究工作的基础,DNA的提取效率和纯度严重影响分子生物学实验的结果,因此快速提取得到高纯度的DNA,是分子生物学实验成败的关键因素之一[1]。目前,普通植物DNA提取方法已经非常成熟,常用的有十六烷基三甲基溴化铵(CTAB)[2],十二烷基苯磺酸钠(SDS)法[3],尿素法[4]、试剂盒法提取基因组DNA[5]。其中,CTAB法是植物提取的经典方法,提取效果好,但步骤繁琐、试剂组成复杂、易污染[5-6];SDS法较为简易、产量高,但有蛋白污染可能[3];尿素法具有产量高、快速省时、可常温操作、成本耗用低等优点[4];试剂盒法操作简便、快速省时、污染少、提取的DNA纯度高,但其成本比较高[4]。我们采用CTAB和试剂盒2种不同的DNA提取方法,以常规种植马铃薯植株叶片为实验材料,探索了适合批量高效的马铃薯叶片基因组DNA提取方法。
1 材料与方法
1.1 供试材料
供试材料为8份马铃薯品系,均为普通栽培种。植物基因组DNA提取试剂盒(DP305-2)购自天根生化科技(北京)有限公司。
1.2 试验方法
试验材料于4月28日种植于农业部西北旱作区马铃薯野外观测实验站(甘肃省渭源县),出苗后15 d,剪取马铃薯植株上部倒数未完全展开的第2片复叶,放入冰盒带到实验室,经液氮速冻后置于-80℃下保存备用。马铃薯基因型编号分别为 001、010、039、043、052、060、109、111。
1.3 DNA提取
采用改良CTAB法和试剂盒法两种方法分别提取马铃薯叶片基因组DNA。
1.3.1 改良CTAB法提取DNA[7]取备用马铃薯叶片约500 mg,加液氮研磨成粉末状,迅速移入2 mL离心管。加入700μL的CTAB提取缓冲液,混匀(CTAB在65℃水浴预热),待所有样品研磨完后,逐个加入2μLβ-巯基乙醇(通风橱下),放回水浴锅中,每5 min轻轻震荡几次,30 min后加入700 uL氯仿∶异戊醇(24∶1),颠倒摇匀数次,在12 000 r/min条件下离心10 min。小心吸取上清液600μL转入1.5 mL离心管,加入等体积的饱和酚和氯仿∶异戊醇(各300μL)溶液,混匀,在12 000 r/min条件下离心10 min。小心吸取上清液400μL转入新离心管,加入等体积的异丙醇,混匀,室温静置10 min,在12 000 r/min条件下离心10 min,弃去上清液,用70%乙醇洗涤沉淀2次。室温下干燥5~15 min后,溶于100μL TE溶液中,置于-20℃保存备用。每个基因型材料DNA提取重复2次。
1.3.2 试剂盒法提取DNA 按试剂盒(DP305-2)说明书操作。提取马铃薯叶片基因组DNA后,置于-20℃保存备用。每个基因型材料DNA提取重复2次,验证其DNA提取的效果。
1.4 DNA检测
1.4.1 琼脂糖凝胶电泳法 取DNA样品5μL,与1μL 6×Loading Buffer混匀后上样,以2 000 bp DNA Ladder Marker为参照,在含荧光染料EB的1%琼脂糖凝胶上120 V电泳20 min。电泳结束后,通过凝胶成像系统(BIO-RAD,GelDocXR+)观察拍照,进行纯度、浓度检测。
1.4.2 紫外分光光度法 取2μL DNA样品,与498μL加ddH2O稀释250倍至500μL,在紫菀分光光度计(岛津,UV-240)上测定DNA OD260和OD280值,并计算OD260/OD280,以检测纯度和浓度。
1.5 SSR-PCR检测
利用文献公开发表的SSR引物STM0024[8],对8份材料中的1个基因型的4份DNA样品进行PCR扩增,引物由上海生工生物有限公司合成。STM0024引物序列:上游引物序列CATTACCTTGTGAGATTAGATTG(5′-3′),下游引物序列CATATAAGTAGGAATAGGAGGTTT(5′-3′),扩增目标片段135 bp。
PCR反应体系:在20μL反应体系中加入上下游引物各 1.20 uL(20 pmol/μL),10×Buffer(含Mg2+)为 2.0μL,dNTPs为 1.0μL,Taq酶为 0.1 μL(5U/μL),DNA模板为 0.8 uL(50 ng/μL)。扩增程序:95预变性3 min,95℃变性30 s,53.4℃退火30 s,72℃延伸1 min,共34循环,最后72℃延伸10 min,4℃保存PCR产物。
吸取 PCR产物 10μL,加 2μL 6×Loading Buffer配制样品,以2000 bp DNA Ladder Marker为参照,在含荧光染料EB的2%琼脂糖凝胶上,120 V电泳30 min,电泳结束后,通过凝胶成像系统(GelDocXR+)观察拍照。
2 结果与分析
2.1 DNA样品凝胶电泳检测结果
图1的Marker含6条带,分子量由大到小依次为 2 000、1 000、750、500、250、100 bp,其中750 bp条带的DNA浓度约为100 ng,其余条带约50 ng。琼脂糖凝胶电泳结果显示,2种方法提取的DNA条带均清晰整齐、DNA完整无杂带。改良CTAB法提取的DNA点样孔内有杂质且存在拖尾现象,试剂盒提取的DNA只有少量点样孔内有杂质,表明试剂盒提取的DNA纯度较高于改良CTAB法。改良CTAB法提取的1份样品(109I)DNA浓度低于50 ng,8份材料2次重复共16份次的DNA得率为93.8%;试剂盒提取提取的5份样品(010I,010II,039I,039II,043II)浓度低于50 ng,8份材料2次重复共16份次的DNA得率68.8%,说明改良CTAB法提取DNA得率高于试剂盒。2种方法提取的DNA样品浓度、纯度在各重复之间差异不明显。
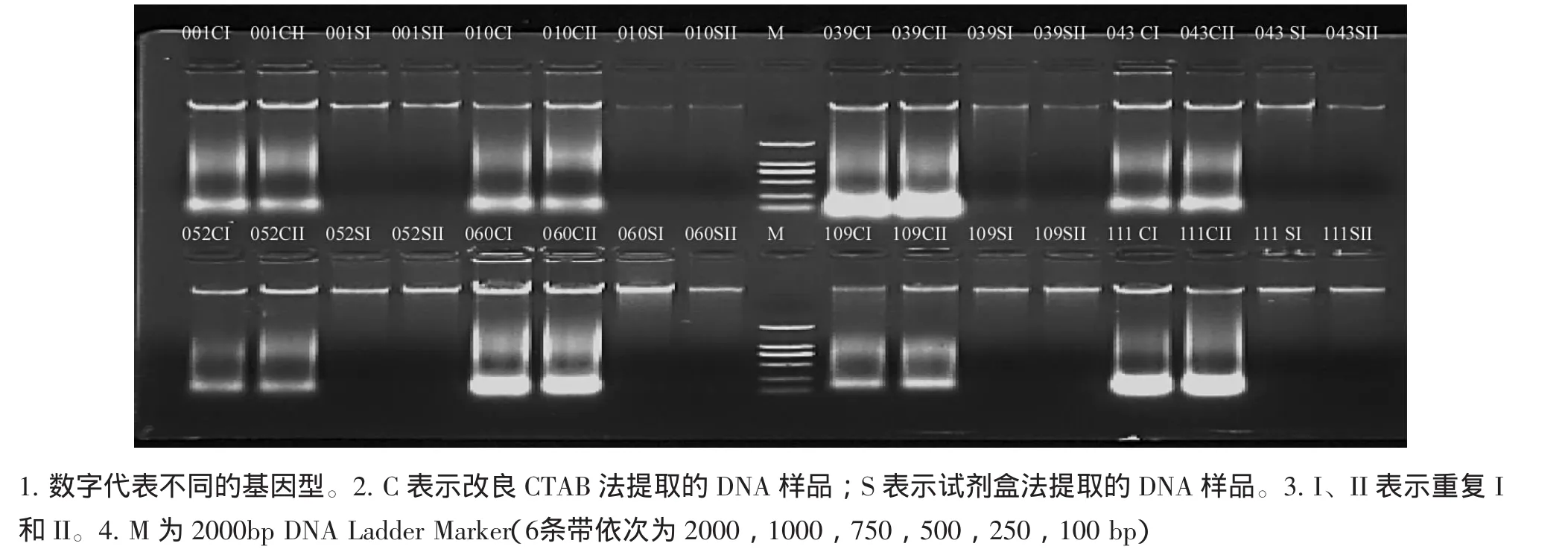
图1 改良CTAB法与试剂盒法提取的基因型DNA样品

表1 改良CTAB法与试剂盒法提取的DNA样品纯度
2.2 紫外分光光度法测定结果
DNA样品的纯度用OD260/OD280的比值来表示,当OD260/OD280比值接近1.8时,DNA纯度符合质量标准;当OD260/OD280比值大于1.9时,表明有RNA污染,小于1.6时,表明样品中存在蛋白质或酚污染[9-10]。根据紫外分光光度分析(表1),改良CTAB法提取的010I,039I,039II,043I,060I,060II,109I,111I、111II等9份DNA样品吸光值比值大于1.9,说明有RNA污染,和图1结果相同。试剂盒提取的043I,060I,109I,111I等4份DNA样品吸光值比值小于1.6,说明有蛋白质、多糖或酚等杂质。改良CTAB法提取的DNA样品OD260/OD280比值平均值1.89,试剂盒提取的DNA样品OD260/OD280比值平均值1.66,2种方法提取的DNA样品均符合质量标准。
2.3 SSR-PCR检测
由图2可以看出,2种方法提取的DNA样品为模板进行SSR-PCR扩增反应,经琼脂糖凝胶电泳检测,产物条带清晰,大小一致,说明两种方法提取的DNA完全满足马铃薯SSR-PCR扩增需要。

图2 不同方法提取的DNA样品PCR扩增结果
3 小结与讨论
1)CTAB法作为DNA提取的经典方法,广泛应用于植物基因组DNA提取,具有稳定性好、得率高、成本低等优点[4],根据研究对象特点而进行改良后可以提取到高质量的 DNA[3,9,11]。但该方法在配制试剂过程中繁琐耗时,步骤多,试剂组成复杂,易污染,在使用上收到了一定程度的限制[1]。从成本来看,试剂盒法所用药品及耗材都需整套购买,费用较高,而CTAB法只需配好所需药品,耗材不多。但试剂盒可用于多样品同时操作,快速,准确,方便,无需酚、氯仿抽提,避免了有机质溶剂的污染,逐渐受到重视。从本研究结果来看,试剂盒法提取的DNA质量高、杂质少,DNA得率略低,CTAB法提取的DNA浓度大、量大,但杂质多。
2)本试验选用的材料采自田间马铃薯植株,较组培苗叶片含有较多的酚类物质。试验结果表明,改良CTAB法和试剂盒两种方法都可得到满足SSR-PCR反应扩增要求的DNA,能够进行基于SSR标记的马铃薯遗传多样性分析试验,各实验室可根据实际条件、经费支出、人员配给等具体情况,选择适合的方法进行马铃薯基因组DNA的提取。如果需要样品DNA数量不多、质量高,样本较多时建议选用试剂盒法提取,因为其操作过程简便。相反,若是小规模提取、质量要求不是很高、样本较少时建议选用CTAB法,因为其成本低、得率较高。
[1] 刘塔斯,林丽美,龚力民,等.分子标记中植物DNA提取方法的研究进展[J]. 中南药学,2006,3(6):370-373.
[2] SAMBROOK J,萨姆布鲁克,Russell DW,等.分子克隆实验指南[M].北京:科学出版社,2002.
[3] 王晓丹,吕慧颖,张 敬,等.以PCR为目的的大豆叶片DNA提取方法的比较研究[J].分子植物育种,2004,2(6):891-894.
[4] 曹文波,郑璐璐,谢文海.一种提取植物基因组DNA的方法——改良尿素法[J].华中师范大学学报(自然科学版),2008,42(3):448-451.
[5] 梁玉琴,李芳东,傅建敏,等.柿属植物基因组DNA提取方法比较[J].中南林业科技大学学报,2012,32(4):170-173.
[6] 张 平,夏东升,蔡亚君,等.多种方法提取苎麻组织基因组 DNA的质量比较[J].湖北农业科学,2014,53(11):2 682-2 685.
[7] CLARK MS.植物分子生物学:实验手册[M].顾红雅翟礼佳,译.北京:高等教育出版社,2011.
[8] GHISLAIN M,NU'ÑEZ J,ROSARIO HERRERA M,et al.Robust and highly informative microsatellite-based genetic identity kit for potato[J].Mol Breeding,2009,23(3):377-388.
[9] 赵 静,叶 欢,李雪松,等.四种改良CTAB法提取大叶朴基因组DNA比较研究[J].北方园艺,2010(1):165-168.
[10] 代翠红,李 杰,朱延明,等.不同DNA提取方法对 4种重要作物DNA提取效率的比较[J].东北农业大学学报,2005,36(3):329-332.
[11] 仇建标,丁文勇,陈少波.几种DNA提取方法对红树植物秋茄叶片DNA提取效果的比较[J].浙江海洋学院学报(自然科学版),2013,31(5):402-408.

