鲭鱼加工废弃物分段发酵过程中生化指标的动态变化
刘书来,柯玉原,周绪霞,丁玉庭
(浙江工业大学海洋学院,浙江杭州,310014)
近年来随着我国海底层经济鱼类资源的衰退,使鲭鱼等中上层鱼类资源越显丰富,其年产量维持在40多万t,从而成为我国东海区海洋渔业中具有重要地位的鱼获物之一。鲭鱼可被加工成鱼脯、鱼糜、鱼罐头等产品,但是生产过程中会产生40% ~60%的加工废弃物[1]。目前对鱼类加工废弃物的利用方式有很多,比如:将鱼皮处理成皮革[2];将鱼鳞做成天然吸附剂;分离酶、明胶和具有抗微生物和抗肿瘤能力的蛋白质[3];通过生物炼制方法生产生物燃料以及其他各种大容量化工原料及产品[4];在鱼废弃物中添加植物乳杆菌进行发酵[5]或添加其他乳酸菌生产动物饲料产品[6-7];也有研究者在回收的鱼废物中接种乳酸菌和酵母混合物,测试乳酸菌和酵母菌在鱼废弃物中的活性,并获得互补的成分形成了均衡的食物配给动物食用[8]。
因植物乳杆菌是厌氧细菌(兼性好氧),活菌数比较高,能大量产酸,能有效控制发酵液的pH环境抑制腐败性微生物和碱性物质的产生。产朊假丝酵母是高蛋白源,其可优化废弃物的蛋白组成,并已用于生产几种工业产品[9]。本试验先在鲭鱼废弃物中添加葡萄糖、植物乳杆菌进行发酵,降低发酵环境的pH,到一定程度后再添加产朊假丝酵母,并考察短时连续分段发酵过程中鲭鱼加工废弃物的生化指标动态变化。
1 材料与方法
1.1 原料与菌种
1.1.1 原料
原料为鲭鱼罐头产品加工后的废弃物,由台州兴旺水产有限公司提供。
1.1.2 菌种
产朊假丝酵母Y150(Candida utilis)和植物乳杆菌B758(Lactobbacillus phan),上海市工业微生物研究所菌种保藏中心提供。
1.2 主要试剂与仪器
1.2.1 主要试剂
NaOH、HClO4、HCl、甲醛、山梨酸、Na2SO3、CuSO4·5H2O、NaKC4H4O6·4H2O、H3BO3、C2HO2Cl3等均为分析纯。
1.2.2 主要仪器
PHS-3C型数显酸度计,上海精密科学仪器有限公司;AR2130电子精密天平,华东医药有限公司;HR2860型打浆机,上海飞利浦有限公司;K9840型自动凯氏定氮仪,海能仪器;UV-7504型紫外可见光分光光度计,上海欣茂仪器有限公司;LRH-250F型生化培养箱,上海一恒科学仪器有限公司;TCL-16M型高速台式冷冻离心机,长沙湘仪离心机仪器有限公司;SKY-111B型低温恒温振荡摇床,上海苏坤实业有限公司。
1.3 发酵剂制备
将植物乳杆菌接入 MRS肉汤培养基中,于30℃、180 r/min摇床培养,然后离心(8 000r/min,10 min)后,用0.85% 生理盐水冲洗并调整至植物乳杆菌浓度约为12 g/L。
将产朊假丝酵母接入WORT肉汤培养基中,于30℃、180 r/min摇床培养,然后离心(5 000 r/min,10 min)后,用0.85%生理盐水冲洗并调整至产朊假丝酵母浓度约为19 g/L。
1.4 发酵过程
将鲭鱼加工废弃物切碎,采用打浆机打碎后剁碎成鱼糜状,称量60 g于250 mL三角瓶中,添加20 mL水,巴氏杀菌(75℃,20 min),并添加已单独灭菌的0.2 g/mL葡萄糖溶液7.2 mL,作为发酵培养基。
采用分段发酵方式,先在发酵培养基中接种5%(v/w)植物乳杆菌于30℃下厌氧发酵6 h,再接种5%(v/w)产朊假丝酵母并分别在25、30、35℃下好氧发酵42 h。
1.5 分析方法
1.5.1 微生物平板计数
参考GB 4789.2-2010无菌操作方式。植物乳杆菌采用MRS琼脂培养基,并加入2 g/L山梨酸以抑制产朊假丝酵母生长,在37℃培养(72±3)h后计数;产朊假丝酵母采用麦芽汁琼脂培养基,在28℃下培养(72±3)h后计数。
1.5.2 pH值测定
参照GB/T 5009.45-2003。
1.5.3 总酸、氨基态氮含量测定
总酸参照GB/T 12456-2008测定,氨基态氮含量测定是在测定总酸后的样品中加入10 mL 36%~38%的甲醛溶液,用0.05 mol/L NaOH滴定至pH 9.2。
1.5.4 水溶性蛋白质含量测定[10]
采用双缩脲法,标准曲线方程为y=0.529 4x+0.007 6,R2=0.999 2。
1.5.5 挥发性盐基氮含量测定
参照SC/T 3032—2007。
1.5.6 非蛋白氮含量测定[11]
本试验称取样品约5.000 g于锥形瓶中,加入50 mL蒸馏水静置30 min,然后加入10 mL 10% 三氯乙酸溶液静置30 min,滤纸过滤,残渣用三氯乙酸溶液冲洗2次,凯氏定氮仪定氮。
1.5.7 统计分析
数据分析采用SPSS 21和Excel 2007软件,数据均以平均值±SD表示,采用最小显著差异法(LSD)进行差异显著性分析,显著性水平设置为P<0.05。
2 结果与分析
2.1 微生物变化
表1为鲭鱼加工废弃物发酵过程中植物乳杆菌和产朊假丝酵母的生物量随发酵时间的变化情况。厌氧发酵阶段中植物乳杆菌在厌氧和葡萄糖存在的条件下快速生长繁殖,由初始7.83 lg(CFU/g)快速上升至8.61 lg(CFU/g)。6 h后开始进入好氧发酵阶段,在25、30和35℃下,因植物乳杆菌是兼性厌氧菌,仍能继续生长繁殖,至发酵结束时分别达到8.98、9.11、8.77 lg(CFU/g);产朊假丝酵母在 25 和30℃下,快速生长繁殖,至发酵结束时分别达到6.52、6.64 lg(CFU/g),但在35℃,产朊假丝酵母生物量在6~30 h之间上升,30~48 h之间下降,至发酵结束时为5.3 lg(CFU/g)。30 h后产朊假丝酵母生物量显著小于其他两个温度下的产朊假丝酵母生物量(P<0.05)。主要原因是35℃过高,不利于产朊假丝酵母生长繁殖。从发酵结果可以看出,本试验中3个发酵温度对植物乳杆菌生长繁殖影响差异不大,而25和30℃下,产朊假丝酵母生物量有所增加,提高了发酵基质中单细胞蛋白含量。另外,植物乳杆菌和产朊假丝酵母可以共同生长是因为乳酸菌与酵母菌之间存在代谢产物互补机制[12],酵母菌在发酵过程中为乳酸菌提供了许多营养因子例如氨基酸、维生素和丙酮酸盐等其他物质[13],而乳酸菌的代谢产物又为酵母菌提供了能量来源[14]。
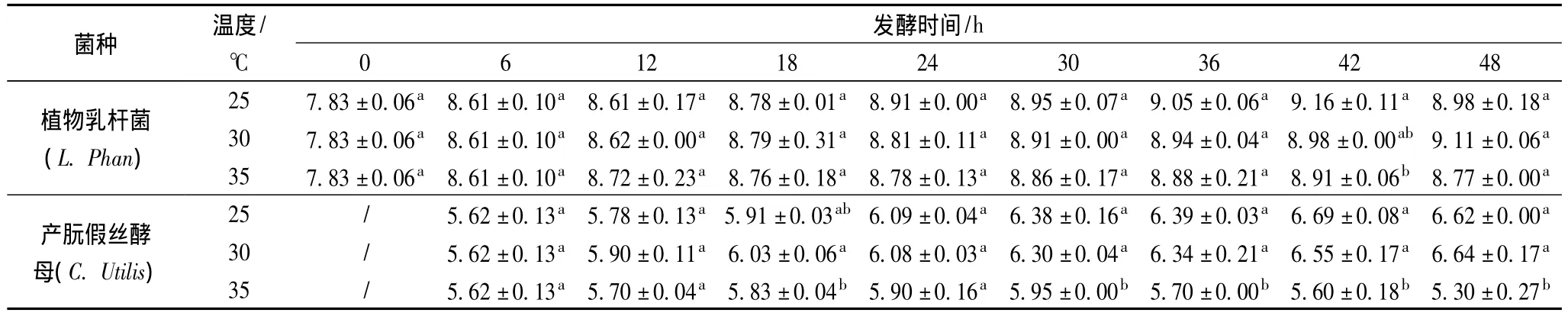
表1 分段发酵过程中植物乳杆菌及产朊假丝酵母的生物量变化Tabel 1 Biomass changes of L.phan and C.utilis in segmented fermentation process
2.2 pH和总酸的变化
图1为鲭鱼加工废弃物发酵过程中pH和总酸含量的变化。第1发酵阶段中pH快速下降,从初始6.48降至5.46。第2发酵阶段中pH在6~12 h继续下降至4.80左右,而12~48 h,pH变化趋于平缓,至发酵结束时略有上升。pH的变化趋势与Hernan等[6]在鱼废弃物中添加植物乳杆菌制备鱼青贮饲料的结果一致。pH快速下降可能是由于植物乳杆菌在厌氧发酵条件下急速生长和繁殖产生大量有机酸引起的。而pH在发酵后期趋于平缓且略有上升,一方面可能与产朊假丝酵母生长繁殖过程中利用了植物乳杆菌产生的乳酸有关[15];另一方面可能是发酵液的酸性环境使蛋白质发生降解,产生一些碱性含氮物质,或者是原料中的腐败菌生长繁殖产生胺类物质,中和酸性物质所致[16]。25、30和35℃三个发酵温度之间的pH相差不大,总酸含量也无显著性差异(P>0.05),总酸含量变化趋势与pH呈负相关。

图1 分段发酵过程中pH和总酸含量的变化Fig.1 Changes of pH and total acid in segmented fermentation process
2.3 水溶性蛋白质含量变化
图2为鲭鱼加工废弃物发酵过程中水溶性蛋白含量的变化情况。第1发酵阶段中水溶性蛋白质含量在0~6 h略有上升。第2发酵阶段中水溶性蛋白质含量在25、30和35℃三个不同温度条件下均逐渐下降,至发酵结束时分别为0.74、0.98和0.63 g/100 g。一方面可能是较低的pH发酵环境改变了鲭鱼废弃物蛋白质结构引起的[17];另一方面可能是菌种本身产生的蛋白酶使蛋白质降解[16]引起的。由图2可知,35℃下水溶性蛋白质含量下降速率比25和30℃下水溶性蛋白质含量下降速率快,但是35℃下产朊假丝酵母菌生物量低于其他两组,可推测植物乳杆菌和产朊假丝酵母产的蛋白酶不是影响水溶性蛋白质含量下降的主要原因,而35℃下的pH低于其他两组,可推测酸性环境是水溶性蛋白质降解的主要原因。
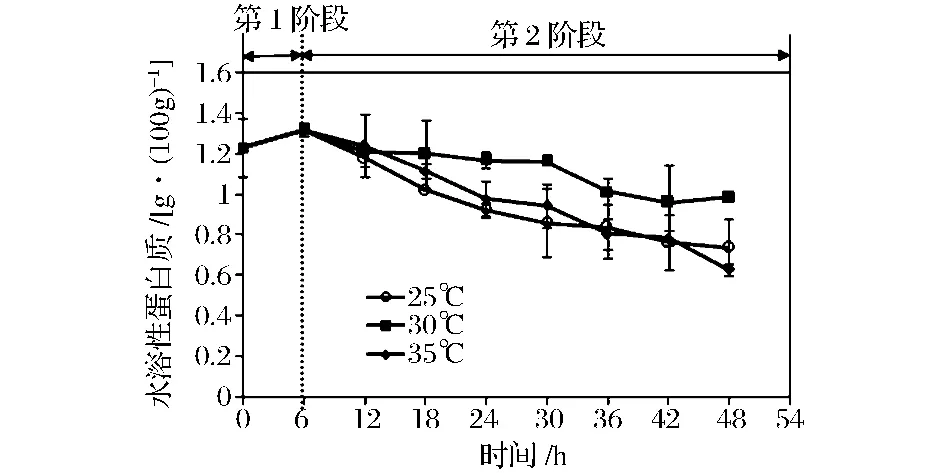
图2 分段发酵过程中水溶性蛋白质含量的变化Fig.2 Changes of water-soluble protein in segmented fermentation process
2.4 氨基态氮含量变化
氨基态氮是指以氨基酸形式存在的氮元素的含量。由图3可知,第1发酵阶段中,氨基态氮含量在0~6 h逐渐上升,从初始0.28 g/100 g上升至0.30 g/100 g。第2发酵阶段中氨基态氮含量在25、30和35℃三个不同温度条件下均逐渐上升,至发酵结束时分别为0.31、0.43和0.36 g/100 g。氨基态氮含量变化与水溶性蛋白含量变化总体呈负相关,也是由于蛋白质降解形成氨基酸引起的。虽然在6~48 h,30℃下氨基态氮含量较高,但是25、30和35℃三个发酵温度下的氨基态氮含量均无显著性差异(P>0.05)。

图3 分段发酵过程中氨基态氮含量的变化Fig.3 Changes of amino nitrogen in segmented fermentation process
2.5 挥发性盐基氮含量变化
挥发性盐基氮(TVB-N)是用于评价挥发性胺类物质形成的重要指标,并可表征发酵过程中腐败微生物及其代谢形成腐败性物质的变化规律。由图4可知,第1发酵阶段中,TVB-N含量在0~6 h略有下降,从初始62.26 mg/100 g下降至60.99 mg/100 g。第2发酵阶段中TVB-N含量在25、30和35℃下均先快速下降,接着趋于平缓,最后逐渐上升,至发酵结束时分别为48.59、53.97和55.69 mg/100 g。并且25℃下TVB-N含量显著低于30和35℃下TVB-N含量 (P <0.05)。Hu Yongjin等[18]认为,TVB-N 含量下降是因为乳酸菌产生的乳酸和抗菌素中和了TVB-N引起的。而M.H.EI Jalil等认为,TVB-N含量高低与蛋白质降解有关[19],TVB-N含量在发酵后期逐渐上升可能是由于腐败微生物与酶使含氮化合物如蛋白质、肽、氨基酸等发生脱氨基或者分解反应,并使之转化为氨基酸和挥发性氮[20]。

图4 分段发酵过程中挥发性盐基氮含量的变化Fig.4 Changes of total volatile base nitrogen in segmented fermentation process
2.6 非蛋白氮含量变化
非蛋白氮(NPN)在饲料加工领域是饲料中蛋白质以外的含氮化合物的总称,包括游离氨基酸、蛋白质降解的含氮化合物、氨以及铵盐等简单含氮化合物。由图5可知,第1发酵阶段中,NPN含量在0~6 h逐渐上升,从8.8 mg/g上升至9.06 mg/g。第2发酵阶段中,NPN含量在25、30和35℃三个不同温度下均逐渐上升,至发酵结束时分别为11.15、11.36和11.90 mg/g。NPN含量的变化趋势与AHammoumi等[5]在鱼废弃物中添加植物乳杆菌后用于饲养肉仔鸡的研究中的变化趋势一致。NPN的变化趋势可能是一些微生物或内源性酶将蛋白氮转化成NPN引起的[5];也可能是较低的pH值使蛋白质结构改变,促进NPN含量增加[21]。虽然35℃下NPN含量最高,至发酵结束时达到11.90 mg/g,但是25、30和35℃三个不同发酵温度对非蛋白氮含量影响差异不大。

图5 分段发酵过程中非蛋白氮含量的变化Fig.5 Changes of non-protein nitrogen in segmented fermentation process
3 结论
本研究以鲭鱼加工废弃物为发酵原料,以植物乳杆菌和产朊假丝酵母为发酵剂,探索提高鲭鱼加工废弃物高值化利用的途径。发酵结束时,水溶性蛋白质含量降低,非蛋白氮含量上升,氨基态氮含量由初始0.28 g/100 g分别提高至0.31、0.43和0.36 g/100 g,表明发酵剂一定程度上利用鲭鱼加工废弃物中蛋白质,提高了发酵基质中的多肽和氨基酸含量;pH变化与TVB-N变化呈正相关,TVB-N含量从初始62.26 mg/100 g分别降低至48.59、53.97和55.69 mg/100 g,表明添加植物乳杆菌能够充分抑制腐败微生物生长繁殖,保证发酵环境的安全性,同时为产朊假丝酵母生长繁殖提供有利条件;温度变化对植物乳杆菌生长繁殖影响不大,其生物量均有所提高,从初始7.83 lg(CFU/g)分别上升至8.98、9.11 和8.77 lg(CFU/g);产朊假丝酵母生物量从初始5.62 lg(CFU/g)分别上升至6.52、6.64 lg(CFU/g)和下降至5.30 lg(CFU/g),表明25和30℃下利于产朊假丝酵母生长繁殖,发酵基质中单细胞蛋白含量会增加,这也提高了鲭鱼加工废弃物的营养价值,而35℃下不利于产朊假丝酵母的生长繁殖。
[1] FAO.Year Book of Fishery Statistics[M].Food and Agricultural Organization of the United Nations,Rome.2009:98/1 and 2.
[2] Blanco M,Sotelo C G,Chapela M J,et al.Towards sustainable and efficient use of fishery resources:present and future trends[J].Trends in Food Science and Technology,2007,18(1):29-36.
[3] Arvanitoyannisl I S,Kassaveti A.Fish industry waste:treatments,environmental impacts,current and potential uses[J].International Journal of Food Science and Technology,2008,43(4):726-745.
[4] Aggelopoulos T,Katsieris K,Bekatorou A,et al.Solid state fermentation of food waste mixtures for single cell protein,aroma volatiles and fat production[J].Food Chemistry,2014,145(15):710-716.
[5] Hammoumi A,Faid M,Yachioui M E,et al.Characterization of fermented fish waste used in feeding trials with broilers[J].Process Biochemistry,1998,33(4):423-427.
[6] Góngora H G,Ledesma P,Lo Valuo V R,et al.Screening of lactic acid bacteria for fermentation of minced wastes of Argentinean hake(Merluccius hubbsi)[J].Food and Bioproducts Processing,2012,90(4):767-772.
[7] Váquez J A,Docasal S F,rieto M A,et al.Growth and metabolic features of lactic acid bacteria in media with hydrolysed fish viscera.an approach to bio-silage of fishing byproducts[J].Bioresource Technology,2008,99(14):6 246-6 257.
[8] Ennouali M,Elmoualdi L,labioui H,et al.Biotransformation of the fish waste by fermentation[J].African Journal of Biotechnology,2006,5(19):1 733-1 737.
[9] Moftah O A S,Grbavcic S,Zuza M,et al.Adding value to the oil cake as a waste from oil processing industry:production of lipase and protease by Candida utilis in soild state fermentation[J].Appl Biochem Biotechnol,2012,166(2):348-364.
[10] 徐潇颖.鱼糜固态发酵及其成熟过程品质变化研究[D].杭州:浙江工业大学,2013:37.
[11] 周亚荣,王加启,周振峰,等.饲料非蛋白氮与可溶性蛋白测定方法概述[J].中国奶牛,2011(11):39-40.
[12] Tamime A Y,Marshall V M E.Microbiology and technology of fermented milks[M].LAW B A.Microbiology and biochemistry of cheese and fermented milk.London:Blackie Academic & Professional,1997.
[13] Roostita R,Fleet G H.The occurrence and growth of yeast in Camembert and blue-veined cheese[J].International Journal of Food Microbiology,1996,28(3):393-404.
[14] Loretan T.The diversity and technological properties of yeasts from indigenous traditional South African fermented milks[D].University Orange Free State,1999.
[15] Arnold J L,Knapp J S,Johnson C L.The use of yeasts to reduce the polluting potential of silage effuent[J].Wat Res,2000,34(15):3 699-3 708.
[16] XU W,YU G,XUE C,et al.Biochemical changes associated with fast fermentation of squid processing by-products for low salt fish sauce[J].Food Chemistry,2008,107(4):1 597-1 604.
[17] Kristinsson H,Hultin H O.Effect of low and high pH treatment on the functional properties of cod muscle proteins[J].Journal of Agricultural and Food Chemistry,2003b,51(17):5 103-5 110.
[18] HU Y,XIA W,LIU X.Changes in biogenic amines in fermented silver carp sausages inoculated with mixed starter cultures[J].Food Chemistry,2007,104(1):188-195.
[19] Jalil M H E I,Faid M,Elyachioui M.A biotechnological process for treatment and recycling poultry wastes manure as a feed ingredient[J].Biomass and Bioenergy,2001,21(4):301-309.
[20] Lopetcharat K,Choi Y J,Park J W,et al.Fish sauce products and manufacturing:a review[J].Food Reviews International,2001,17(3):65-68.
[21] Klement J T,Cassens R G,Fennema O R.The association of protein solubility with physical properties in a fermented sausage[J].Journal of Food Science,1973,38(7):1 128-1 131.

