L-谷氨酰胺产生菌的分离及其发酵培养基的优化
徐海燕,曹 斌,辛国芹,汪祥燕,汪孟娟,董佩佩,谷 巍
(山东宝来利来生物工程股份有限公司,山东泰安 271000)
L-谷氨酰胺(Gln)是 L-谷氨酸 γ-羧基酰胺化的一种氨基酸,是构成蛋白质的基本氨基酸之一,在生物体代谢中起着非常重要的作用(刘春晖和张伟国,2009)。生产L-Gln的方法主要包括化学合成法、酶转化法和直接发酵法,目前Gln的生产均采用发酵法。李爽等 (1998)以黄色短杆菌SGr和DONr抗性菌株作为生产菌株,采用16 L发酵罐发酵44 h,L-Gln的合成量达到55.2 g/L。张克旭等(1992)以天津短杆菌TG-866-174为出发菌株,经亚硝基胍和硫酸二乙酯诱变得到菌株GW-77,可代谢累积L-Gln 31.4 g/L,最高可产33.2 g/L。 Yamada 等(1979)对产黄菌(Flavobacterium rigense)FERM-P no.3556进行紫外诱变,得到了一株具有青霉素抗性的突变菌株FERM-P no.3628,可产 L-Gln 25 g/L。汪世华等(2002)对谷氨酸棒杆菌S9114进行紫外线及硫酸二乙酯(DES)诱变处理,定向选育出1株生产菌SH44,其L-Gln产量可代谢累积达到41.4 g/L左右。本试验旨在利用纸层析法定向筛选L-Gln产生菌,并通过紫外线和化学诱变剂对菌株进行诱变选育,使其合成L-Gln的能力进一步提升,同时采用正交试验对其发酵条件进行优化。
1 材料与方法
1.1 试验材料 果蔬摊土、活禽摊土、树林土等。
1.2 培养基
1.2.1 分离培养基 葡萄糖2%、牛肉膏0.5%、酵母膏0.5%、蛋白胨1%、氯化钠0.5%、制霉素50 U/mL,琼脂1.5%,pH 7.0,30℃培养 24 h。
1.2.2 活化斜面培养基 葡萄糖0.1%、牛肉膏1%、蛋白胨1%、氯化钠0.5%、琼脂粉1.5%,pH 7.0,30℃培养 24 h。
1.2.3 斜面保存培养基 蛋白胨1%、牛肉膏1%、氯化钠0.5%,琼脂 1.5%,pH 7.0。
1.2.4 种子培养基 葡萄糖4%、尿素0.5%、磷酸氢二钾0.2%、硫酸镁0.05%、玉米浆2.2%,pH 7.0,30℃培养 12 h。
1.2.5 发酵培养基 葡萄糖12%、磷酸二氢钾0.25%、硫酸镁 0.05%、硫酸锰 4 mg/L、硫酸锌2.5 mg/L、玉米浆 1%、硫酸铵7%,pH 7.0。
1.2.6 完全培养基 葡萄糖0.5%、牛肉膏1%、蛋白胨1%、酵母膏0.5%、氯化钠0.5%、琼脂粉1.5%,pH 7.0。
1.2.7 筛选培养基
1.2.7.1 磺胺胍(SG)药物培养基 在基本培养基的基础上添加适量的SG(400~800 mg/L)。
1.2.7.2 高浓度硫酸铵培养基 在基本培养基的基础上添加适量的硫酸铵(60~100 g/L)。
配制发酵培养基时,硫酸铵配成400 g/L的溶液,用NaOH溶液调pH 7.0,与发酵液分开灭菌,接种前与发酵液混合。
1.3 试验方法
1.3.1 菌种的分离筛选 取果蔬摊土、活禽摊土等土样5.0 g,置于盛有50 mL灭菌生理盐水的250 mL三角瓶内,进行梯度稀释,选取合适稀释度的样品液涂布于分离培养基上,30℃培养48 h,挑选生长良好、菌落较大的单菌落,接种于斜面培养基上,冰箱4℃保藏。
初筛菌种的初步鉴定:将初筛到的菌种进行革兰氏染色,革兰氏阳性菌保存,革兰氏阴性菌弃用。
纸层析法复筛菌种:将初筛得到的革兰氏阳性菌菌株摇瓶振荡培养24 h,利用纸层析法鉴定发酵液中是否含有L-Gln,定性复筛产L-Gln的菌株。
1.3.2 菌种生长曲线的测定 将菌株进行摇瓶发酵,每2 h取样一次测定发酵液的OD562(以空白培养基作对照),绘制生长曲线。
1.3.3 菌株的培养方法
1.3.3.1 液体种子培养 将斜面菌种接种到装有10 mL发酵培养基的100 mL三角瓶中,30℃、170 r/min摇床振荡培养8 h。
1.3.3.2 摇瓶发酵培养 500 mL三角瓶中装入发酵培养基50 mL,接入一环菌体或液体种子1 mL,30℃、170 r/min摇床振荡培养60 h。
1.3.4 菌株的诱变
1.3.4.1 紫外诱变 把待诱变菌株培养至对数生长期,5000 r/min离心5 min,去上清液,把菌体用无菌水再次离心洗涤,将菌体加入到含有玻璃珠的15 mL无菌生理盐水中振荡20 min,然后用无菌生理盐水稀释至108个/mL,将2 mL稀释的菌液加至无菌平皿中,放入无菌磁力搅拌子,再将平皿放在操作台紫外灯下照射20、40、60 s,照射后吸取菌体进行逐级稀释,并涂平板进行培养,挑取长得快、菌落大的进行斜面保存。
1.3.5 分析方法
1.3.5.1 L-Gln含量的测定 采用纸层析法。(1)展开:采用新华3号滤纸,每个样品点样1 μL,在室温下用不饱和法展开,展开剂用(苯酚∶水=4∶1)上行法展开;(2)定量:配制1%的Gln标准品,点样1 μL;菌株发酵液经离心后,取其上清液点样1 μL,放入层析缸中展开;(3)显色:展开完毕后用电吹风吹干滤纸,喷上0.5%的茚三酮无水乙醇溶液,60℃显色30 min;(4)比色测定:剪下Gln斑点,用5 mL硫酸铜乙醇溶液(0.1%硫酸铜溶液∶75%乙醇=2∶38)浸泡 30 min,然后在 510 nm 处测定A值,根据标准品的A值和样品的A值即可计算出样品的L-Gln的含量。
1.3.5.2 pH的测定 采用PHS-3C型精密pH测定。
1.3.6 菌株的鉴定
1.3.6.1 16S rDNA的扩增与序列分析 目的菌株接种于新鲜的种子培养基中培养12 h,采用天根公司的试剂盒提取菌体DNA,并对其进行16S rDNA序列扩增。所用引物为通用引物:1492r 5'-ggttaccttgttacgactt-3'27f 5'-agagttgatcctggctcag-3';PCR 反应体系(50 μL)为:Mixture 25 μL(含Taq DNA聚合酶及dNTP等,天根生化科技有限公司),上下游引物各 1 μL,模板 DNA 2 μL,超纯水21 μL。PCR扩增程序为94℃预变性5 min,94℃变性1 min,52℃退火 1 min,72℃延伸 2 min,30个循环,72℃延伸10 min。PCR产物送北京博尚生物技术有限公司进行序列测定。
1.3.6.2 系统发育分析 登录 GenBank(http://www.ncbi.nlm.nih.gov)对菌株16SrDNA测序结果利用Blast进行检索,并下载相关属种的16S rDNA 序列, 采用 DNAMAN、DNAclub、MEGA3.1等软件进行同源性分析,并构建系统进化树。
2 结果与分析
2.1 菌种的分离筛选
2.1.1 菌种的初筛 从泰安周边的树林土、果蔬摊土、活禽摊土等样品中进行菌株的分离、筛选。经过1~2 d的培养,平板上出现明显的菌落,经过反复分离纯化,共分离出细菌菌株56株;菌株菌落多为白色、黄色、浅黄色,还有部分为褐色、黄褐色,菌落多数为圆形,表面光滑;菌体多为粗短不一的杆状、球状。将其中革兰氏染色为阳性的菌株保存备用,共保存42株。
土木工程的项目施工过程有很强的流动性,当前施工工程规模不断扩大,造成了当前土木工程的施工地点往往不固定,施工中需要进行多次的移动。同时,土木工程中施工人员大都未能经过完善的训练和学习,专业施工技术的缺乏使得土木工程施工技术使用存在不足,且施工人员流动性强。这两类问题往往造成了施工内容和施工质量的不稳定,直接影响了土木工程施工效率和施工质量。
2.1.2 菌种的复筛 纸层析结果发现,从活禽摊土分离到的菌株的发酵液均有层析带出现,果蔬摊土及树林土中分离到的菌株中仅有个别的菌株有层析带的出现,并且与L-Gln标准品在同一位置。表明这些菌株的发酵液中含有L-Gln,其中有6株的L-Gln的含量在1 g/L以上,但含量最高的也仅有2 g/L左右,其编号为BL-12。
2.2 菌株BL-12的诱变选育 菌株BL-12经过紫外线和硫酸二乙酯化学诱变,再经过磺胺胍、高浓度硫酸铵平板筛选和摇瓶发酵,筛选得到一株具有磺胺胍、高浓度硫酸铵抗性的菌株BLCC7-0162,在未经培养基优化的条件下,可产生L-Gln 8.0 g/L左右。
2.3 菌株BLCC7-0162生长曲线的测定 由图1可以看出,菌株BLCC7-0162的延滞期是0~2 h,较短,2 h后进入对数生长期,10 h达到稳定期,稳定期持续的时间比较长。
2.4 菌株BLCC7-0162发酵培养基的优化

图1 菌株BLCC7-0162的生长曲线
2.4.1 碳酸钙浓度对菌株合成L-Gln的影响 发酵液中由于硫酸铵的不断利用及伴随着谷氨酸和L-Gln的形成,使发酵液的pH值下降,进而影响菌株的生长和产物的形成。碳酸钙具有缓冲发酵液pH的作用,因此可使pH维持在一个比较适宜的水平。从图2可以看出,不同的碳酸钙添加水平对菌株合成L-Gln的能力有较大的影响,在发酵培养基中添加3%的碳酸钙更有利于L-Gln的积累。过高,会影响菌体生长和发酵期间的溶氧,过低,无法中和氢离子,导致发酵液pH下降,不利于L-Gln的合成。

图2 碳酸钙浓度对L-Gln产量的影响
2.4.2 葡萄糖浓度对菌株合成L-Gln的影响 葡萄糖能够直接影响到菌体的生长和产酸的水平。本试验采用不同浓度的葡萄糖进行发酵。从图3可以看出,葡萄糖含量在12%以下时,L-Gln产量相对较高,大于14%时L-Gln产量明显下降。
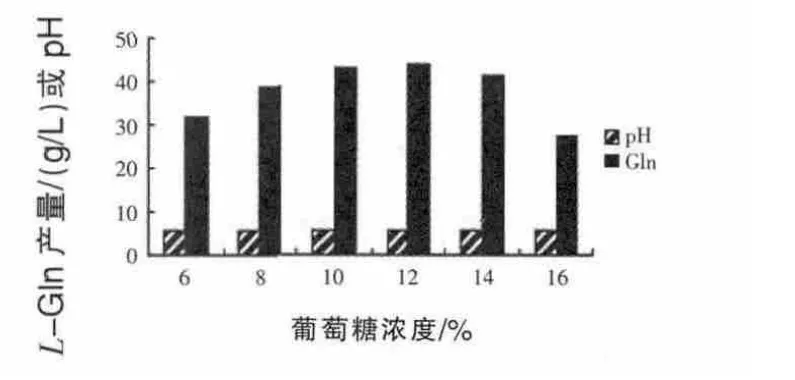
图3 葡萄糖浓度对L-Gln产量的影响
2.4.3 硫酸铵浓度对菌株合成L-Gln的影响 硫酸铵为菌株的生长提供了氮源,同时高浓度的NH4+是L-Gln发酵中抑制谷氨酸合成以及刺激L-Gln合成的必要条件,所以要求培养基中必须有较高水平的硫酸铵。但NH4+的浓度过高会抑制L-谷氨酰胺合成酶的活性,不利于L-谷氨酸向L-谷氨酰胺的转化。从图4可以看出,硫酸铵浓度在6%以下时,L-Gln的合成相对较高,其中以4%时产量最高,在7%以上明显下降。

图4 硫酸铵浓度对L-Gln产量的影响
2.4.4 玉米浆浓度对菌株合成L-Gln的影响 由于玉米浆的主要成分是氨基酸和多肽类,还含有丰富生长因子,成分较复杂,其成分受玉米来源及处理方法的影响而不同。本试验考察了添加不同浓度的玉米浆对菌株合成L-Gln的影响,结果见图5。从图5可以看出,随着玉米浆浓度的增加,L-Gln的合成量呈下降趋势,添加量为0.5%时,L-Gln的合成量相对较高。

图5 玉米浆浓度对Gln产量的影响
2.4.5 不同初始pH对菌株合成L-Gln的影响L-Gln在菌株合成累积的过程中会被L-谷氨酰胺酶降解为谷氨酸。谷氨酸是酸性氨基酸,在碱性条件下更利于谷氨酸的生成,同时由于本试验中添加了具有pH缓冲作用的碳酸钙,所以本试验采用不同的初始pH进行菌株对L-Gln合成的影响,结果见图6。从图6可以看出,起始pH为7.0~7.5时更有利于L-Gln的生成。

图6 不同初始pH对L-Gln产量的影响
2.4.6 正交试验优化培养基组成 根据上述各因素的单因子试验结果,对葡萄糖、硫酸铵及玉米浆进行3因素3水平试验,结果见表1。由表1可以看出,影响L-Gln产量的因素的主次顺序为:葡萄糖>玉米浆>硫酸铵。试验所得的最佳组合为A2B2C2,即葡萄糖12%、硫酸铵5%、玉米浆1%。采用此配方,进行验证试验,结果显示,L-Gln的产量为(45.82±1.23)g/L。 因此,后续试验采用此配方进行。

表1 L9(33)正交试验设计及结果分析
2.4.7 正交试验优化培养基中无机盐的组成 以筛选出的葡萄糖12%、硫酸铵5%、玉米浆1%、碳酸钙3%为基础配方,进行硫酸镁、硫酸锌、硫酸锰及磷酸二氢钾的四因素三水平正交试验。由表2试验结果可以看出,影响L-Gln产量的因素的主次顺序为:磷酸二氢钾>硫酸锌>硫酸镁>硫酸锰。试验所得的最佳组合为A2B1C1D2,即磷酸二氢钾 0.1%、硫酸镁 0.04%、硫酸锰 2 mg/L、硫酸锌2.5 mg/L。采用此配方,进行验证试验,结果显示,L-Gln 的产量为(46.89±1.06)g/L。
2.5 菌株BLCC7-0162的鉴定
2.5.1 菌落及菌体形态 该菌株在筛选培养基上培养24 h,其菌落呈圆形,白色,边缘整齐,表面光滑、湿润,显微镜下观察菌体呈短杆至小棒状,有时微弯曲,两端钝圆,单个或成八字排列,革兰氏染色阳性。
2.5.2 16S rDNA序列和系统发育分析 该菌株的PCR产物电泳结果显示,在分子量大小为1500 bp左右得到一条特异性好的条带,与预期结果一致(图7)。

表2 L9(34)正交试验设计及结果分析

图7 菌株BLCC7-0162 16S rDNA的PCR电泳图
将菌株BLCC7-0162的16S rDNA序列与http://www.ncbi.nlm.nih.gov网站上己登录的部分菌株的16S rDNA基因序列进行比对,结果显示菌株BLCC7-0162与已报道的Corynebacterium glutamicum (DQ171711.1)的序列同源性达到100%。鉴定该菌株属于谷氨酸棒状杆菌。
选择与BLCC7-0162同源性较高的部分已登录的相关菌株序列,用ClustalX1.83软件进行阵列比对后利用MEGA 3.1软件进行分析,构建系统进化树(图8)。
3 小结
3.1 从树林土、果蔬摊土、活禽摊土等样品中分离筛选到6株产L-Gln含量在1 g/L以上的菌株,发现其中活禽摊土是L-Gln产生菌较好的来源。

图8 菌株BLCC7-0162与相关菌株的系统进化关系
3.2 以BL-12为出发菌株,经过紫外线及化学(硫酸二乙酯)诱变,再通过磺胺胍、高浓度硫酸铵定向筛选,得到一株产L-Gln能力较强的菌株BLCC7-0162,在未经培养基优化的条件下,三角瓶发酵48 h可以产生8.0 g/L的L-Gln。
3.3 通过对发酵培养基及发酵条件进行优化,菌株BLCC7-0162经60 h摇瓶发酵后L-Gln产量达到47 g/L左右。优化后的培养基为:葡萄糖12%、硫酸铵5%、玉米浆1%、磷酸二氢钾0.1%、硫酸镁0.04%、硫酸锰2 mg/L、硫酸锌2.5 mg/L、碳酸钙3%、初始pH 7.0~7.5。
[1]李爽,章健,解云峰,等.L-谷氨酰胺发酵条件的研究[J].工业微生物,1998,28(4):7 ~ 10.
[2]刘春晖,张伟国.L-谷氨酰胺产生菌的选育和代谢流量分析[J].生物技术,2009,19(4):63.
[3]汪世华,白文钊,吴思方,等.L-谷氨酰胺高产菌株的诱变育种[J].食品科学,2002,23(3):64 ~ 67.
[4]张克旭,刘永生,张凤珊,等.L-谷氨酰胺生产菌的选育及均匀设计在发酵条件试验中的应用[J].食品与发酵工业,1992,2:21~25.
[5]YamadaS,NabeK,Ujimaru T,etal.L-Glutamine formation by Flavobacterium rigense[J].Appl Environ Microbiol,1979,37:1063 ~ 1066.

