桉树叶片双向电泳体系的建立及优化
陈慧洁,郭朦朦,冯丽贞,2,林燕萍,许 诺,邹霖湘
(1.福建农林大学林学院;2.福建农林大学森林保护研究所,福建福州350002)
桉树是桃金娘科(Mytaceae)桉树属(Eucalyptus)、杯果木属 (Angophora)和伞房属(Corymbia)植物的统称[1],具有许多优良的生物学特性,环境适应性强,生长速度快,病虫害少,木材用途广,是世界上著名的经营利用树种之一,具有重要的经济价值.近年来随着经济和需求的日益增长,桉树人工引种和造林面积迅速扩大,桉树种类的局限性、林木遗传组成的单一化及粗放式的栽培和经营管理导致桉树病害频发,发生面积也不断扩大.桉树焦枯病主要为害桉树苗木以及4 a以下的幼林和萌芽林,是桉树苗木生产极具毁灭性的病害之一[2-3].热带和亚热带地区的桉树密集种植区是该病害的高发区,病害一旦爆发可导致桉树林大面积枯萎死亡.
从蛋白质领域入手研究病原菌胁迫下植物的抗病防御机制是目前最为有效的研究方法之一.在病原菌胁迫下,植物启动抗病防御机制是一个复杂的动态过程,而蛋白质作为基因功能的执行者具明显的动态性,可直观地掌握这一复杂动态互作过程[4-5],有助于更全面系统地认识病原菌胁迫下植物的抗病特点及细胞代谢的多个生物学过程[6-7].本研究对桉树叶片蛋白制备、裂解液成分、裂解条件及上样量进行探讨,建立一套重复性好、分辨率高且适用于桉树叶片的双向电泳技术体系,为后期研究焦枯病菌胁迫下其蛋白质组的变化、深入了解桉树响应焦枯病机理,以及开展桉树诱导抗病性研究奠定基础.
1 材料与方法
1.1 供试材料
桉树种系“巨尾桉广9”(E.grandis×E.urophylla guang 9)由福建永林集团种苗中心提供.将苗高20 cm桉树组培苗种植在福建农林大学科技园内.取顶叶下完全展开的成熟度一致的功能叶片,迅速放入液氮中,并保存在-80℃备用.
1.2 主要试剂与仪器
主要试剂包括 2-Me、Acr、AP、Bis、BSA、CHAPS、DTT、甘油、甘氨酸、硫脲、尿素 SDS、TEMED、Tris、溴酚蓝等(上海生工提供);IAA、琼脂糖由Amresco公司提供;G-250、Tris饱和酚由Solarbio公司提供;IPG buffer、IPG胶条由GE公司提供;低分子量蛋白由Takara公司提供;TCA、硝酸银、冰醋酸、丙酮等均为国产分析纯试剂.
主要仪器有等电聚焦仪、垂直电泳槽(SE600和Ettan DALTⅡ)、凝腔扫描仪、图像分析软件(Image Master 2D Platinum 7.0),均由GE 公司提供.
1.3 样品制备
1.3.1 桉树叶片总蛋白的提取 分别采用TCA/丙酮沉淀法[8]、苯酚抽提法[9]、TCA/丙酮沉淀/苯酚抽提法[10]提取桉树叶片总蛋白.
1.3.2 蛋白裂解 裂解缓冲液Ⅰ包括 7 mol·L-1尿素、2 mol·L-1硫脲、0.04 g·mL-1CHAPS、60 mmol·L-1DTT、0.5%(体积分数)IPG Buffer.裂解缓冲液Ⅱ包括 9 mol·L-1尿素、0.04 g·mL-1CHAPS、60 mmol·L-1DTT、0.5%(体积分数)IPG Buffer.同时蛋白重溶解条件设置为:(1)将蛋白溶液置于超声波清洗器中室温超声处理,每超声处理1.5 min,即振荡蛋白溶解液30 s,重复10次,控制超声波清洗器中水的温度在35℃以下;(2)30℃恒温水浴中重溶解蛋白1 h,不断振荡.
1.3.3 蛋白定量 采用Bradford法进行蛋白定量.
1.4 双向电泳
预试验结果表明,采用18 cm、pH 4-7的IPG线性胶条进行双向电泳,蛋白分离效果好.
1.4.1 样品上样及等电聚焦 在蛋白定量的基础上,每根胶条通过300、150、100、50 μg的上样量梯度来确定样品2-DE的最佳上样量.20℃室温下,将胶条置于泡涨盘中被动水化18 h后,转移至聚焦盘进行等电聚焦.等电聚焦参数见表1.
1.4.2 胶条的平衡 从-20℃冰箱中取出平衡液Ⅰ、Ⅱ,在室温下
解冻,然后向其中加入1%(质量分数)DTT和2.5%(质量分数)IAA.等电聚焦结束后,取出IPG胶条,先后在平衡液Ⅰ、Ⅱ中各平衡15 min.
1.4.3 SDS-PAGE 将IPG胶条转至事先灌好的10%(质量分数)分离胶上,并按如下参数进行电泳:恒流10 mA下运行1 h,恒流30 mA电泳至溴酚蓝指示线距胶底部1-2 cm.
1.4.4 凝胶染色 采用银染法对凝胶进行染色[11].
1.4.5 图像扫描与分析 染色后的凝胶用扫描仪按要求进行扫描,采用Image Master 2D Platinum 7.0软件进行分析.

表1 等电聚焦参数Table 1 Parameters of isoelectro focusing
2 结果与分析
2.1 提取方法对蛋白分离效果的影响
通过比较图1中a、c抽提法得到的电泳结果可看出,采用这2种方法得到的条带总体清晰度较一致,但a电泳图谱上分子质量为70 ku以上的条带模糊,分子质量为40 ku以下的背景较深,条带直接分离效果不佳.图1中b抽提法得到的电泳条带总体分布情况与c的较一致,但其图谱背景较深,条带总数及清晰度都不如c抽提法.图1中c抽提法得到的图谱背景最浅,分辨率最高,蛋白条带最多,条带比a、b抽提法的清晰.此外,虽然图1中c抽提法得到的条带在50 ku左右存在高丰度蛋白,但并不影响其整体效果.由此可见,TCA/丙酮沉淀/苯酚抽提法较适用于桉叶蛋白的提取.
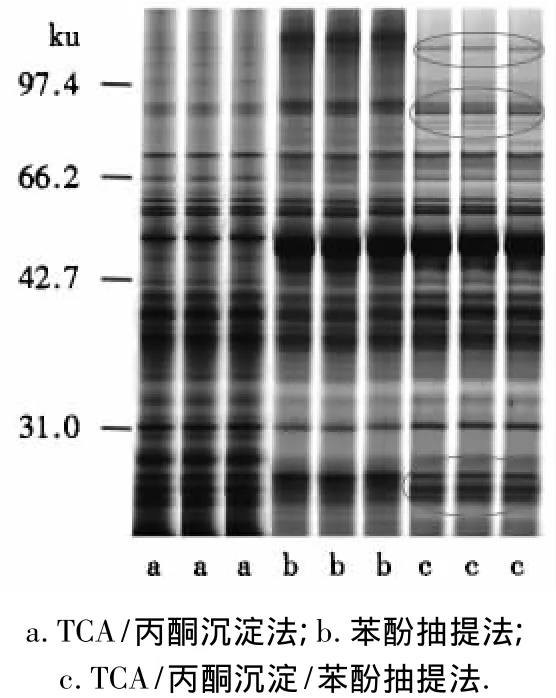
图1 蛋白不同提取法对桉树叶片蛋白SDS-PAGE图谱的影响Fig.1 Effects of different extraction methods on the SDS-PAGE map of eucalyptus leaves protein
2.2 裂解缓冲液及裂解条件对蛋白分离效果的影响
从图2可看出,采用裂解液Ⅱ(b)裂解的蛋白凝胶图谱的背景浅,丰度低的蛋白条带较模糊,蛋白重溶解的溶解度较低;而采用裂解液Ⅰ(a)裂解的蛋白图谱整体背景较深,但整体条带较清晰,蛋白重溶解的溶解度较前者有所提高.因此,裂解液Ⅰ(a)为较优选择.
通过比较图3中a和b条件下得到的桉树叶片蛋白质SDS-PAGE图谱可知,采用相同裂解缓冲液溶解蛋白时,室温超声处理(a)与30℃恒温水浴处理(b)所得的结果无明显差异.
2.3 上样量对蛋白分离效果的影响
上样量对电泳结果的清晰程度有很大影响,它直接决定了蛋白点的分布和检测.上样量太多,则高丰度蛋白会掩盖周围的蛋白点,影响等电聚焦,导致凝胶图谱产生横纵向条纹、蛋白点拖尾及银染时点饱和等现象;上样量太少,则低丰度蛋白点较模糊,甚至无法在凝胶上显示,严重影响蛋白点的检测和电泳的准确性.从图4可看出,图4C的2-DE图谱背景色深,横纵条纹多,蛋白分离效果差,高丰度蛋白成片出现,图谱分辨率低,清晰可辨的蛋白点非常少;图4D的2-DE图谱背景色较均匀,分离蛋白点较多,但仍然可见较多的高丰度蛋白交叉、重叠,造成蛋白点横纵向拖尾及边缘低丰度蛋白表达受限,尤其是Rubisco高度表达使凝胶碱性端清晰可见的蛋白点减少;图4E的2-DE图谱横纹、拖尾等情况较图4D有明显改善,但仍有较多的高丰度蛋白,Rubisco所造成的影响仍存在;图4F的2-DE图谱背景色浅,分辨率高,横纵条纹少,蛋白点之间边界清晰,分离效果较好.因此,在高丰度Rubisco存在的情况下,为获得蛋白分离均匀、分辨率高的凝胶图谱,确定50 μg为最佳上样量.

图2 不同裂解液对桉树叶片蛋白质SDS-PAGE图谱的影响Fig.2 Effect of lysis buffers on SDS-PAGE map of eucalyptus leaves protein

图3 不同裂解条件下桉树叶片蛋白质SDS-PAGE图谱的影响Fig.3 Effect of different dissolving conditions on SDS-PAGE map of eucalyptus leaves protein
3 讨论
3.1 蛋白样品的制备及裂解
蛋白质样品制备是双向电泳技术的关键步骤之一.桉树叶片含有较多的黄酮类、有机酸类、多酚类、油脂等次生代谢产物,容易造成双向电泳凝胶图像的拖尾、背景色深等问题[12-13].因此,本研究在进行桉叶液氮研磨时加入适量PVPP以吸附酚类化合物,减弱其对电泳的干扰.本试验比较了TCA/丙酮沉淀法、苯酚抽提法和TCA/丙酮沉淀/苯酚抽提法提取桉树叶片蛋白的SDS-PAGE电泳结果,发现采用TCA/丙酮沉淀/苯酚抽提法提取蛋白得到的电泳图谱背景浅,条带清晰,数量较多;采用TCA/丙酮沉淀法提取蛋白的电泳图谱,70 ku以上的高分子质量蛋白减少,分子质量低于40 ku的背景较深,表明蛋白样品含较多杂质,且在蛋白重溶解中有部分高分子质量的蛋白损失;苯酚抽提法提取蛋白的电泳图谱背景色较深,表明蛋白样品中仍有杂质未得到有效去除[14-18].因此,宜选择TCA/丙酮沉淀/苯酚抽提法.
TCA/丙酮沉淀/苯酚抽提法是将TCA/丙酮沉淀法与苯酚抽提法有机结合,兼具二者的优点,可有效去除蛋白样品中的有机物等杂质,从而得到较清晰的凝胶图谱.但该方法的步骤繁多,易导致蛋白损失.因此蛋白提取过程中应适当减少重复步骤和缩短相应时间.
蛋白重溶解时蛋白样品的溶解度和离子强度是可否获得较清晰的凝胶图谱的关键.本研究比较了蛋白样品在加硫脲和不加硫脲的裂解液中重溶解的电泳结果,发现加硫脲的裂解液所重溶解的蛋白条带较清晰,溶解度较高.表明裂解液中加入硫脲和尿素,可打开蛋白的三维结构并抑制蛋白聚集,提高蛋白的溶解度,适用于桉叶蛋白的重溶解.在蛋白裂解过程中,需将裂解温度控制在37℃以内,以防因尿素在37℃时发生降解致使蛋白发生氨基甲酰化,引起蛋白点的等电点改变,在凝胶图谱上形成成串的点[9,19].

图4 不同上样量对桉树叶片2-DE图谱的影响Fig.4 Effects of protein-loading amount on 2-DE map of eucalyptus leaves protein
3.2 上样量的确定
IPG胶条的上样量是影响2-DE图谱质量的重要因素之一,它因样本类型、水化方式、胶条长度及其pH范围和凝胶的染色方法等的不同而有所差异[20-21].一般情况下,长且窄的pH范围的胶条需要较高的上样量.此外,采用考马斯亮蓝染色时其上样量要比银染的多.本试验比较了300、150、100、50 μg 4种不同上样量的双向电泳结果,发现在上样量为50 μg时,得到图谱的分辨率高,横纵条纹少,蛋白点之间边界清晰,分离效果较好;而增加上样量受高度表达Rubisco的影响,出现蛋白点的横纵向拖尾及边缘低丰度蛋白表达受限等问题.因此,上样量以50 μg为最佳.
综上所述,桉树叶片最适双向电泳体系为:采用 TCA/丙酮沉淀/苯酚抽提法制备蛋白质;以7 mol·L-1尿素、2 mol·L-1硫脲、0.04 g·mL-1CHAPS、60 mmol·L-1DTT、0.5%(体积分数)IPG buffer作为蛋白裂解裂解缓冲液;对于18 cm、pH 4-7的线性胶条,每根胶条的上样量为50 μg,并采用银染.
[1]王豁然.桉树生物学概论[M].北京:科学出版社,2010:76-93.
[2]CHEN S,LOMBARD L,ROUX J,et al.Novel species of Calonectria associated with Eucalyptus leaf blight in Southeast China[J].Persoonia-Molecular Phylogeny and Evolution of Fungi,2011(26):1-12.
[3]祁述雄.中国桉树[M].2版.北京:中国林业出版社,2002:1-226.
[4]朱永生,蔡秋华,罗曦,等.蛋白质组学在植物病理学上的应用研究[J].福建农业学报,2012,27(3):305-311.
[5]ARANJUELO I,MOLERO G,ERICE G,et al.Plant physiology and proteomics reveals the leaf response to drought in alfalfa(Medicago sativa L.)[J].Journal of Experimental Botany,2011,62(1):111-123.
[6]LEE J,FENG J,CAMPBEII K B,et al.Quantitative proteomic analysis of bean plants infected by a virulent and avirulent obligate rust fungus[J].Molecular & Cellular Proteomics,2009,8(1):19-31.
[7]AHSAN N,LEE D G,ALAM I,et al.Comparative proteomic study of arsenic-induced differentially expressed proteins in rice roots reveals glutathione plays a central role during As stress[J].Proteomics,2008,8(17):3561-3576.
[8]靖长柏.浙江沿海3种桉树抗寒性及其机理研究[D].杭州:浙江农林大学,2011.
[9]魏开华.蛋白质组学实验技术精编[M].北京:化学工业出版社,2010:21-22.
[10]WANG W,TAI F,CHEN S.Optimizing protein extraction from plant tissues for enhanced proteomics analysis[J].Journal of Separation Science,2008,31(11):2032-2039.
[11]YAN J X,WAIT R,BERKELMAN T,et al.A modified silver staining protocol for visualization of proteins compatible with matrix-assisted laser desorption/ionization and electrospray ionization-mass spectrometry[J].Electrophoresis,2000,21(17):3666-3672.
[12]FLENGSRUD R,KOBRO G.A method for two-dimensional electrophoresis of proteins from green plant tissues[J].Analytical Biochemistry,1989,177(1):33-36.
[13]于冯,郑春芳,施孟如,等.红树植物秋茄叶片双向电泳技术体系的建立及优化[J].热带亚热带植物学报,2011,19(6):519-523.
[14]GRANIER F.Extraction of plant proteins for two-dimensional electrophoresis[J].Electrophoresis,1988,9(11):712-718.
[15]DAMERVAL C,DE V D,ZIVY M,et al.Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J].Electrophoresis,1986,7(1):52-54.
[16]胡敏,徐凌飞,张军科,等.梨叶片总蛋白提取及双向电泳体系的建立[J].西北农林科技大学学报:自然科学版,2012,40(1):33.
[17]GÖRG A,WEISS W,DUNN M J.Current two-dimensional electrophoresis technology for proteomics[J].Proteomics,2004,4(12):3665-3685.
[18]李肖芳,韩和平,王旭初,等.适用于盐生植物的双向电泳样品制备方法[J].生态学报,2006,26(6):1848-1853.
[19]张燕,何文锦,叶冰莹,等.甘蔗叶片蛋白质组双向电泳技术优化[J].福建师范大学学报:自然科学版,2011,27(1):80-84.
[20]BOGUTH G,HARDER A,SCHEIBE B,et al.The current state of two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2000,21(6):1037-1053.
[21]郝强,葛秀秀,张睿鹂,等.北方常绿阔叶木本植物叶片蛋白质双向电泳技术体系优化[J].西北植物学报,2010,30(9):1906-1912.

