基于单壁碳纳米管涂层纤维的固相微萃取技术测定水中的杀菌剂
林宏立,李权龙,陈 猛,关 雄
(1.福建农林大学生物农药与化学生物学教育部重点实验室,福建福州350002;2.厦门大学环境与生态学院,福建厦门361005)
杀菌剂是用于防治由各种病原微生物引起的植物病害的一类农药,其在农业中的大量使用不可避免地对水体造成污染,在一些水体中经常被检出[1-3].其中百菌清为水源水、饮用水的必检指标,其限量值为0.01 mg·L-1[4].分析水中此类农药所用的样品预处理方法包括液 - 液萃取[5]、固相萃取[1-3,6]、固相微萃取[7-8]等.
单壁碳纳米管(single-walled carbon nanotubes,SWCNTs)是由单层石墨卷曲而成的纳米尺寸的管子,具有良好的化学稳定性和很强的吸附性能.以SWCNTs为涂层的SPME纤维已成功应用于水中多种农药和环境内分泌干扰物的测定[8].本研究选取水中4种常见的杀菌剂(百菌清、三唑酮、稻瘟灵和异菌脲)为目标化合物,考察SWCNTs纤维的萃取性能,并优化萃取条件,建立了水中上述杀菌剂的固相微萃取-气相色谱分析方法,并将其用于实际水样的分析.
1 材料与方法
1.1 仪器与试剂
6890气相色谱仪配电子捕获检测器(μECD)购自美国Agilent公司;HP-35色谱柱(30.0 m×320 μm×0.25 μm)购自美国J&W Scientific公司;SPME专用采样台及手柄购自美国Supelco公司.
分析纯百菌清(chlorothalonil)、三唑酮(triadimefon)、稻瘟灵(isoprothiolane)和异菌脲(iprodione)购自上海西格玛奥德里奇贸易有限公司;HPLC级丙酮、乙酸乙酯购自美国Tedia公司;分析纯盐酸和氢氧化钠购自上海化学试剂厂;超纯水系统购自Millipore Simplicity公司.
分别称取10.0 mg的各农药标准品置于10 mL棕色容量瓶中,用丙酮溶解并定容,得到1000 mg·L-1的单标储备液.将单标储备液按百菌清∶三唑酮∶稻瘟灵∶异菌脲=2∶5∶10∶100的体积比混合后,用丙酮稀释,得到浓度分别为2、5、10和100 mg·L-1的混标储备液.
1.2 水样采集
本试验中使用的河水采自九龙江华安段,农田水取自厦门翔安沙美村农田.水样经过0.45 μm的玻璃纤维膜过滤,装入棕色瓶中,于4℃保存备用,12 h内完成检测.
1.3 SWCNTs萃取纤维的制备
采用电泳沉积法制备SWCNTs纤维,并用高温氢气处理[9].将商品固相微萃取头上的纤维取下,换上SWCNTs纤维,得到自制的SWCNTs萃取头.
1.4 色谱分离条件
升温程序如下:初始温度80℃,以45℃·min-1上升到210℃,再以10℃·min-1增至260℃,保持4.5 min.后运行:300 ℃,保留3 min.进样口温度280 ℃,载气(高纯氮)流速1.0 mL·min-1,采用不分流模式.检测器温度300℃,尾吹氮气流速40.0 mL·min-1.在此条件下,4种目标化合物在12 min内实现基线分离.
1.5 萃取过程
采用DI(direct immersion)-SPME方式在室温下进行萃取.取10 mL待测水样于15 mL的萃取瓶中,放入磁力搅拌子,盖上有聚四氟乙烯隔垫的瓶盖,置于磁力搅拌器上,将SWCNTs萃取头插入样品瓶中,推出纤维使其浸没于水中.萃取完成后,缩回萃取纤维,并立即插入GC进样口进行热脱附,用色谱峰面积定量.每个样品平行测定3次.
2 结果与分析
2.1 SPME萃取条件的优化
本研究基于SWCNTs纤维,采用GC-ECD法测定水中的杀菌剂,考察了热脱条件、搅拌速度、pH值、离子强度、萃取时间等因素对纤维萃取效率的影响.优化试验所用的水样的配制:往10 mL超纯水中加入20 μL混标储备液.
2.1.1 热脱附条件的确定 GC进样口温度为300℃,考察脱附时间分别为1、3、5和7 min时目标物的脱附情况.结果表明,随着热脱附时间的延长,目标物的脱附量略有增加,5 min后趋于稳定.将脱附5 min的纤维再次插入进样口脱附,未见目标物的色谱峰,说明目标物已完全脱附,没有残留.因此,脱附条件为300℃下热脱附5 min.
2.1.2 水样搅拌状态对萃取的影响 在室温、萃取时间为15 min、不调节pH和水样离子强度的试验条件下,考察了搅拌速度分别为300、500、700、1000 r·min-1时,SWCNTs纤维对4种杀菌剂的萃取量,结果表明:随着搅拌速度的增加,纤维上的萃取量随之增大;搅拌速度为1000 r·min-1时,萃取量最大;搅拌速度大于1000 r·min-1时,磁力搅拌子不稳定.因此,本试验确定搅拌速度为1000 r·min-1.
2.1.3 pH值对萃取量的影响 用1 mol·L-1的NaOH和HCl溶液调节水样的pH值分别为1、2、4、6和12,在室温、萃取时间为15 min、转速为1000 r·min-1的试验条件下,考察了不同pH值下SWCNTs纤维的萃取效率,结果见图1.由图1可知,百菌清和异菌脲的萃取量随着pH值的增大而减小,pH值为1时萃取量最大;三唑酮和稻瘟灵的萃取量则随着pH值的增大,呈先增加后减小的趋势.这种萃取效率差异与各目标物的结构和性质有关.综合考虑,选定最佳pH值为2.
2.1.4 萃取时间对萃取量的影响 萃取时间是影响SPME纤维萃取效率的一个重要因素.在温度为室温、搅拌速度为1000 r·min-1、水样的pH为2、不调节水样离子强度的试验条件下,考察了萃取时间分别为15、30、45、60 min时,SWCNTs纤维对4种目标物的萃取量.结果表明,随着萃取时间的延长,纤维上萃取量逐渐增加,萃取时间为60 min时,萃取过程仍未达到平衡.这可能是由SWCNTs纤维涂层上存在的纳米尺寸孔洞引起的,目标物在这些孔洞中的扩散速度很慢.综合考虑速度和方法的灵敏度,最后确定萃取时间为30 min.

图1 水样pH值对纤维萃取效率的影响(n=3)Fig.1 Effect of pH on the extraction efficiency of SWCNTs fiber(n=3)
本研究考察了水样离子强度对目标物萃取量的影响,发现加入大量NaCl后,热脱附时有盐在纤维上析出,导致萃取纤维难以缩回.由此确定不调整水样的离子强度.
根据上述试验结果,确定用SWCNTs纤维萃取水中4种杀菌剂的试验条件为:300℃热脱附5 min,搅拌速率1000 r·min-1,调整pH值为2,不调节离子强度,萃取时间30 min.建立了水中4种杀菌剂的固相微萃取-气相色谱分析方法.
2.2 方法的准确度和精密度
配制一系列百菌清(0.2 -20 μg·L-1)、三唑酮(0.5 -50 μg·L-1)、稻瘟灵(1 -100 μg·L-1)和异菌脲(10-1000 μg·L-1)的标准水样,采用所建立的方法测定;以各目标物的色谱峰面积和浓度绘制工作曲线,得到4种目标物的线性范围和相关系数(R2);分别以3倍和10倍的信噪比确定方法的检测限(LOD)和定量限(LOQ);用同一根纤维萃取3份平行水样,考察了所建立方法的相对标准偏差(RSD),结果见表1.从表1可见,4种目标物在上述浓度范围内有很好的线性相关,相关系数大于0.9956,方法的LOD为0.022 -0.987 μg·L-1,LOQ 为 0.075 -3.259 μg·L-1,方法的精密度大于7.8%(n=3).
2.3 实际水样测定
利用所建立的方法测定河水和农田水,结果表明,2个水样中均未检出目标物.向河水和农田水中加标,百菌清、三唑酮、稻瘟灵和异菌脲的加标浓度分别为 1、2.5、5、50 μg·L-1(低浓度)和 10、25、50、500 μg·L-1(高浓度),加标回收率见表2、3.4种目标物的加标回收率为71.9% -110.2%,方法的精密度高于9.1%(n=3).结果表明,所建立的方法适用于分析水中的4种目标物.
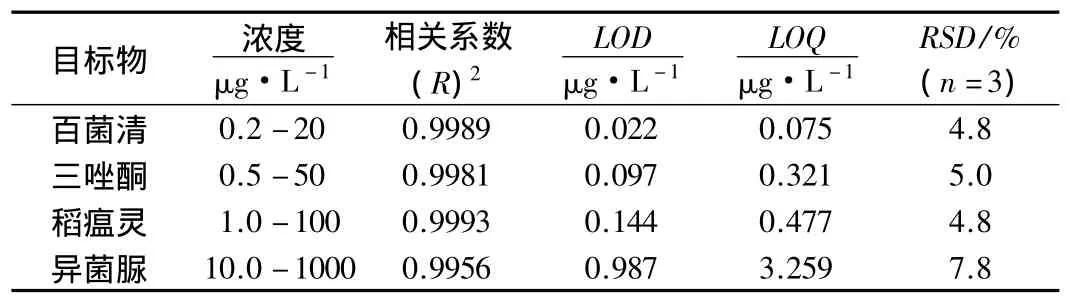
表1 所建立的方法的性能指标Table 1 Characteristic data of established method
3 小结与讨论
本试验利用SWCNTs纤维,建立了水中4种杀菌剂的固相微萃取-气相色谱分析方法,并考察了SWCNTs纤维的性能.结果表明,SWCNTs纤维能在pH为1的条件下正常工作,对4种不同结构的杀菌剂都有较好的萃取能力.所建立的分析方法灵敏度高,检出限优于液-液萃取法,与固相萃取[3]和固相微萃取方法[5-8]相近,重现性较好,能满足水中杀菌剂实际检测的要求.
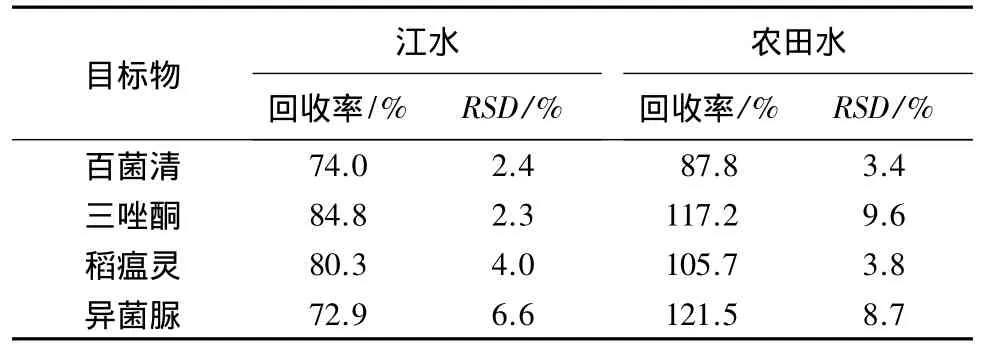
表2 低浓度下方法的加标回收率和精密度1)Table 2 Recoveries and precisions of the established method at low concentration
1)百菌清、三唑酮、稻瘟灵和异菌脲的加标浓度分别为1、2.5、5 和50 μg·L-1.

表3 高浓度下方法的加标回收率和精密度1)Table 3 Recoveries and precisions of the established method at high concentration
[1]宋伟,林姗姗,孙广大,等.固相萃取-气相色谱-质谱联用同时测定河水和海水中87种农药[J].色谱,2012,3(3):318-326.
[2]陈猛,陆婉清,韩燕,等.固相萃取-气相色谱法对河水与海水中36种农药残留的同时测定[J].分析测试学报,2009,28(12):1378-1383.
[3]游明华,孙广大,陈猛,等.环境水样中9种三唑类农药的固相萃取-气相色谱-质谱分析[J].色谱,2008,26(6):704-708.
[4]刘艳,王玫,黄春燕.水中百菌清的气相色谱测定法[J].环境与健康杂志,2010,27(6):524-525.
[5]向彩红,冯丽清,刘序铭.气相色谱法测定水源水、饮用水中百菌清[J].广州化工,2008,36(3):57-58.
[6]陈剑刚,朱克先,张亦庸.固相萃取-气质联用法测定水中三氯杀螨醇及百菌清[J].中国卫生检验杂志,2005,15(4):318-420.
[7]李晓晶,黄聪,于鸿.水中有机氯农药和氯苯类化合物的顶空固相微萃取-气相色谱测定法[J].环境与健康杂志,2009,26(7):626-629.
[8]冯喜兰,田孟超,李爱梅.多壁碳纳米管固相微萃取测定水中的三唑酮和噻嗪酮[J].光谱实验室,2011,28(2):504-508.

