红、黑米皮对高脂血症模型大鼠脏器组织的保护作用
徐惠龙,杨志坚,程租锌,郑金贵
(1.福建中医药大学药学院,福建福州350122;2.福建农林大学农产品品质研究所,福建福州350002)
米皮是指稻(Oryza sativa L.)的颖果经加工而脱下的果皮,其含有蛋白质、多糖、脂肪酸、维生素、肌醇、植酸和矿物质等功能性成分[1].红米和黑米是由于花色素在米皮大量积累而显示出特定颜色[2],它们不但营养丰富,而且有良好的药用功能,自古素有“药米”之称,是民间滋补佳品.红、黑米皮作为功能性食品已引起许多学者的关注,具有多途径、多环节、多靶点等特点,且长期服用无毒副作用,在预防和治疗代谢性疾病具有独特优势,并应用于抗氧化、抗动脉粥样硬化、抗肿瘤等疾病[3-5].陈起萱等[6]研究显示,红米和黑米可减轻高脂引起的兔动脉粥样硬化的发生和发展,其作用机制可能是通过改善血脂水平和提高抗氧化能力,从而减少动脉壁细胞及其他成分的氧化损伤.但以上研究主要集中在血液、主动脉少数组织上,缺乏同时观察多个组织器官的药理效应,且各组织器官之间的相互联系也被忽视.前期的研究证实,红、黑米皮不仅可以降低高脂血症(hyperlipidemia,HLP)模型大鼠的体重和器官指数,还可以改善其血脂水平[7].本试验基于前期药理效应的基础上,以肝脏、主动脉和心脏组织的病变程度为切入点,进一步研究红、黑米皮对HLP的改善作用及其可能机制.
1 材料与方法
1.1 材料
1.1.1 红、黑米皮的制备 福红819(红米)和福紫681(黑米)由福建农林大学农产品品质研究所选育,其稻谷产量高、功能成分含量高.米皮为新鲜的糙米经精米机碾25 s所制成的材料,粉碎过筛(100目)后,用蒸馏水配制成悬浮液,置4℃保存备用.
1.1.2 试验动物 健康雄性SD大鼠40只,体重180-200 g,清洁级,购自上海斯莱克试验动物有限责任公司,许可证号:SCXK(沪2007-0005).
1.1.3 试剂 主要试剂有天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(上海荣盛生物药业有限公司,批号分别为20120401、20120603),谷光甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、游离脂肪酸(free fatty acids,FFA)试剂盒(南京建成生物工程研究所,批号分别为 20120711、20120719、20120718、20120723),多聚甲醛,苏木精,伊红,无水乙醇,二甲苯.
1.1.4 仪器 主要仪器有UV-1700紫外可见分光光度计(日本岛津公司)、BT224半自动生化分析仪(意大利Biotecnica公司)、LeicaTP1020型脱水机、LeicaEG1150c型包埋机、LeicaRM2165型石蜡切片机(德国莱卡公司)、普通光学显微镜(日本尼康公司).
1.2 方法
1.2.1 大鼠分组与试验设计 试验前大鼠饲喂普通饲料,适应7 d后随机取10只作为正常对照组;其余30只用高脂饲料(含87.3%基础饲料、2%胆固醇、10%猪油、0.5%胆酸钠和0.2%丙基硫氧嘧啶)饲喂28 d,建立HLP模型(经戊巴比妥钠麻醉,眼眶静脉取血0.5 mL,分离血清检测血脂水平),随机分成模型组、红米皮组和黑米皮组,每组10只.从29 d起,正常组和模型组每千克大鼠灌胃20 mL蒸馏水,红米皮组每千克大鼠灌胃20 mL 0.09 g·mL-1红米混悬液,黑米皮组每千克大鼠灌胃20 mL 0.09 g·mL-1黑米混悬液.每天上午于8:00-9:00时灌胃1次,并记录进食量,共56 d.试验过程中,正常组饲喂普通饲料,其余各组饲喂高脂饲料,自由饮食饮水,每周称量一次体重.试验结束前,禁食(不禁水)16 h,取血处死,取肝脏、腹主动脉和心脏.
1.2.2 指标检测 采血后,离心制备血清,ALT、AST、GSH-Px、SOD和CAT的活性及FFA的浓度均按试剂盒说明书测定.取0.5 cm×0.5 cm×0.3 cm块状的肝脏、腹主动脉和心脏分别置于10%多聚甲醛溶液中固定72 h,依次用75%、95%和100%乙醇梯度脱水,石蜡包埋切片,再用95%和85%乙醇梯度脱蜡水化,苏木精—伊红(H-E)染色后,于光学显微镜下观察3种组织器官的病理改变.
1.2.3 统计学处理 数据用x±s表示,用SPSS 13.0统计软件包对数据进行统计分析,组间比较采用单因素方差分析.
2 结果与分析
2.1 大鼠进食量的变化
各组大鼠在试验期间日平均摄食量均没有发现明显的差异(P>0.05).这说明试验中所用剂量的米皮对大鼠的一般生理状况并未产生不良的影响.
2.2 大鼠血清生化指标的变化
由表1可知:食用高脂饲料后,大鼠血清ALT和AST的活性及FFA的浓度显著升高(P<0.05),而CAT、GSH-Px和SOD的活性显著降低;与模型组相比,红、黑米皮组ALT、AST的活性及FFA的浓度显著降低(P<0.05),CAT、GSH-Px和 SOD的活性均不同程度升高,其中,ALT活性分别下降了14.73%和64.50%,AST活性分别下降了16.59%和41.79%,FFA 浓度分别降低了41.54%和31.54%,CAT活性分别升高了45.09%和101.16%,GSH-Px活性分别升高了13.02%和36.26%,SOD活性分别升高了10.28%和28.60%.
2.3 大鼠肝脏病理学的变化
从图1可见:正常组大鼠的肝细胞排列非常整齐,可见圆而大的细胞核,胞浆着色较为均匀,未见脂肪变性及细胞坏死(图1A),说明普通饲料对大鼠的脂质代谢没有产生不良影响;模型组的肝细胞排列非常松散,肝细胞肿大且排列混乱,细胞内和细胞间隙可见许多大小不一的空泡,中央静脉周围病变最为明显,甚至可见炎性细胞浸润和轻度的肝细胞坏死现象(图1B),说明大量的脂质在肝脏沉积,并呈弥漫性重度脂肪变性而导致轻微的脂肪肝,已成功建立HLP大鼠模型;红米皮组的肝细胞排列较为整齐,未见有坏死的细胞,肝细胞较正常仍有肿大的现象,肝细胞间隙可见脂肪滴而形成的空泡,但脂变肝细胞数目较模型组明显减少(图1C);黑米皮组的肝细胞排列较整齐,且结构完整,接近于正常,基本上没有脂肪滴空泡,肝细胞基本恢复正常(图1D).这表明黑米皮在改善肝脏病变程度优于红米皮.
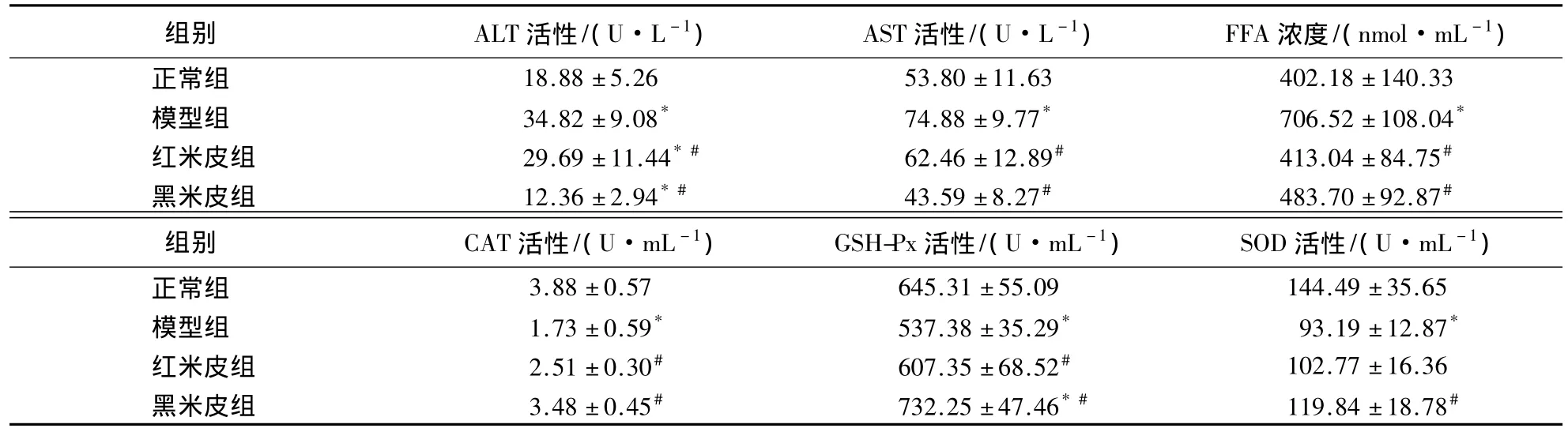
表1 大鼠血清生化指标的变化1)Table 1 The bichemical indices in serum among different groups rats
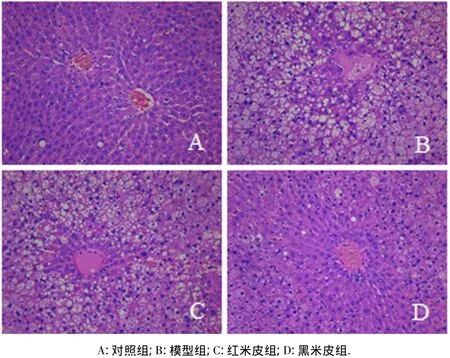
图1 大鼠肝脏病理组织学观察(10×20)Fig.1 Histopathology of liver tissues from rats in four groups(10 ×20)
2.4 大鼠主动脉横截面病理学的变化
从图2可见:正常组大鼠的主动脉形态正常,高倍镜下可见血管内膜表面光滑完整,无明显增厚,中膜边缘清晰,管腔内无赘生物(图2A);而模型组主动脉的内膜明显增厚,管腔内可见许多形状无规则、大小不一样的脂肪滴泡沫等赘生物,但血管壁上还未见动脉粥样硬化斑块(图2B);红米皮组的血管内膜表面光滑完整,稍微增厚,介于正常组和模型组之间,但未见泡沫细胞(图2C);黑米皮组的血管内膜表面光滑完整,无明显增厚,管腔内无泡沫细胞,接近于正常组(图2D).这表明黑米皮在改善主动脉病变程度优于红米皮.
2.5 大鼠心脏病理学的变化
从图3可见,各组大鼠心脏未见脂肪组织浸润而形成的空泡,这可能是由于HLP模型大鼠造模时间还不够,还未形成心肌脂肪性病变.
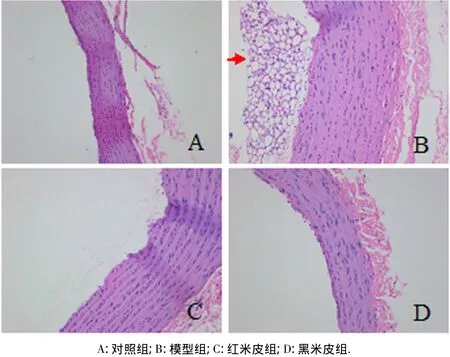
图2 大鼠主动脉横截面病理组织学观察(10×20)Fig.2 Histopathology of heart aorta from rats in four groups(10 ×20)

图3 大鼠心脏病理组织学观察(10×10)Fig3.Histopathology of heart from rats in four groups(10×10)
3 讨论
HLP易引起“血稠”,造成血管内皮细胞损伤和病灶脱落,脂质沉积于血管壁而形成斑块,逐渐形成动脉粥样硬化而堵塞血管,从而影响血液循环,严重时就会发生冠心病、非酒精性脂肪肝和心肌梗死等疾病[8].HLP及其并发症可影响机体多个脏器组织,其中涉及最直接的组织有血液、肝脏、主动脉和心脏.红、黑米皮含有酚酸、花色苷和γ-谷维素等抗氧化活性成分[9],它们可以清除体内多余的氧自由基而保护机体免受损伤,在防治HLP等心血管疾病上具有独特的疗效作用,这是本试验选择米皮作为试验原材料的重要依据.
红米和黑米可以降低主动脉脂质斑块面积[6,10]和改善肾脏脂质过氧化反应[11],而这种对器官的保护作用与其提高机体抗氧化能力[8]和免疫调节作用[12]密切相关.本试验中,红、黑米皮可以提高HLP模型大鼠CAT、SOD和GSH-Px等抗氧化酶活性,减轻肝脏、主动脉的脂肪性病变程度,对于长期高脂饮食的大鼠脏器具有一定的保护作用,这与前人[11,13]的研究结果相类似.针对改善病变效果来看,黑米皮对于HLP模型大鼠脏器的防治作用优于红米皮,这可能是由于黑米的花色苷、黄酮类物质和胡萝卜素高于红米[14-15]而导致的.
肝脏是脂质和脂肪酸代谢的中心,其功能的好坏影响血液中的脂质水平[16].脂肪肝与HLP关系密切、互为因果,HLP患者脂质代谢严重失调,肝脏逐渐沉积脂类物质而变成为一个储油罐,当血液经肝脏净化时,血液将带走一部分的脂类物质而导致黏稠度增加,从而诱发脂肪肝、动脉粥样硬化、冠心病和心肌梗塞等疾病的发生.本试验中,红、黑米皮能够抑制HLP引起血清中AST、ALT活性及FFA浓度的上升,这可能是由于米皮中的活性成分在肠道调节脂类物质在体内的消化吸收或在肝脏内结合了大量胆汁酸而排出体外,促使肝脏内的脂质源源不断地向胆汁酸代谢途径分解而转移,阻断了胆汁酸的肠肝循环,有效降低血液中的FFA浓度,这与前期的研究结果[7]相一致.
大量试验研究及流行病学调查表明,HLP是动脉粥样硬化病变形成的决定因素[17].本试验结果表明,高脂饮食大鼠主动脉内有大量的脂质沉积,说明主动脉内已经发生脂肪性病变,但可能由于诱导时间还不够长,还未形成严重的动脉粥样硬化病症;红、黑米皮组大鼠主动脉内膜虽有不同程度的增厚,但还未发生脂肪病变,这说明米皮能清除动脉内脂质沉积,改善血管内膜状况,预防动脉粥样硬化斑块的形成和发展.
综上所述,红、黑米皮对改善HLP模型大鼠脏器的病理具有积极作用,其中,黑米皮作为功能性食品对于保护机体免受氧自由基等损伤有较好的应用前景,其作用机理及剂量依存关系有待进一步的试验证实.
[1]苏越.糙米组织结构及功能特性[J].农业科技与装备,2010,191(5):20-22.
[2]王丽华,叶小英,李杰勤,等.黑米、红米的营养保健功效及其色素遗传机制的研究进展[J].种子,2006,25(5):50-54.
[3]徐惠龙,程祖锌,杨志坚,等.黑米皮对高脂血症模型大鼠的抗氧化作用[J].福建中医药大学学报,2013,23(1):15-17.
[4]CHANG H,YU B,YU X P,et al.Anticancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J].Genet Mol Res,2010,9(4):2086 -2095.
[5]夏效东,凌文华,夏敏,等.黑米花色苷提取物对APoE基因缺陷小鼠动脉粥样硬化晚期斑块的影响[J].食品科学,2006,27(3):213 -215.
[6]陈起萱,凌文华,梅节,等.黑米和红米抗动脉粥样硬化和抗氧化作用初步研究[J].营养学报,2001,23(3):246-249.
[7]徐惠龙,程祖锌,杨志坚,等.糙米皮对高脂血症大鼠血脂水平的影响[J].现代食品科技,2013,29(1):38-41.
[8]陈继承.醋粉中降血脂成分筛选及其对脂质代谢的调控[D].杭州:浙江大学,2011.
[9]LAOKUDILOK T,SHOEMAKER C F S,JONGKAEWWATTANA S,et al.Antioxidants and antioxidant activity of several pigmented rice brans[J].J Agric Food Chem,2011,59(1):193 -199.
[10]LING W H,CHENG Q X,MA J,et al.Red and black rice decrease atherosclerotic plaque formation and increase antioxidant status in rabbits[J].J Nutr,2001,131:1421 -1426.
[11]TOYOKUNI S,ITANI T,MOTIMIYDU Y,et al.Protective effect of colored rice over white rice on fenton reaction-based renal lipid peroxidation in rats[J].Free Radical Research,2002,36(5):583 -592.
[12]OKAI Y,OKADA T,HIGASHI-OKAI K,et al.Immunomodulating activities in bran extracts of Japanese red,black and brown rices[J].J UOEH,2009,31(3):231 -242.
[13]陈起萱,凌文华,马静,等.黑米和红米对高胆固醇兔主动脉脂质斑块面积和血脂的影响[J].卫生研究,2000,29(3):183-185.
[14]KIM J K,LEE S Y,CHU S M,et al.Variation and correlation analysis of flavonoids and carotenoids in korean pigmented rice(Oryza sativa L.)cultivars[J].J Agric Food Chem,2010,58(24):12804 -12809.
[15]ABDEL-AAL E S,YONG J C,RABALSKI I.Anthocyanin composition in black,blue,pink,purple,and red cereal grains[J].J Agric Food Chem,2006,54(13):4696 -4704.
[16]PEARCE J.Some differences between avian and mammalian biochemistry[J].Int J Bioch,1977,8:269 -279.
[17]BROWN B G,ZHAO X,SACCO D E,et al.Lipid lowering and plague regression:new insights into prevention of plague disruption and clinical events in coronary disease[J].Circulation,1993,89:1781 -1789.

