高效液相色谱–电感耦合等离子体质谱法分析水中硒的形态*
辛晓东,李伟,胡芳,赵清华,王明泉,孙韶华,贾瑞宝
(山东省城市供排水水质监测中心,济南 250021)
硒是生物体内必需的生物微量元素,具有重要的生理生物活性。人体内硒水平下降将直接影响骨骼、心肌及肝、眼、前列腺、甲状腺等重要的生命器官。据报道,膳食中以富硒酵母形式补充硒的摄入,可使癌症发病率、死亡率下降50%左右。我国科学家通过补硒预防治疗克山病,大骨节病,肝癌等威胁人类健康的重大疾病,在国际上已获重大进展。然而,硒是一种典型的双功能元素,适量的硒有利于人体健康,但过量摄入硒又可能导致中毒,当日均摄入量为750~950 μg 时[1],会引起硒中毒。人、马及牛一次服用硒的最小致死剂量分别为2~4,1.5,4.5~5.0 mg/kg[2]。因 此,GB 2006–5749 《生活饮用水卫生标准》中规定了饮用水中硒的限值为0.01 mg/L。
硒在自然界中的存在形态分为无机硒和有机硒。无机硒主要有单质硒、硒化物、亚硒酸盐、硒酸盐等;有机硒主要有硒代半胱氨酸、硒代胱氨酸、硒代蛋氨酸、硒乙硫基氨基酪酸、硒甲基硒代半胱氨酸、硒甲基硒代蛋氨酸、硒脲、硒胱胺、二甲基硒、二甲基二硒、三甲基硒、二乙基硒、甲基亚硒酸脂、甲基硒砜、硒蛋白等。硒的毒性和生物利用度在很大程度上取决于硒的化学形态,如亚硒酸盐的毒性略大于硒酸盐,无机硒的毒性大于以氨基酸和蛋白质结合的有机硒,硒代氨基酸、植物中的硒化合物以及水溶性硒酸钠和亚硒酸钠的生物利用度较高[3]。因此对水中不同价态硒的检测评价具有重要意义。
目前不同形态硒的检测方法主要采用高效液相色谱法(HPLC)、气相色谱(GC)或毛细管电泳法将不同形态硒分离后再连接到电感耦合等离子体质谱仪(ICP–MS)、原子荧光仪(AFS)、质谱仪(MS)等检测器进行分析[4–11]。GC–MS、LC–MS在检测时需进行衍生,操作繁琐;HPLC–ICP–MS法作为一种高灵敏的分析测试技术在金属及类金属形态分析领域得到广泛应用[12–16]。
由于水中硒含量较低,现有方法不能满足水中硒形态分析的要求,因此笔者利用高效液相色谱法,通过优化色谱流动相成分与比例,分离水中两种常见的痕量硒形态(硒酸根、亚硒酸根),结合电感耦合等离子体质谱系统,建立了水中硒形态的分析方法。该方法实现了对水中常见不同形态硒的同时分析,具有选择性好、检测范围宽、检测速度快等特点,在水质分析领域具有重要应用价值。
1 实验部分
1.1 主要仪器与试剂
电感耦合等离子体质谱仪:NexIon 300x型,美国Perkin Elmer公司;
高效液相色谱分离系统:Flexar型,美国Perkin Elmer公司;
超纯水机:Mill-iQ型,美国Millipore公司;
四丁基氢氧化铵(TBAOH):1 mol/L;
乙酸铵、乙二胺四乙酸二钾[EDTA(钾)]:分析纯;
甲醇:色谱纯;
硒酸根贮备液(以Se计):0.525 μmol/g,中国计量科学研究院;
亚硒酸根贮备液(以Se计):0.543 μmol/g,中国计量科学研究院;
实验用水为超纯水。
1.2 仪器工作条件
(1)液相色谱条件。色谱柱:C8色谱柱(3 μm×3 cm,美 国Perkin Elmer公 司);流动 相:0.15 mmol/L EDTA(钾)–0.1 mmol/L TBAOH–0.15 mmol/L乙 酸 铵–5%甲 醇(用HNO3,NH4OH调节流动相pH为6~7),流量为1.5 mL/min;进样体积:50 μL。
(2)ICP–MS条件。采用标准模式Rpq 0.25;积 分 时 间:250 ms;分 析 时 间:5 min;Se(Ⅳ),Se(Ⅵ)保留时间分别为0.3,1.4 min。
1.3 样品前处理
水样经0.45 μm滤膜过滤后可直接进行分析,浓度较大的水样用流动相稀释后进行测定。
2 结果与讨论
2.1 分析条件优化
2.1.1 离子对试剂及其浓度
由于待分析的硒以含氧酸根阴离子形式存在,会与加入的离子对试剂形成非极性离子对,在C8色谱柱中有不同程度的吸附而无法实现分离,故采用四丁基铵盐(Bu4N+)作为离子对试剂。与Bu4N+离子结合的阴离子会影响不同形态硒的保留时间,比较使用溴离子、硫酸根、氢氧根的结果发现,使用氢氧根的四丁基铵盐有较好的分离效果,因此选用四丁基氢氧化铵(TBAOH)作为离子对试剂。
增加TBAOH的浓度会增加TBAOH和离子对竞争而吸附在固定相的机会,使离子对吸附在固定相的比率减少,保留时间缩短;同时也会增加硒和TBA+结合成离子对的机会,增加保留时间,此两者为竞争性反应。配制TBAOH浓度分别为0,0.05,0.1,0.2,0.3,0.4,0.5 mmol/L的流动相,对比两种价态硒的保留时间,见图1。由图1可知,流动相中TBAOH的浓度小于0.1 mmol/L时,Se(Ⅳ),和Se(VI)的保留时间间隔小,不易分开;TBAOH浓度大于0.1 mmol/L时,Se(Ⅳ),和Se(Ⅵ)的保留时间间隔增大。因此选择TBAOH浓度为0.1 mmol/L。
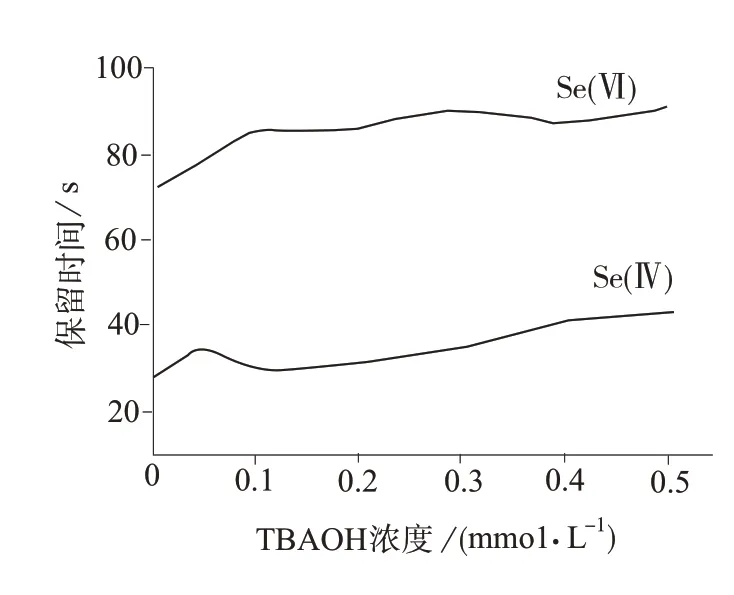
图1 流动相中TBAOH对Se(IV),Se(VI)保留时间的影响
2.1.2 甲醇含量
增加流动相中甲醇含量可以降低流动相的极性,使离子对在管柱内的保留时间缩短,但过量的甲醇会使电流不稳定。改变流动相中甲醇的含量,考察SeSe(Ⅳ),Se(Ⅵ)的分离情况,见图2。由图2可知,随着流动相中甲醇体积分数的增加,SeSe(Ⅳ),Se(Ⅵ)的保留时间缩短;当甲醇体积分数大于5%时,Se(Ⅳ),Se(Ⅵ)保留时间继续缩短,导致无法分离,此外甲醇体积分数过高会导致仪器点火失败。因此选择甲醇体积分数为5%。

图2 流动相中甲醇含量对Se(IV),Se(VI)保留时间的影响
2.1.3 EDTA(钾)浓度对分离的影响
在流动相中添加EDTA(钾)能增加流动相的离子强度,并增强与固定相的作用力,使硒的保留时间缩短,而过多的EDTA(钾)又会使砷的分离程度变差。为了能在最短时间内将两种形态的硒有效分离,EDTA(钾)浓度选择为0.15 mmol/L。
2.1.4 pH值对分离的影响
流动相pH值的改变对不同形态硒的保留时间、出峰效果影响很大。当pH值为6~7时,两种形态硒的色谱峰形较好,分离良好,无拖尾现象;当pH值为5~6时,出现拖尾现象;当pH<5或pH>7时,无法形成良好的峰型。因此确定流动相的pH值为6~7。
2.2 工作曲线方程与检出限
用流动相稀释配制一系列不同浓度Se(Ⅳ),Se(Ⅵ)的混合标准系列溶液(2,5,10,20,50,100 μg/L),进样测定。以目标化合物的的色谱峰面积(Y)对其质量浓度(X)绘制标准曲线,得工作曲线方程,Se(Ⅳ):Y=3683.3X–128.42;Se(Ⅵ):Y=4 072.1X–3 176,相关系数r2均不低于0.999,线性范围为2~100 μg/L。
以3倍信噪比计算仪器的检出限(LOD),以10倍信噪比计算仪器的定量限(LOQ),结合样品前处理的稀释倍数计算得到Se(Ⅳ),Se(Ⅵ)的检出限分别为0.05,0.03 μg/L,定量限均为2,2 μg/L。
图3为Se(Ⅳ),Se(Ⅵ)混合溶液(2 μg/L)色谱图。由图3可知,Se(Ⅳ),Se(Ⅵ)均实现了基线分离,互不干扰。

图3 Se(Ⅳ),Se(Ⅵ)混合溶液色谱图色谱图
2.3 回收率及精密度试验
以水源水、供水厂出厂水(除氯后)、管网水(除氯后)为基体进行加标回收试验,结果见表1。由表1可知,Se(Ⅳ),Se(Ⅵ)的回收率分别为102.3%~106.2%,104.7%~108.3%,相对标准偏差分别为6.4%~9.6%,4.4%~7.3%。说明该方法具有良好的精密度和准确度。该法适用于水源水中无机硒的形态分析。
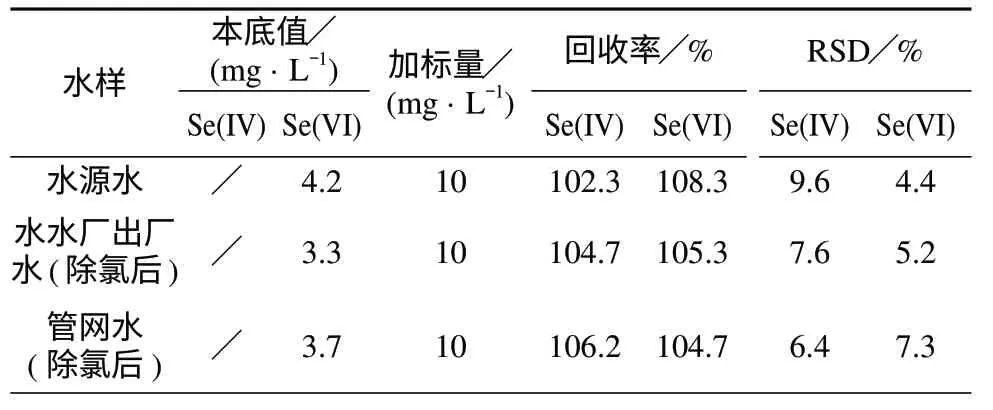
表1 回收率及精密度试验结果(n=5)
2.4 实际水样测定
实际样品的采集应选择使用塑料材质的采样器皿,运输过程中应避光。采集后应立刻测定,如无法立刻测定,则需将水样置于4℃冰箱中避光保存。
将建立的方法应用于济南市4座水库水样的测定,结果见表2。由表2可知,各水库中的硒含量满足GB 3838–2002 《地表水环境质量标准》中二类水质标准要求,4座水库中的硒主要以硒酸根的形式存在。

表2 实际水样测定结果 μg/L
3 结语
采用HPLC–ICP–MS法实现了对水中硒酸根、亚硒酸根的分离与测定。Se(Ⅳ),Se(Ⅵ)可在4 min内有效分离。该方法灵敏度高,具有良好精密度和准确度,在环境水体元素形态分析中有良好的应用前景。
[1]陈历程,张勇. 微量元素硒的研究现状及其食品强化[J].食品科学,2002,23 (10): 134–137.
[2]汪大翠,徐新华,宋爽. 工业废水中专项污染物处理手册[M].北京:化学工业出版社,2000: 358–363.
[3]黄峙. 食品硒源的生物学研究进展[J].食品科学,2001,22 (5): 90–94.
[4]张玲金,陈德勋,刘晓端.植物中硒的分离和微波消解–原子荧光测定法[J].环境与健康杂志,2004,21(3): 35–40.
[5]Katarzyna W,Kazimierz W,SASI,et al. HPLC–ICP–MS speciation of selenium in enriched onion leaves–a potential dietary source of Se-methylselenocysteine [J]. Food Chemistry,2004,326: 617–623.
[6]Zheng J,Masaki O. Speciation of selenium compounds with ionpair reversed-phase liquid chromatography using inductively coupled plasma mass spectrometry as element-specific detection [J]. Journal of Chromatography A,2000,874: 55–64.
[7]彭岚,谈明光,李玉兰,等. 微波辅助萃取–液质联用技术测底泥砷、硒的化学形态[J].分析试验室,2006,25(5): 228–235.
[8]王振华,何滨,史建波,等. 液相色谱–双通道原子荧光检测联用法同时测定砷和硒的形态[J].色谱,2009,27(5): 711–716.
[9]韦昌金,刘霁欣,裴晓华. 离子交换色谱–氢化物发生双道原子荧光法同时测定砷和硒形态[J].分析化学研究报告,2008,36(8): 1 061–1 065.
[10]Ipolyi I,Stefanka Z. Speciation of Se (Ⅳ)and the selenoamino acids by high-performance liquid chromatography–direct hydride generation0atomic fluorescence spectrometry [J]. Analytica Chimica Acta,2001,538: 367–375.
[11]张涛,高愈希,李柏,等. 高效液相色谱–等离子体质谱联用方法研究富硒大米中硒的形态[J].分析化学研究报告,2008,36(2): 206–210.
[12]陈邵鹏,顾海东,秦宏兵. 高效液相色谱–电感耦合等离子体质谱联用技术用于环境中元素形态分析的最新进展[J].化学分析计量,2011,20(2): 96–100.
[13]尚德荣,赵艳芳,翟毓秀,等. 高效液相色谱–电感耦合等离子体质谱(HPLC–ICP–MS)分析水产品中游离态三价铝[J].科学通报,2013,58(36): 3 812–3 817.
[14]陈光,林立,陈玉红. 液相色谱–电感耦合等离子体质谱法联用(HPLC–ICP–MS)测定乳制品的无机砷及其它砷形态[J].环境化学,2009,28(4): 608–611.
[15]Zhang X,Vanderbiesen V,Cubber A D. Accumulation of Arsenic Species in Serum of Paients with Chronic Renal Disease [J]. Clin Chem,1996,42(8): 1 231–1 237.
[16]李彬,刘丽,王秋泉,等. SE–HPLC/ICP–MS/ESI–MS联用技术用于富镉植物中镉的形态研究[J].光谱学与光谱分析,2010,30(4): 1 096–1 110.

