反应池–两步同位素稀释质谱法测定血清总钙*
李胜民,王军
(北京市医疗器械检验所、医疗器械检验与安全性评价北京市重点实验室,北京 101111)
人体血清中总钙含量的高低是人体健康状况的重要指标,其与人体的多种疾病密切相关[1–5]。目前测定血清中钙的常规方法很多,不同方法的检测结果差异很大。医学实验室通常自建参考方法,通过参加实验室间的量值比对保证不同实验室检测结果的准确性。
同位素稀释质谱法是国际公认的权威测量方法[6],同位素稀释质谱法通常需要用多接收ICP–MS先测定浓缩同位素的丰度比值,并计算浓缩同位素的浓度[7–10],而多接收ICP–MS仪器价格高昂,普通实验室无力购置。
笔者在LGC同位素稀释法原理[11–13]基础上建立了反应池–两步同位素稀释质谱法测定血清总钙的参考方法。与常规同位素稀释法相比,该方法的优点在于定值过程中不必先标定浓缩同位素的浓度,仅通过测定选定的一对同位素丰度比值,即可测定血清中钙的浓度,大幅降低了实验对仪器性能的要求。
1 实验部分
1.1 主要仪器与试剂
电感耦合等离子体质谱仪:Elan DRC-e型,美国Perkin Elmer 公司;
电子天平:XS205型,瑞士Mettler Toledo公司;
超纯水机:Mili-Q Adventage型,美国Millipore公司;
碳酸钙标准物质:编号为SRM915b,美国国家标准与技术研究院;
人血清成分电解质标准物质:编号为SRM 956c,美国国家标准与技术研究院;
冷冻人血清中无机成分分析标准物质:编号为GBW 09152,中国计量科学研究院;
42CaCO3:纯度为94.37%,编号为139691,美国橡树岭实验室;
硝酸:BV–III级,北京化学试剂研究所;
实验用水由Mill Q超纯水系统制备。
1.2 电感耦合等离子体质谱仪工作参数
ICP射频电压:1 100 V;雾化器气体流量:0.97 L/min;离子透镜电压:6.75 V;模拟信号电压:–1 700 V;脉冲信号电压:900 V;延迟时间:2 ms;扫描方式:峰高;扫描次数:25;单次测量读取次数:25;重复次数:25;甲烷流量:0.9 mL/min;氩气流量:0.8 mL/min;测量质量数:42和44;冷却水温:20℃;进样流量:1 mL/min;分析模式:同位素比。
1.3 溶液的制备
一级钙标准溶液的配制:将称量瓶洗净烘干,冷却后直接倒入大于0.20 g的CaCO3标准物质粉末,于105℃下烘干2 h。取出冷却,于干净容器中称取0.12 g的CaCO3标准物质,加入2 mL的BV–III级浓硝酸,溶解后加超纯水稀释至总质量约为45 g,保存备用。定值前平行配制3份一级钙标准溶液,以进行重复性验证,3份溶液浓度的相对标准偏差应小于1%。
二级钙标准溶液配制:取15 mL一级钙标准溶液,用超纯水稀释至45 mL,配制成二级钙标准溶液,稀释前后的量值以天平称量的质量为计算量。
一级浓缩同位素稀释剂的配制:称取约1 mg的42Ca同位素于干净容器中,加入0.20 mL BV–III级浓硝酸,加超纯水稀释至总质量约为100 g,保存备用。
二级浓缩同位素稀释剂配制:取1 mL一级浓缩同位素稀释剂,用超纯水稀释至45 mL。
钙标准溶液与浓缩同位素稀释剂混合样品的制备:分别称取mzc(约0.15 mL)的二级钙标准溶液与mYc(约0.20 mL)的“二级浓缩同位素稀释剂”混合后用超纯水稀释到45 mL,两种试剂的加入量均称重并以质量带入计算。
血清样品与浓缩同位素稀释剂混合样品的制备:分别称取0.3~0.5 mL(mzg)的血清样品,与0.20 mL二级浓缩同位素稀释剂(mYg)混合后用超纯水稀释到45 mL,两种试剂的加入量均以实际称得质量计算。
钙标准工作溶液配制:取0.15 mL二级钙标准溶液,用超纯水稀释至45 mL。
浓缩同位素工作溶液配制:取1.0 mL二级浓缩同位素稀释剂,用超纯水稀释至45 mL。
2 结果与讨论
2.1 实验条件的选择
2.1.1 甲烷反应气流量的设定
质谱法分析钙元素时,氩气干扰很严重,Elan DRC-e型仪器可以利用通入甲烷气体消除氩气的干扰,因为42Ca比44Ca丰度小很多,所以氩气对42Ca比对44Ca的相对干扰要严重。实验中以检测42Ca确定甲烷与氩气的最佳流速。利用仪器自带的“反应池碰撞气体流量优化”模式,找到甲烷、氩气的最佳流速分别为0.9,0.8 mL/min,经验证在此条件下氩气对44Ca 的干扰基本消除。
2.1.2 分析时间参数的设定
使用Boulyga[14]等反应池模式测定44Ca/40Ca值时的实验参数,44Ca/42Ca值的重复性不能满足定值要求。当扫描次数、单次测量读样次数及重复次数均设置为25时,数据的重复性明显优于前者,此时的单次分析时间约为5 min。将sweeps,readings,replicates视为3个独立的测量次数的参数,25∶25∶25的结果也符合不确定度计算公式。
2.1.3 硝酸浓度变化对44Ca/42Ca值的影响
配制硝酸底液浓度不同的1.00 μg/mL Ca溶液,在相同实验条件下测定44Ca/42Ca值,结果见表1。由表1可知,酸度变化时对同位素比值没有明显的影响,但cps响应信号随酸度的增加而减小。因此,在配制基准溶液和样品溶液时,不必考虑酸度的差异,为了使信号强度最大,对于血清样本可直接进行稀释。
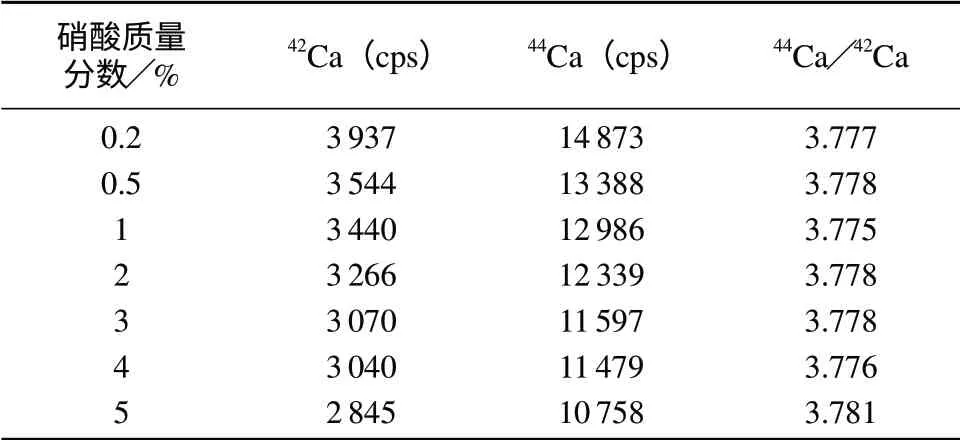
表1 硝酸含量对44Ca/42Ca值测定结果的影响
2.1.4 钙浓度变化对44Ca/42Ca值的影响
综上所述,骨关节结核在发生与发展的过程中,伴随着机体内多种细胞因子表达水平的变化,IL-15、MCP-1和TGF-β含量显著增高,提示其可能参与骨关节结核的免疫调节过程,但其具体机制尚未明确,有待深入研究。IL-15、MCP-1和TGF-β的表达水平有望成为骨关节结核的预防、诊断、病情监测及判断预后的重要临床参考指标。
不同质量浓度钙标准溶液44Ca/42Ca值的测定结果见表2。由表2可知,当钙质量浓度为0.5~1.5 μg/mL时,测量结果稳定性与重复性均很好;而当钙质量浓度较低时,仪器的重复性和本底空白值明显影响44Ca/42Ca值的重复性和稳定性。因此血清样本稀释后的钙质量浓度在0.5~1.5 g/mL范围时,测定结果的重复性较好。
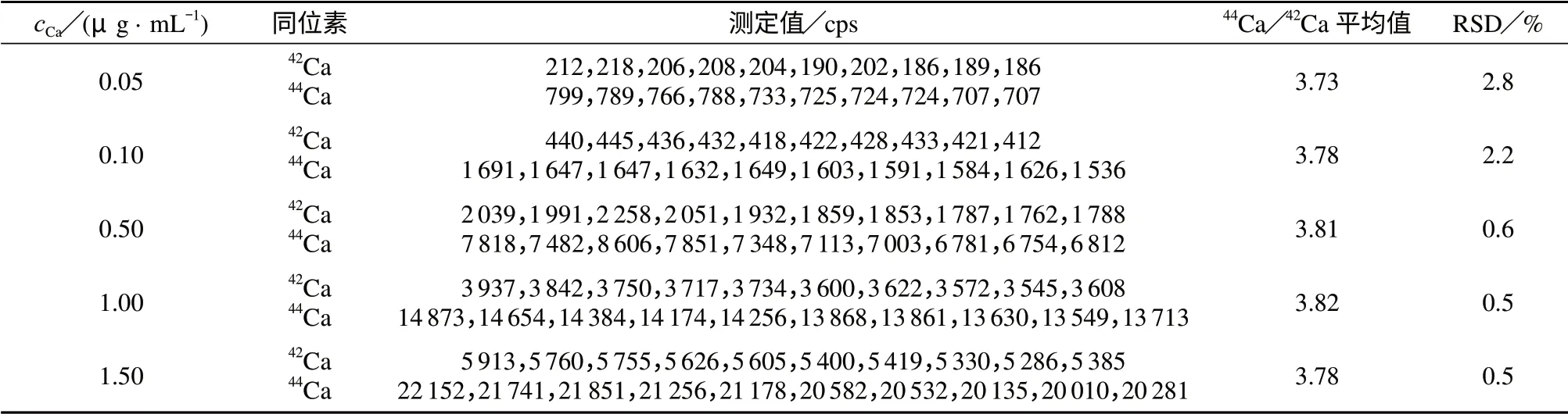
表2 不同浓度钙标准溶液44Ca/42Ca值的测定结果
2.1.5 程序的确定
为了保证基准溶液浓度的准确性,定值分析时二级以下的溶液均为当天配制[15]。为了获得同位素比测量的最佳精度,在样品和同位素稀释剂的混合试样中使同位素比尽量接近于1[10]。在数据处理过程中发现RZ和RY的波动性对最终结果影响很小,而RB与RBC的测量波动性对最终的结果是有影响的,因此RB与RBC必须交替测定,这样可同时消除仪器的测量漂移引入的误差。对于每份血清样本独立稀释成3个混合试样,每个混合试样进行6次独立分析,取其均值。
样品中钙的质量浓度根据式(1)计算[11]:
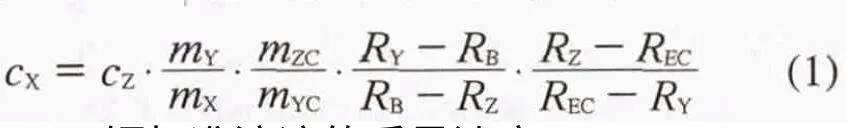
式中:cZ——钙标准溶液的质量浓度;
mY——血清样品与浓缩同位素稀释剂混合时浓缩同位素稀释剂加入的质量;
mX——血清样品与浓缩同位素稀释剂混合时血清样品加入的质量;
mZC——标准溶液与浓缩同位素稀释剂混合时钙标准溶液加入的质量;
Rz——钙标准溶液中44Ca/42Ca的同位素丰度比;
RY——浓缩同位素稀释剂中44Ca/42Ca的丰度比;
RB— —血清样品与浓缩同位素稀释剂混合物中44Ca/42Ca的丰度比;
REC——钙标准溶液与浓缩同位素稀释剂混合物中44Ca/42Ca的丰度比。
2.2 重复性
按照建立的定值方法对自制的leve1–3冷冻人血清标准物质进行定值,数据见表3。表3中,前3个数据为第1天的定值结果,后3个数据为第2天的定值结果。
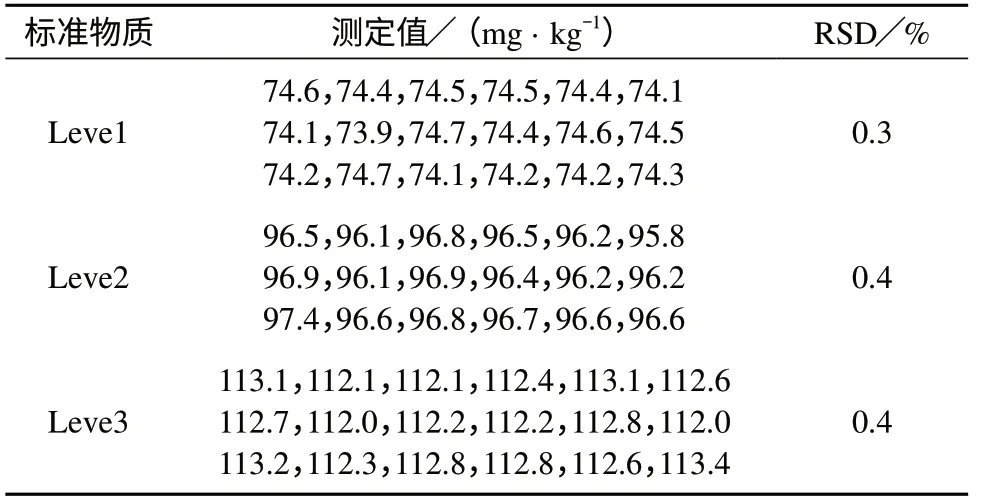
表3 3个水平人血样本Ca含量的定值数据
2.3 准确性
按照建立的定值方法对NIST 956c和GBW 09152人血清标准物质中的钙进行准确度验证,测定结果见表4。

表4 NIST 956c和GBW 09152标准物质中Ca含量测定结果
3 结语
建立了在动态反应池模式的四级杆电感耦合等离子体质谱仪上用同位素稀释质谱法定值血清中总钙的参考方法,取得了满意的定值结果。验证了两步同位素稀释质谱法公式的实用效果。定值过程中减少了被测同位素的量,降低了对质谱仪器的要求,定值结果准确度高、重复性好,本法可以作为实验室测定血清中钙的参考方法。
[1]吴金庆,葛广礼,刘永梅.慢性肾脏病患者血清钙、磷、hs-CRP、IL–6水平变化及其相关性分析[J].山东医药,2014,27: 70–72.
[2]沈贵生.血清钙和C反应蛋白联合检测对急性胰腺炎危重度的早期预测价值[J].肝胆外科杂志,2012,20(5): 352–354.
[3]李晴,高琳,王巍,等.维持性血液透析患者血清成纤维细胞生长因子23水平与血清钙、磷水平及左心室功能的关系研究[J].中国全科医学,2013,16(12): 4 173–4 175.
[4]尹梁宇,阴建,崔剑锋,等.血清钙离子水平与肝硬化发病风险相关性研究[J].中华流行病学杂志,2013,34(5): 457–460.
[5]黎海东,曾丽雯,郑丹,等.血清钙浓度变化与妊娠期高血压症的相关性分析[J].实验与检验医学,2014,32(3): 287–288.
[6]赵华,李本涛,冯典英.电感耦合等离子体质谱法痕量成分定值技术研究进展[J].化学分析计量,2007,16(5): 77–79.
[7]王军,韦超,郭烨,等.同位素稀释电感耦合等离子体质谱测量血清中的钙[J].质谱学报,2007,28(增刊):78–80.
[8]冯流星,王军.同位素稀释–激光剥蚀–电感耦合等离子体质谱法测定生物组织样品中铁元素的含量[J].分析化学,2014(4): 536–541.
[9]赵华,李本涛,冯典英,等.同位素稀释质谱法测定高纯金属铟中的微量镉[J].化学分析计量,2008,17(5): 13–15.
[10]JJF 1267–2010 同位素稀释质谱基准方法[S].
[11]Mike Sargent,Rita Harte,Chris Harrington. Guidelines for Achieving High Accuracy in Isotope Dilution Mass Spectrometry (IDMS)[R]. RSC Analytical Methods Committee,2002: 42–49.
[12]Nevel L Van,Aregbe Y,Taylor P D P. CCQM–K14 key comparison Calcium amount content in serum[J]. Metrologia,2004,41: 080 03.
[13]Lorna A Simpson,Ruth Hearn,et al. A comparison of doublefocusing sector fi eld ICP–MS,ICP–OES and octopole collision cell ICP–MS for the high-accuracy determination of calcium in human serum[J]. Talanta,2005,65 : 900–906.
[14]Sergei F Boulyga,Urs Klo1 tzli,Gerhard Stingeder. Optimization and application of ICPMS with dynamic reaction cell for precise determination of44Ca/40Ca isotope ratios[J]. Anal Chem,2007,79: 7 753–7 760.
[15]Karen E Murphy,Stephen E Long,Michael S Rearick,et al. The accurate determination of potassium and calcium using isotope dilution inductively coupled “cold” plasma mass spectrometry[J].J Anal,2002,17: 469–477.

