喹啉黄中各组分的定性及定量研究*
孙小杰,宋佳,尹华涛
(1.南京市食品药品监督检验院,南京 210008;2.南京市产品质量监督检验院,南京 210028;3.国家食品质量安全监督检验中心,北京 100029)
食品添加剂喹啉黄作为人工合成食用色素,色泽鲜艳、价格低廉,故为食品生产厂家广泛使用。喹啉黄为水溶性偶氮类合成色素,在英国常用于冰糕、水果、蛋糕、巧克力、面包、奶酪酱、软饮料等食品的着色。由于该色素可能导致儿童多动症,日本、美国及挪威禁用于食品,而我国仅允许在配制酒中添加,且最大使用量为0.1 g/L[1],但我国食品中喹啉黄检测的方法标准一直未能及时跟上,造成了喹啉黄检测项目的缺失。
目前测定喹啉黄的文献报道较少,阮丽萍等和杨富春等采用液相色谱法对食品中喹啉黄含量进行了测定[2-3],由于色谱条件的不同,喹啉黄部分组分由于未得到有效分离而造成色谱峰个数存在差异[4-5],对于喹啉黄组成的探讨也未见报道。已有报道的文献中喹啉黄的定量都是以峰面积总和作为定量的基础,而液相色谱易受到其它色素的干扰,无法满足检测的定性确证要求[6-7]。近年来,液相色谱-串联质谱联用技术(LS-MS/MS)在着色剂分析领域的运用发展迅速,弥补了液相色谱定性不够准确的缺点。马晓燕等和伊熊海等对于喹啉黄是以喹啉黄二钠盐来定量[8-9],Feng Feng等研究是以喹啉黄作为一钠盐来定量[10],而单独测定喹啉黄一钠盐、二钠盐并不能准确反映喹啉黄的实际含量。喹啉黄标准品为喹啉黄混合物,因此测定出喹啉黄标准品各组分的质量分数是准确检测喹啉黄的前提。笔者利用液相色谱对喹啉黄各组分进行分离,通过质谱法对各组分进行定性,用峰面积归一化法得出喹啉黄各组分的质量分数,为准确检测食品中喹啉黄的含量提供技术基础。
1 实验部分
1.1 主要仪器与试剂
高效液相色谱仪:Agilent1260型,配有二极管阵列检测器(DAD),美国Agilent公司;
液相色谱-串联质谱仪:Agilent 1260 HPLC-6460 QQQ型,配有电喷雾离子源,美国Agilent公司;
电子天平:XS205型,瑞士Metler Toledo公司;
甲醇:色谱纯,美国ROE公司;
乙酸铵:分析纯,南京化学试剂股份有限公司;
喹啉黄标准物质:纯度为97.5%,德国Dr. Ehrenstorfer公司;
食品添加剂喹啉黄:印度VIDHI公司;
甲醇:色谱纯,美国ROE公司;
实验室用水为经Mili-Q净化系统(0.22 μm过滤膜)过滤的超纯水。
1.2 标准溶液配制
称取喹啉黄标准品100.0 mg于100 mL棕色容量瓶中,用纯水溶解并定容,配制成1 mg/mL的标准储备液,室温保存备用。用时根据实际需要再将其配成适当浓度的标准工作溶液。
1.3 仪器工作条件
1.3.1 色谱条件
色谱柱:Agilent XDB-C18色谱柱(4.6 mm×150 mm,5 μm);流动相:A为0.01 mol/L乙酸铵水溶液,B为甲醇;梯度洗脱程序:0~1.0 min,20% B,1.0~20.0 min,20%~90% B,20.0~22.0 min,90%~20.0% B,22.0~25.0 min,保持20% B;流量:1.0 mL/min;柱温:室温;进样体积:10 μL;检测波长:415 nm。
1.3.2 质谱条件
离子源:电喷雾离子源;扫描方式:负离子扫描;检测方式:多反应监测;毛细管电压:-4 000 V;干燥气温度:300℃;干燥气流量:5 L/min;雾化气压力:310 kPa(45 psi);鞘气温度:250 ℃;鞘气流量:11 L/min;定性离子对、定量离子对、碎裂电压、碰撞能量见表1。
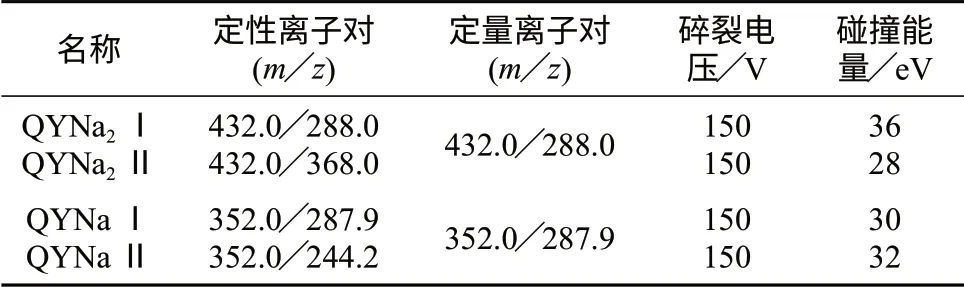
表1 喹啉黄的定性离子对、定量离子对、碎裂电压、碰撞能量
1.4 实验方法
称取100.0 mg食品添加剂喹啉黄样品至100 mL容量瓶中,用纯水溶解并定容。用时根据实际需要再将其稀释后过0.45μm水相滤膜,滤液上机测定。
2 结果与讨论
2.1 喹啉黄各组分的分离
2.1.1 HPLC条件的选择及优化
由于喹啉黄结构中含有磺酸根基团,乙酸铵溶液的存在可以促进目标物的保留和分离,改善峰形,加入不同体积分数的甲醇,结果发现,随着甲醇比例的增加,流动相的极性逐渐减小,洗脱能力逐渐增强,兼顾到合适的保留时间和良好的色谱峰形,最终选择甲醇初始比例为20%,流动相采用梯度洗脱。喹啉黄4个组分的色谱峰的最大吸收波长都在415 nm左右(见图1),且实际检测过程中无基质干扰,因此选择415 nm作为检测波长。
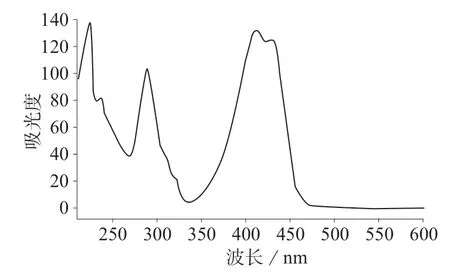
图1 喹啉黄的光谱图
2.1.2 喹啉黄的HPLC分析
分别以10 μg/mL的喹啉黄标准溶液和食品添加剂喹啉黄溶液为研究对象,在1.3.1条件下对喹啉黄标准品和食品添加剂喹啉黄进行分析,色谱图分别见图2及图3。在该色谱条件下,喹啉黄4个组分完全分离,证明流动相的选择合理、分离效果好。结果表明:喹啉黄标准品和食品添加剂喹啉黄的色谱图都存在4个主要的色谱峰,由于合成工艺的不同,由峰面积比较可以看出,喹啉黄标准品主要成分为后两处峰的组分,而食品添加剂喹啉黄主要成分为前两处峰的组分。
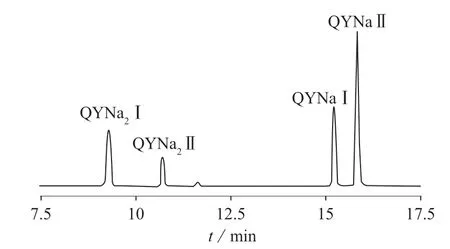
图2 喹啉黄标准品的HPLC色谱图
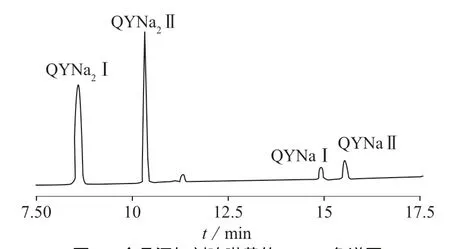
图3 食品添加剂喹啉黄的HPLC色谱图
2.2 喹啉黄各组分的定性分析
2.2.1 质谱条件的选择及优化
首先采用LC-MS的SCAN模式,扫面范围为50~500 m/z时,得到喹啉黄的特征母离子,然后分别优化其母离子的出口毛细管处电压,确定其响应最大的出口毛细管处电压,然后分别对其母离子进行二次选择性电离,通过优化碰撞能量,选取适合检测分析的子离子。
2.2.2 喹啉黄各组分的质谱分析
以10 μg/mL的喹啉黄标准溶液为研究对象,应用LC-MS/MS对4个峰进行验证,MRM色谱图见图4。
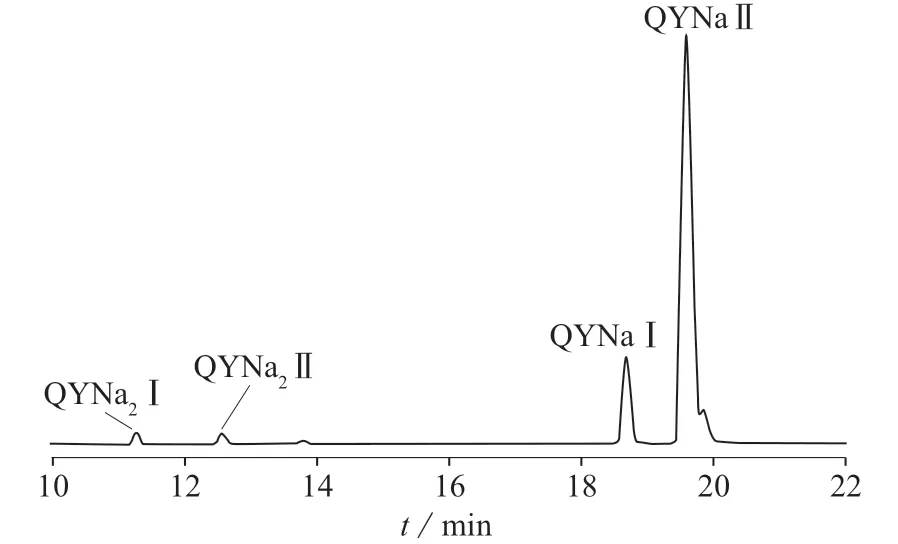
图4 喹啉黄的MRM色谱图
由图4可知,MRM色谱图中同样出现4个色谱峰,喹啉黄一钠盐相对分子质量为375,含一个SO3Na基团,m/z 352.0为[M(375)-Na]模式;喹啉黄二钠盐相对分子质量为477,含两个SO3Na基团,m/z 432.0为[M(477)-2Na+1H]模式。因此前两处色谱峰为喹啉黄二钠盐的色谱峰,后两处色谱峰为喹啉黄一钠盐的色谱峰。按保留时间的前后分别定义为QYNa2Ⅰ,QYNa2Ⅱ,QYNaⅠ,QYNaⅡ。
2.3 喹啉黄各组分的定量分析
2.3.1 HPLC法测定喹啉黄各组分的质量分数
以1.0 mg/mL的喹啉黄标准溶液为研究对象,用峰面积归一化法对4组峰积分得到喹啉黄各组分的质量分数,并在相同情况下平行测定6次,进行精密度试验,结果见表2。

表2 喹啉黄各组分的含量和精密度试验 %
由表2可见,喹啉黄4个组分的相对标准偏差分别为1.09%,1.58%,1.25%,0.90%。说明方法的精密度较高,重复性较好。
2.3.2 线性方程
喹啉黄的质量浓度x在5.0~100.0 μg/mL范围内与色谱峰面积y呈良好的线性关系(r≥0.999 9),以喹啉黄4种组分测量信噪比为S/N=3时的进样浓度定义为检出限,结果列于表3。
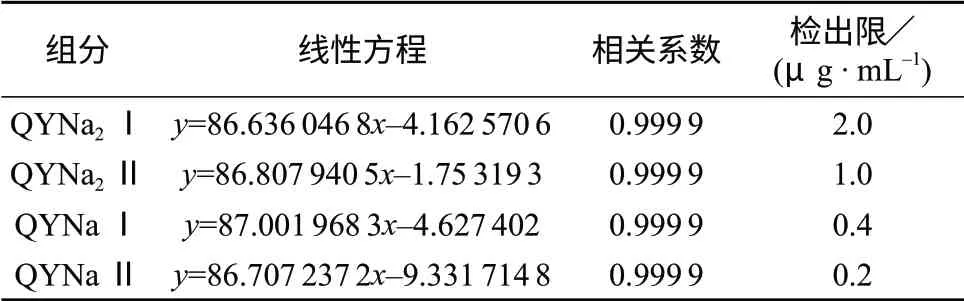
表3 喹啉黄各组分的线性关系
2.3.3 准确度试验
通过向10.0 μg/mL的喹啉黄试样溶液中添 加 低(5.0 μg/mL)、中(25.0 μg/mL)、高(50.0 μg/mL)3个浓度水平的喹啉黄标准溶液,进行回收试验,每个浓度样品平行测定6次,测定结果见表4。
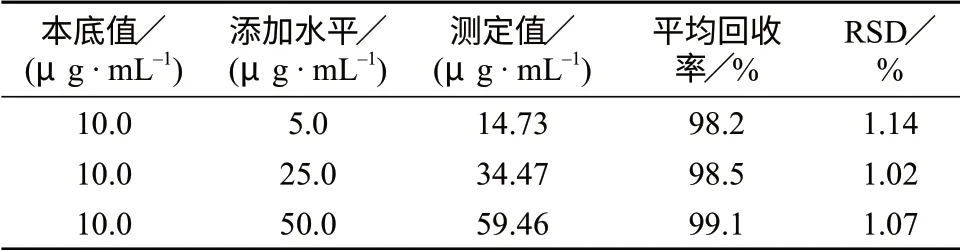
表4 方法回收试验结果
由表4可知,喹啉黄4个组分的回收率在98.2%~99.1%之间,相对标准偏差为1.02%~1.14%,说明该方法具有较高的准确度。
3 结论
建立了高效液相色谱检测喹啉黄各组分质量分数的方法,利用液相色谱法对喹啉黄各组分进行了分离并进行含量测定,通过液质联用法对各组分进行了定性研究。研究发现喹啉黄主要成分为喹啉黄一钠盐和二钠盐,同时各有两种同分异构体,利用峰面积归一化法得到喹啉黄各组分的质量分数。基于食品基质复杂,对于不同食品中喹啉黄检测的前处理方法还需要做进一步研究。
[1]GB 2760-2014 食品安全国家标准食品添加剂使用标准[S].
[2]杨富春,张宝元,陈丹萍.用高效液相色谱法同时测定葡萄酒中4种色素[J].江苏调味副食品,2010,27(3): 12-14.
[3]阮丽萍,吉文亮,刘华良,等.高效液相色谱法同时测定食品中10种合成着色剂[J].中国食品卫生杂志,2011,23(2): 151-154.
[4]奚星林,邵仕萍,邹志飞,等.高效液相色谱法检测食品中的喹啉黄色素[J].“食品安全质量检测技术”试刊论文集,2008: 15-19.
[5]房宁,巩俐彤,李倩.高效液相色谱测定预调酒中喹啉黄的方法[J].中国卫生检验杂质,2013,23(15): 3 049-3 053.
[6]刘泰然,赵海燕,罗仁才.超高效液相色谱法同时测定饮料中的17种食品添加剂[J].中国食品卫生杂志,2013,25(1): 44-48.
[7]李娜,李淑娟,安娟.快速液相色谱法测定食品中11种合成着色剂[J].食品工业科技,2009,30(1): 313-314.
[8]伊雄海,邓晓军,杨惠琴,等.液相色谱-串联质谱法检测食品中的多种易滥用着色剂[J].色谱,2011,29(11): 1 062-1 069.
[9]马晓燕,朱顺达,肖海龙,等.液相色谱-串联质谱法测定食品中喹啉黄、酸性绿S和专利蓝V[J].中国食品学报,2012,12(4): 182-186.
[10]Feng Feng,Zhao Yansheng,Wei Yong, et al. Highly sensitive and accurate screening of 40 dyes in soft drinks by liquid chromatography-electrospray tandem mass spectrometry[J].Journal of Chromatography B,2011,879: 1 813-1 818.

