由钛白副产粗FeSO4制备高纯硫酸亚铁的工艺研究
宋敬敬,严回,赵可
(1.蚌埠学院 应用化学与环境工程系,安徽 蚌埠 233030;2.蚌埠玻璃工业设计研究院,安徽 蚌埠 233010)
国内较大的钛白粉生产企业基本上采用硫酸法式生产钛白,副产硫酸亚铁量很大,每生产1 t 钛白粉约要排出浓废酸8 ~10 t,其中含有七水硫酸亚铁5% ~8%[1-8],但其回收利用率很低,因而成为制约生产钛白粉的“瓶颈”[9-10]。
目前,从钛白粉副产物中提取硫酸亚铁的工艺方法有很多,工艺流程大同小异,大致包括溶解、沉降、过滤、冷却结晶、干燥等步骤,各种工艺条件日趋成熟[11-13],最明显的不同之处在于:①使用的沉降剂不同,其沉降剂在使用过程中夹带的杂质以及沉降剂本身引入的杂质不同对硫酸亚铁晶体的产率有明显的影响;②产品纯度及成分结构的控制,因其不同的工艺制备而造成其产品质量参差不齐。在国内铁矿资源越来越紧张的背景下,对硫酸亚铁的回收利用工艺逐步改进就显得越来越重要,如何提高硫酸亚铁的利用率和纯度,是目前急需解决的问题[13-15]。
本实验以硫酸法制备钛白粉的副产品绿矾为原料,提取和制备高纯硫酸亚铁,采用磷酸作为钛沉降剂,以除去钛白粉副产品中主要杂质钛离子。经过多次过滤浸渍操作去除不溶物,再将滤液经过结晶和重结晶,即可得到高纯度的硫酸亚铁晶体。其工艺过程简便,产品纯度高,在一定程度上提高了生产效率,具有潜在的经济价值与实践指导意义。
1 实验部分
1.1 试剂与仪器
浓硫酸,化学纯;氯化铵、氨水、无水乙醇、磷酸均为分析纯;钛白副产硫酸亚铁,工业品,主要成分和杂质成分含量为FeSO496.12%,Ti 0.55%,Mn 0.15%,Al 0. 30%,Cr 0. 021%,Ca 0. 01%,Cu 0.000 5%,Zn 0.008%,Pb 0.008%,Sn 0.005%,Si 0.001%,水不溶物2.35%,其他0.32%。
Heal Force NW2-10 纯水仪;PHS-25 型pH 计;HJ-4A 恒温磁力搅拌器;SHB-3 循环水多用真空泵;HH 恒温水浴锅;SHA-C 水浴恒温振荡器;HCT-1 型微机差热天平;TD-3500 型XRD 衍射仪;Optima 8000 电感耦合等离子发射光谱分析仪。
1.2 实验方法
50 g 钛白副产FeSO4溶于100 mL 去离子水中,抽滤加入磷酸,调pH 至1 ~2,加热煮沸20 min,趁热加入少量絮凝剂,热滤,除杂,结晶,重结晶,干燥和晶体培养后进行成分分析。
2 结果与讨论
2.1 实验条件的探究
每组实验称取副产FeSO450 g,对影响因素去离子水体积、溶解温度、磷酸的质量分数、反应时间、反应温度进行5 因子4 水平正交实验,结果见表1。
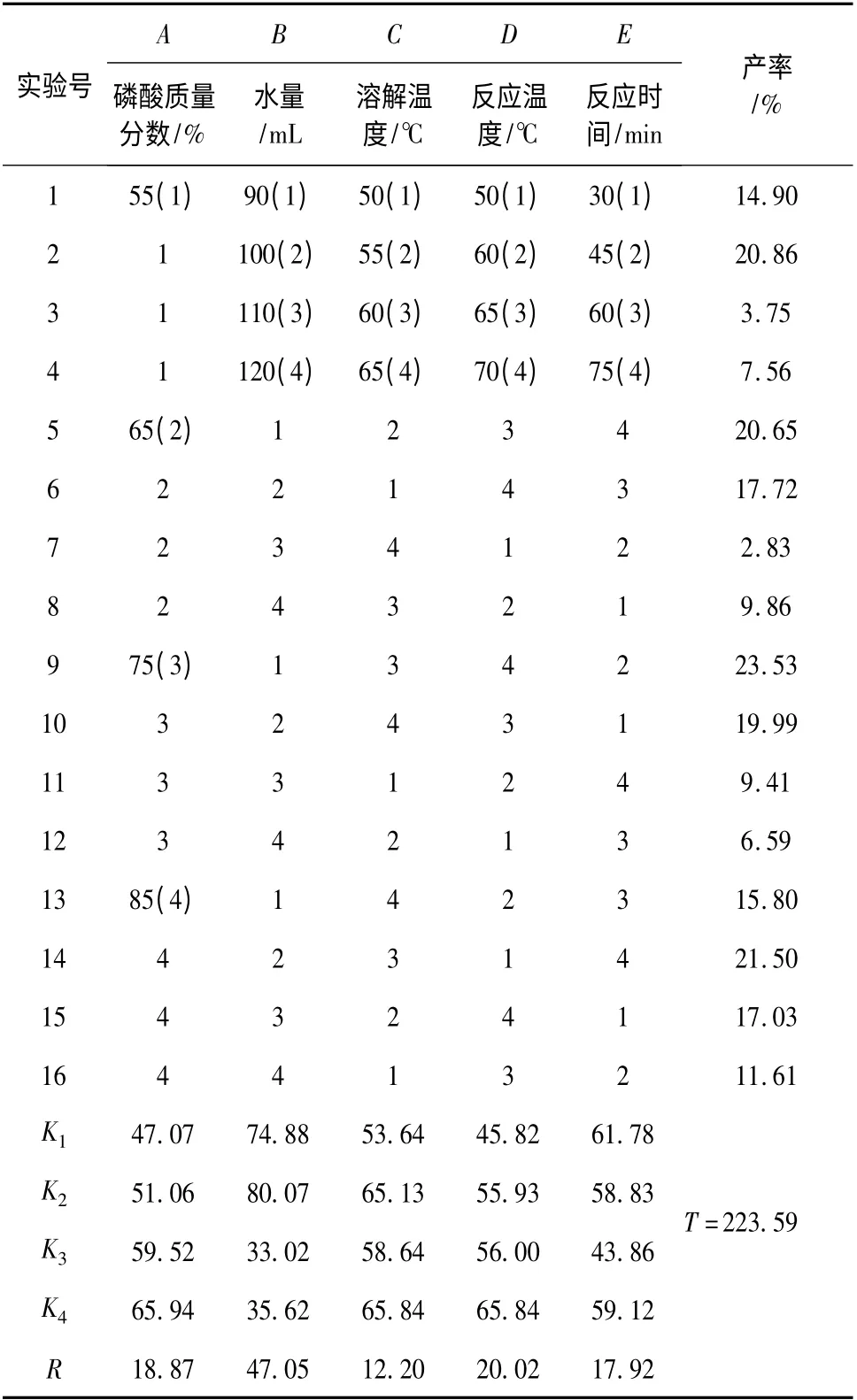
表1 正交实验结果Table 1 The orthogonal experimental result
由表1 可知,最佳实验条件是A4B2C4D4E1,即磷酸质量分数为85%,水体积100 mL,溶解温度65 ℃,反应温度70 ℃,反应时间30 min。
2.2 最佳实验条件的确定
为进一步探究实验的最佳条件,以85%质量分数的磷酸作为沉降剂,对水体积、溶解温度、反应温度和反应时间作进一步正交优化,结果见表2。
由表2 可知,因素对产率影响的主次顺序为:E>B >D >C,最佳实验条件是B2C2D3E1,即水的体积70 mL,水与物料比为1.4∶1,溶解温度55 ℃,反应温度70 ℃,反应时间45 min,与第5 组实验条件一致,产率为68.44%。

表2 工艺条件正交优化结果Table 2 The condition orthogonal optimation result
2.3 分析与表征
2.3.1 高纯硫酸亚铁晶体的物相分析 由图1 可知,所 得产 物在2θ 为16. 292,18. 372,22. 278,23.752,28.029,29.389,34.110,37.218,43.32°各衍射角度对应于七水硫酸亚铁的特征标准峰(PDF卡片号70-4951),样品的晶胞参数为a 13. 816;b 6.554;c 10. 957(标 准 晶 胞 参 数 为a 13. 997,b 6.480,c 11. 021)。可知制备产物为单斜晶系;XRD 图中无其他杂质峰,可证明产品的纯度较高、结晶度较好[6]。

图1 产物的XRD 衍射图Fig.1 X-ray diffraction pattern of ferrous sulfate
2.3.2 高纯硫酸亚铁晶体的热重分析 称取纯化所得FeSO4·7H2O 32. 05 mg,在 升 温 速 率 为10 ℃/min,反应气氛为氮气,气体流速为40 mL/min的条件下进行热重(TG)、差热(DTA)分析,结果见图2。
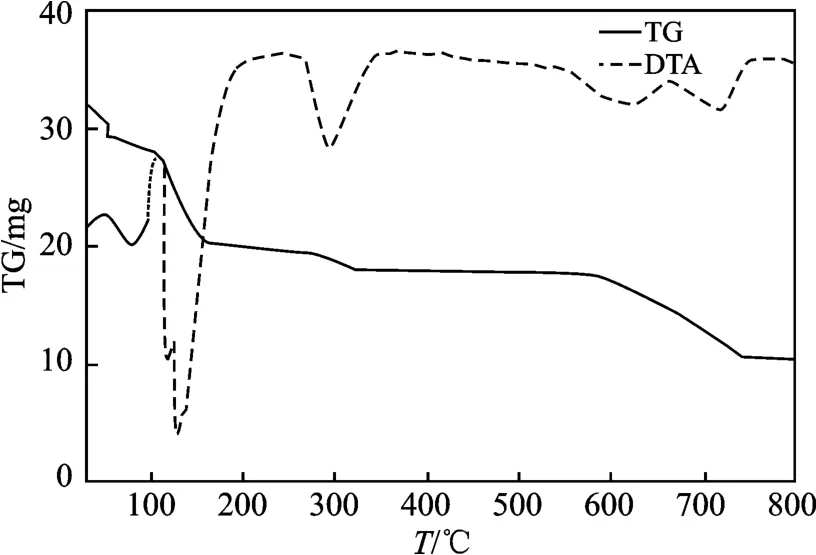
图2 FeSO4·7H2O 的TG-DTA 曲线Fig.2 TG-DTA curve of FeSO4·7H2O
由图2 可知,FeSO4·7H2O 在室温下即分解,终止分解温度为750 ℃。其热分解过程分以下几步进行。第一步,分解温度范围30 ~100 ℃,失重率12.64%,失去2 个水分子(理论值12.95%),形成中间产物FeSO4·4H2O;第二阶段,分解温度范围为100 ~200 ℃,失重率26.17%,失去4 个水分子(理论值25.89%),形成中间产物FeSO4·H2O;第三阶段,分解温度范围是250 ~370 ℃,失重率6.20%,失去一个水分子(理论值6.47%),形成FeSO4;第四步,分解温度范围为370 ~750 ℃,失重率26.19%,相当于失去1/2 个SO2+ SO3(理论值25.92% ),最终形成Fe2O3[16-17]。故可认为样品为含有7 个结晶水的硫酸亚铁晶体。
2.3.3 高纯硫酸亚铁纯度的测定 采用电感耦合等离子体发射光谱仪检测产品纯度. 结果为FeSO499. 82%,Ti 0. 005%,Mn 0. 060%,Al 0. 01%,Cr 0.001%,Ca 0.005%,Zn 0.004%,Pb 0.005%,Si 0.000 7%。纯化重结晶后的钛白粉副产品硫酸亚铁,纯度高,杂质含量少[18]。
3 结论
以工业钛白粉副产粗绿矾为原料,通过水溶等除杂后、过滤,加沉降剂磷酸(85%),再经热滤、冷却结晶、重结晶,制得高纯度七水硫酸亚铁晶体,实验最佳纯化条件为:水与物料比为1.4∶1(mL/g),溶解温度55 ℃,沉降剂磷酸浓度85%,反应温度65 ℃,反应时间45 min,产率可达到68.44%。
[1] 李晋,谢顶衫,朱开宪.钛白粉副产硫酸亚铁综合利用进展[J].广东化工,2011,38(4):269.
[2] 商连弟. 硫酸亚铁的新用途[J]. 现代化工,1995,15(8):41-42.
[3] 纪宏达,游少鸿,马丽丽.钛白厂副产硫酸亚铁的综合利用[J].科技信息,2008,35:824,841.
[4] 张兆麟,刘伟. 硫酸法钛白厂副产绿矾提纯的工艺改进[J].河南化工,1991(3):19-21.
[5] 谢四才. 钛白粉厂硫酸亚铁资源综合利用实验研究[J].广东化工,2012,39(2):128-129.
[6] 罗道成,易平贵.硫铁矿烧渣综合利用研究进展[J].工业安全与环保,2003,29(4):10-12.
[7] 程文敢.硫酸法钛白副产硫酸亚铁制取氧化铁红的研究[J].福建化工,2000(2):25-26.
[8] Zboril R,Mashlan M,Petridis D,et al. The role of intermediates in the process of red ferric pigment manufacture from FeSO4·7H2O[J]. Hyperfine Interactions,2002,139(1/2/3/4):437-445.
[9] 李建文.硫酸亚铁干燥条件及干燥特性的研究[J].饲料工业,1996,17(6):10-12.
[10] Frazer L. Titanium dioxide:environmental white knight?[J]. Environmental Health Perspectives,2001,109(4):A174-177.
[11]汤迪勇,张莉,毛静,等. 硫酸渣制备高纯度硫酸亚铁[J].再生资源与循环经济,2009,2(2):38-40.
[12]宋平.硫铁矿烧渣制取FeSO4·7H2O 研究[J].硫酸工业,1989(3):52-53.
[13]曹健,姬俊梅. 利用钛白粉副产品制备改性聚合硫酸铁[J].泰州职业技术学院学报,2004,4(6):6-8.
[14]唐启. 钛白粉生产废弃物合成聚合硫酸铁用于处理APMP 制浆废水[J].纸和造纸,2011,30(10):55-56.
[15]商连弟. 硫酸亚铁的回收应用值得重视[J]. 现代化工,1983(3):40-42.
[16]穆平.七水合硫酸亚铁热分解及脱水非等温动力学研究[J].河北师范大学学报:自然科学版,1997,21(2):164-167.
[17]熊杰明,王焱,吴新民,等. 七水硫酸亚铁的热分解动力学研究[J]. 北京石油化工学院学报,2008,15(4):15-19.
[18]中华人民共和国质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 664—2011 化学试剂七水合硫酸亚铁[S].北京:中国标准出版社,2011.

