Th1/Th2平衡在结核分枝杆菌免疫中的研究进展①
岳丽敏 秦峻岭 王春芳 王春凤 钱爱东 (吉林农业大学动物科学技术学院,长春130118)
Th1/Th2平衡在结核分枝杆菌免疫中的研究进展①
岳丽敏秦峻岭王春芳王春凤钱爱东(吉林农业大学动物科学技术学院,长春130118)
①本文为国家自然科学基金项目(No.31272566,No.31302124)和吉林省科技发展计划项目(20090219,20120235)。
Th1/Th2细胞是机体内最重要的CD4+T细胞亚群,在机体抵抗外界感染中起到了重要的作用。机体的免疫保护作用也主要来源于Th1/Th2的相对平衡。如果这种平衡被打破,机体将会出现免疫低下,甚至不同程度的病理变化。目前利用该平衡在肿瘤、移植免疫抑制及慢性疾病中的应用越来越受到广大学者的重视,而在结核病中的作用报道较少。本文就Th1/Th2细胞在结核分枝杆菌感染中的变化及在治疗方面的相关研究作一综述。
1 Th1/Th2细胞免疫学的特点
随着Th1细胞和Th2细胞最早由Mosmann和Coffman在1986年提出后,这些年研究人员对Th1 和Th2细胞的分化进行了概括(图1)[1-3]: Th1和Th2是由Th0在一定的条件下分化的T细胞亚群,它们在机体免疫系统中起着不同的免疫作用,但都是机体免疫系统中不可分割的部分。Th1细胞主要参与细胞免疫,刺激单核细胞的分化,能引起组织的炎症反应; Th2细胞主要参与体液免疫,可引起变态反应,控制寄生虫的感染。Th1细胞和Th2细胞在发挥作用的同时分泌多种细胞因子。Th1细胞主要分泌IL-1、IL-2、IL-12、IL-15、IL-18、IFN-γ和TNF。Th2主要分泌IL-4、IL-5、IL-6、IL-10、IL-13和GMCSF[4]。Th1和Th2细胞分泌的细胞因子可促进自身因子的生成,又可抑制对方因子的分泌。细胞因子之间相互影响、相互制约调控疾病的发展[5,6]。Th1细胞和Th2细胞还拥有各自特异性转录因子,分别是T-bet和GATA-3。T-bet在Th1细胞内选择性地表达,同时在IFN-γ生成中起正反馈作用。它不仅促进Th1细胞产生IFN-γ,还促进Th2细胞也分泌IFN-γ。此外,它还抑制一些Th2细胞因子的表达[7]。GATA-3除了利于Th0向Th2分化外,还在IL-4和IL-5因子的表达中起关键性作用。
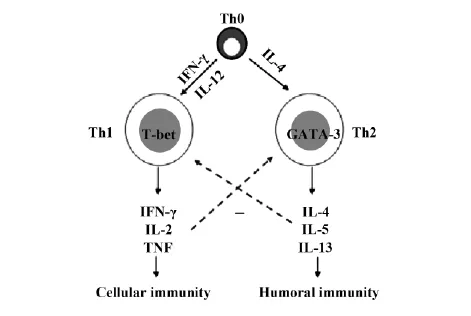
图1 Th1和Th2细胞的分化Fig.1 Differentiation of Th1 and Th2 cells
2 Th1/Th2细胞在结核分枝杆菌感染的作用
结核分枝杆菌感染机体后,能否被消除,并不是Th1细胞发挥作用越强越好,它需要Th2细胞对其抑制,以减少Th1细胞在免疫过程中给机体带来的炎症反应。因此Th1/Th2的相对平衡在抵抗结核分枝杆菌感染中至关重要。
2.1 Th1细胞在结核分枝杆菌感染中的作用Th1细胞主要通过诱导巨噬细胞活化和控制结核分枝杆菌复制来抵抗该菌的感染。Th1细胞在发挥作用时离不开相关因子的参与。IFN-γ和TNF-α在抗结核分枝杆菌感染的免疫中起到关键性作用,这主要体现在能激活单核细胞并维护肉芽肿的完整性方面[8];活化T细胞产生的IL-2可影响活化细胞的寿命,并对其效应功能的发挥起积极作用[9]; IL-12是Th0向Th1分化中最核心的因子,它还能正调节IFN-γ的分泌,在激活的单核细胞和T细胞之间也起到了桥梁的作用,除此之外,它还能促进CD4+CD25-T细胞的扩增并表达激活标志[10]。
2.2 Th2细胞在结核分枝杆菌感染中的作用虽然Th1细胞是抗胞内菌感染的主要细胞,但Th2细胞在抗结核感染中也具有不可忽视的作用。Wu等[11]在比较结核病人和健康人体内的IL-4时发现,结核病人表达少量的IL-4,认为IL-4表达过低可能是导致肺结核出现严重病变的主要因素。虽然Th2细胞在一定水平上能够降低Th1细胞给机体带来的伤害,但Th2细胞表达过剩会抑制Th1细胞的作用,为结核分枝杆菌在体内生存提供有利条件。Ashenafi等[12]在活动期肺结核病人的肺内就检测到了高水平的IL-4和低水平的IFN-γ。由此可见,使Th1/Th2达到相对平衡才能从根本上治疗结核。
3 Th1/Th2细胞亚群的失调在结核分枝杆菌感染中的作用
对不同时期结核病人体内Th1/Th2细胞因子进行检测时发现,机体内这两种细胞因子的表达存在很大差异,而这可能就与该病的预后有关。胥萍等[13]在对不同感染程度的结核病人进行检测时发现:随着病情的加重,Th1细胞因子表达量下降加剧,且Th1/Th2严重失衡。崔海燕等人[14]在结核性胸膜炎患者体内检测出了高含量的IFN-γ。Asma khanniche等[15]在非活动期结核患者体内发现Th1细胞因子表达呈现下降趋势。除此之外,在感染耐药结核分枝杆菌的病人体内也发现Th1细胞免疫受抑制的现象。Tan[16]在多重耐药结核病人体内检测到Th1细胞被抑制,其细胞因子IFN-γ、IL-2表达量下降,而Th2细胞处于激活状态,表达了较高的IL-4、IL-6和TNF-α。因此一些学者提出了一种假设: Th1/Th2细胞的转移是否会造成结核分枝杆菌感染向慢性转化或导致其耐药性的出现。但是为什么会出现这种现象的免疫机制有待探索。
Th1和Th2细胞因子在体内分布的不均衡可能会导致Th1/Th2平衡漂移。相关研究结果显示外周血和肺组织细胞因子确实存在差异。Sharma等[17]对粟粒性结核病人进行检测时发现外周血中高表达IFN-γ,肺内病变部位主要表达Th2细胞因子。这种不平衡的分布可能与一些调节因子有关。Ankathatti Munegowda等[18]证明单独缺陷IL-6或IL-10时,会使CD4+Th2细胞转变成Th1细胞。de Paus等[19]发现IFN-α和IFN-β能够抑制IFN-γ的免疫反应并减少巨噬细胞分泌Th1型细胞因子。同时Bo Wu等在感染肺结核病人的外周血中检测到了低水平的IFN-γ、IL-12β、IL-12α和IL-23mRNA含量,却发现了高水平IL-9的mRNA。如果加入IL-9的特异性抗体,则体内IFN-γ的含量就会大大地增加[20]。此外,他还首次证明了在感染结核时IL-24 对IFN-γ的表达起到了正调节作用[21]。在肺结核病人的病变部位,Pradip.Saha等观察到含有大量的CXCR3+CCR5+细胞聚集,而且它能促进IFN-γ的产生[22]。Tregs细胞是免疫系统中最重要的调节细胞,在Tregs对IFN-γ调节的研究方面,Shimon Sakaguchi等[23]观察到: Treg细胞通过促进IL-10和TGF-β的分泌抑制T细胞产生IFN-γ。但陈心春等[24]通过CD4+CD25+调节性T细胞促进了结核患者体内细胞因子IFN-γ及IL-10的分泌。因此,Treg在结核病患者体内的具体作用还不是很清楚[25]。关于是否是调节因子控制着机体内细胞因子的分布还有待进一步的研究,此外这些调节因子是如何对细胞因子作用的也同样需要探讨。
病变部位的微环境也可能对细胞因子的变化造成影响,从而导致平衡的失调。Li等[26]已经证明了来自结核病人的胸膜液可以导致从健康人体内分离的Th1细胞发生功能紊乱,且抑制Th1细胞的分化和阻止其发挥免疫效应。为了进一步验证,他又用结核病人的胸膜液作用分离于BCG刺激后胸膜液中的CD4+T细胞,检测到胸膜液以剂量依赖的形式抑制CD4+T细胞分泌IFN-γ、IL-2和TNF-α,从而猜测局部产生的胸膜液可能会破坏CD4+T细胞产生的免疫反应[27]。
4 Th1/Th2平衡失调与结核分枝杆菌感染的治疗
4.1通过细胞因子治疗结核分枝杆菌的感染通过细胞因子对结核分枝杆菌进行治疗已经成为一个新的研究方向。王霞芳[28]通过向感染结核的小鼠体内注入外源的IFN-γ,证实了该细胞因子具有增强小鼠抵抗结核分枝杆菌免疫保护力的能力。Ma等[29]认为建立在IL-24基础上的免疫治疗能起到很好的抑制结核分枝杆菌感染的目的。Zhang等[30]通过减少肺结核病人体内的CD19+CD5+CD1d+调节性B细胞来恢复抗结核特异性抗原IL-22的反应达到有效的治疗。从这些实验成果中我们可以看到通过细胞因子治疗结核病具有一定的参考价值。
除此之外,细胞因子还能够提高结核分枝杆菌疫苗的免疫效果。张丰经等[31]成功地构建了重组卡介苗———rBCG-IL-12p70-TB10.4,该重组卡介苗诱导产生的特异性细胞免疫应答比BCG产生的应答强且持久。李晖等[32]将IL-12表达质粒与结核分枝杆菌的Mtb8.4基因疫苗联合免疫给小鼠,观察到该表达质粒能够在一定程度上增强Mtb8.4基因疫苗提供的保护力。陈丽萍等[33]则检测到T-bet佐剂有利于Ag85B抗结核疫苗发挥免疫作用,显著地诱导Th1细胞免疫。在结核分枝杆菌治疗模型中,So-Shin Ahn等采用IL-7作为结核分枝杆菌DNA疫苗的佐剂提高了抗原特异性T细胞的反应[34]。
4.2构建细胞因子相关的融合基因疫苗目前有很多将表达细胞因子和结核分枝杆菌抗原的融合基因做成疫苗的报道,这种疫苗在一定程度上提高了机体的抵抗力,为结核分枝杆菌感染的治疗和预防开辟了另一条新的道路。Shi等[35]建立了HSP65-IL-2-DNA融合基因疫苗,发现该疫苗的免疫原性和保护性均优于HSP65-DNA疫苗,之后又在大肠杆菌体内成功地表达出了IL-12与结核分枝杆菌Rv1759c结构域的融合蛋白[36]。邓仪昊等[37]构建了能够表达IL-12p70-Ag85A融合蛋白的重组卡介苗。邓仪昊[38]在比较rBCG-IL-12p70-MPT64重组疫苗与卡介苗时,证实了该重组疫苗能提供很好的保护力。郝牧等[39]在该领域同样也有重大的突破,将人IL-12和结核分枝杆菌ESAT-6抗原建立联合疫苗,能明显地刺激机体的细胞免疫和稳定体液免疫,使机体形成足够的免疫力。这些研究的方向都为以后结核分枝杆菌的预防和治疗奠定了基础。
5 展望
虽然通过细胞因子可能达到结核治疗的目的,但该技术还不成熟。由于就目前研究的结果来看,处在不同的结核感染期及感染的毒株存在差异等原因,其不同的结核病人体内Th1/Th2漂移的方向不同,不能盲目地通过细胞因子进行治疗结核。而且,对于细胞因子在疫苗设计中达到的免疫效果也并不是十分完美,仍然需要研究人员不断地对其完善。对于Th1/Th2漂移的研究还只是起步,特别是在慢性结核分枝杆菌感染中,现在只是观察到了这种现象,然而为什么出现向Th2漂移及其机制有待进一步的研究。而调节因子在Th1和Th2平衡中的调节机制更值得我们进行研究与探讨,这对于结核病的预防和治疗具有重要的参考价值。
参考文献:
[1]Zhu JF,Jankovic D,Oler AJ,et al.The transcription factor T-bet is induced by multiple pathways and prevents an endogenous Th2 cell program during Th1 cell responses[J].Immunity,2012,37(4) : 660-673.
[2]Chiu HY,Cheng YP,Tsai TF.T helper type 17 in psoriasis: From basic immunology to clinical practice[J].Dermatol Sin,2012,30 (4) : 136-141.
[3]Ottenhoff TH.New pathways of protective and pathological host defense to mycobacteria[J].Trends Microbiol,2012,20 (9 ) : 419-428.
[4]Raghupathy R.Th1-type immunity is incompatible with successful pregnancy[J].Immunol Today,1997,18(10) : 478-482.
[5]Robinson CM,Jung JY,Nau GJ.Interferon-γ,tumor necrosis factor,and interleukin-18 cooperate to control growth of Mycobacterium tuberculosis in human macrophages[J].Cytokine,2012,60 (1) : 233-241.
[6]Mayer-Barber KD,Andrade BB,Barber DL,et al.Innate and adaptive interferons suppress IL-1α and IL-1β production by distinct pulmonary myeloid subsets during mycobacterium tuberculosis infection[J].Immunity,2011,35(6) : 1023-1034.
[7]Szabo SJ,Kim ST,Costa GL,et al.A novel transcrip tion factor,T-bet,directs Th1 line2 age commitment[J].Cell,2000,100: 655-669.
[8]Jacobs M,Togbe D,Fremond C,et al.Tumor necrosis factor is critical to control tuberculosis infection[J].Microbes Infect,2007,9 (5) : 623-628.
[9]Hoyer KK,Dooms H,Barron L,et al.Interleukin-2 in the development and control of inflammatory disease[J].Immunol Rev,2008,226(1) : 19-28.
[10]King IL,Segal BM.Cutting edge: IL-12 induces CD4+CD25-T cell activation in the presence of T regulatory cells[J].J Immunol,2005,175(2) : 641-645.
[11]Wu HP,Wu CL,Yu CC,et al.Efficiency of interleukin-4 expression in patients with tuberculosis and nontubercular pneumonia[J].Hum Immunol,2007,68(10) : 832-838.
[12]Ashenafi S,Aderaye G,Bekele A,et al.Progression of clinical tuberculosis is associated with a Th2 immune response signature in combination with elevated levels of SOCS3[J].Clin Immunol,2014,151(2) : 84-99.
[13]胥萍,施美华,费晓峰,等.肺结核患者外周血中Th细胞极化偏移及临床意义分析[J].中国免疫学杂志,2010,26 (2) : 178-185.
[14]崔海燕,张青,粟波,等.结核性胸膜炎患者Th1/Th2及前炎症细胞因子的变化[J].中华临床医师杂志,2012,6 (14) : 4109-4111.
[15]Asma khanniche,王颖,沙巍,等.Th1和Th17细胞在活动期肺结核病患者外周比例失衡的临床研究[J].现代免疫学,2012,32(5) : 387-391.
[16]Tan Q,Xie WP,Min R,et al.Characterization of Th1-and Th2-type immune response in human multidrug-resistant tuberculosis [J].Eur J Clin Microbiol,2012,31(6) : 1233-1242.
[17]Sharma SK,Mitra DK,Balamurugan A,et al.Cytokine Polarization in Miliary and Pleural Tuberculosis[J].J Clin Immunol,2002,22 (6) : 345-352.
[18]Ankathatti Munegowda M,Xu S,Freywald A.CD4+Th2 cellsfunction alike effector Tr1 and Th1 cells through the deletion of a single cytokine IL-6 and IL-10 gene[J].Mol Immunol,2012,51 (2) : 143-149.
[19]de Paus RA,van Wengen A,Schmidt I,et al.Inhibition of the type I immune responses of human monocytes by IFN-α and IFN-β[J].Cytokine,2013,61(2) : 645-655.
[20]Wu B,Huang C,Kato-Maeda M,et al.IL-9 is associated with an impaired Th1 immune response in patients with tuberculosis[J].Clin Immunol,2008,126(2) : 202-210.
[21]Wu B,Huang C,Kato-Maeda M,et al.IL-24 modulates IFN-γ expression in patients with tuberculosis[J].Immunol Lett,2008,117(1) : 57-62.
[22]Saha PK,Sharma PK,Sharma SK,et al.Recruitment of Th1 effector cells in human tuberculosis: Hierarchy of chemokine receptor(s) and their ligands[J].Cytokine,2013,63(1) : 43-51.
[23]Shimon Sakaguchi,Kajsa Wing,Yasushi Onishi,et al.Regulatory T cells: how do they suppress immune responses?[J].Int Immunol,2009,21(10) : 1105-1111.
[24]陈心春,周伯平,邓群益,等.CD4+CD25+调节性T细胞对肺结核患者特异细胞免疫的调节作用[J].中国防痨杂志,2008,30(3) : 165-169.
[25]Hyo-Jeong Lin,Jong Sun Park.CD4+Foxp3+T regulatory cells in drug-susceptible and multidrug-resistant tuberculosis[J].Tuberculosis,2013,93(5) : 523-528.
[26]Li Q,Li L,Liu Y,et al.Pleural fluid from tuberculous pleurisy inhibits the functions of T cells and the differentiation of Th1 cells via immunosuppressive factors[J].Cell Mol Immunol,2011,8: 172-180.
[27]Li Q,Li L,Liu Y,et al.Biological functions of Mycobacterium tuberculosis-specific CD4+T cells were impaired by tuberculosis pleural fluid[J].Immunol Lett,2011,138(2) : 113-121.
[28]王霞芳,吴妹英,徐培君,等.干扰素-γ对小鼠结核病的实验研究[J].抗感染药学,2008,5(4) : 236-240.
[29]Ma YF,Chen HD.Interleukin 24 as a novel potential cytokine immunotherapy for the treatment of Mycobacterium tuberculosis infection[J].Microbes Infect,2011,13(12-13) : 1099-1110.
[30]Zhang MZ,Zeng GC,Yang QT,et al.Anti-tuberculosis treatrment enhances the production of IL-22 through reducing the frequencies of regulatory B cell[J].Tuberculosis,2013,dx.doi.org/10.1016/j.tube.2013.12.003.
[31]张丰经,何红云,邓仪昊,等.重组结核病疫苗rBCG-IL-12p70-TB10.4的免疫效应[J].基础医学与临床,2014,34 (1) : 93-97.
[32]李晖,李强,钟森,等.结核分枝杆菌Mtb84基因疫苗与人白细胞介素12表达质粒联合免疫的细胞免疫应答观察[J].解放军医学杂志,2007,32(3) : 229-244.
[33]陈丽萍,张荣波,胡东,等.T-bet佐剂对Ag85B抗结核DNA疫苗的免疫调节[J].细胞与分子免疫学杂志,2012,28(7) : 680-683.
[34]Ahn SS,Jeon BY,Park SJ,et al.Nonlytic Fc-fused IL-7 synergizes with Mtb32 DNA vaccine to enhance antigen-specific T cell responses in a therapeutic model of tuberculosis[J].Vaccine,2013,31(27) : 2884-2890.
[35]Shi CH,Zhang H,Wang LM,et al.Therapeutic efficacy of a tuberculosis DNA vaccine encoding heat shock protein 65 of Mycobacterium tuberculosis and the human interleukin 2 fusion gene[J].Tuberculosis,2009,89(1) : 54-61.
[36]师长虹,江鹰,毛峰峰,等.结核分枝杆菌Rv1759c结构域与IL-2融合蛋白的表达与鉴[J].现在生物医学进展,2011,11(6) : 1001-1004.
[37]邓仪昊,何红云,张本斯.人细胞因子IL-12p70与结核分枝杆菌特异性抗原Ag85A融合基因重组卡介苗的构建及鉴定[J].实用医学杂志,2012,28(24) : 4038-4040.
[38]邓仪昊,何红云,王勇,等.重组结核病疫苗rBCG-IL-12p70-MPT64免疫原性研究[J].中国现代医学杂志,2013,23(20) : 29-34.
[39]郝牧,鲍朗,高蕾,等.人IL-12与结核分枝杆菌抗原ESAT-6联合基因疫苗的免效果观察[J].微生物学报,2007,47(3) : 477-481.
[收稿2014-04-21修回2014-05-15]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2015.10.030
通讯作者及指导教师:王春凤(1972年-),女,博士,教授,博士生导师,主要从事动物微生态和黏膜免疫研究,E-mail: wangchunfeng@ jlau.edu.cn。钱爱东(1960年-),男,博士,教授,博士生导师,主要从事动物微生物与分子免疫学的研究,E-mail: qianaidong0 115@ 163.com。
作者简介:岳丽敏(1987年-),女,E-mail: min241987yue@ 163.com。
文章编号1000-484X(2015) 10-1426-04
文献标志码A
中图分类号R392