被动免疫治疗过敏性鼻炎豚鼠对炎症细胞因子的影响①
朱喜玲 周文芸张海玲 翟精武 孙翠英 常 秋 文 珠胡国柱(安顺学院农学院,安顺561000)
被动免疫治疗过敏性鼻炎豚鼠对炎症细胞因子的影响①
朱喜玲周文芸②张海玲翟精武孙翠英常秋文珠③胡国柱②(安顺学院农学院,安顺561000)
[摘要]目的:探讨抗IL-1β和TNF-α IgY滴鼻治疗过敏性鼻炎豚鼠对炎症细胞因子的影响。方法:应用卵清白蛋白
(OVA)建立豚鼠过敏性鼻炎模型。将豚鼠随机分为:正常对照组(C组,17只),模型组(M组,27只),0.1%抗IL-1β和TNF-α IgY治疗组(Z1组,21只),丙酸氟替卡松治疗组(Z2组,21只)。分别在治疗后2、4、8 h心脏取血,鼻灌洗收集鼻灌洗液(NLF),ELISA法测定细胞因子水平。结果:在外周血,0.1%抗IL-1β和TNF-α IgY治疗组2~8 h时IL-1β、IL-5、IL-9、IL-13、IL-18、IL-33和TGF-β1,2~4 h时TNF-α和OVA特异性IgE,以及4~8 h时IL-22等水平均显著低于模型组(P<0.05)。在鼻灌洗液中,0.1%抗IL-1β和TNF-α IgY治疗组2~8 h时IL-1β、IL-5、IL-9、IL-13、IL-22、IL-33、TNF-α、TGF-β1和OVA特异性IgE,以及2 h时IL-18等水平显著低于模型组(P<0.05)。结论:过敏性鼻炎豚鼠采用抗IL-1β和TNF-α IgY滴鼻治疗能显著地降低炎症因子水平。
[关键词]过敏性鼻炎;豚鼠;卵白蛋白;肿瘤坏死因子;白细胞介素-1β;细胞因子
①本文为江西省科技厅社会发展重大招标课题(2006第四批)。
②江西省人民医院,南昌330006。
③江西省医学科学研究院血液研究室,南昌330006。
Influence on inflammation cytokines in passive immunotherapy for allergic rhinitis guinea pigs
ZHU Xi-Ling,ZHOU Wen-Yun,ZHANG Hai-Ling,ZHAI Jing-Wu,SUN Cui-Ying,CHANG Qiu,WEN Zhu,HU Guo-Zhu.Agricultural College,Anshun College,Anshun 561000,China
[Abstract]Objective: To explore the influence on inflammation cytokines for anti-IL-1β and TNF-α IgY intranasal treatment in guinea pigs with allergic rhinitis.Methods: The allergic rhinitis model in guinea pigs was established using ovalbumin(OVA) .Hartley guinea pigs were randomly divided into the control group(group C,n = 17),the allergic rhinitis model group(group M,n = 27),the 0.1% anti-IL-1β and TNF-α IgY treatment group(group Z1,n=21) and the fluticasone propionate treatment group(group Z2,n=21).At 2 h,4 h and 8 h after the last treatment,blood was got by heart puncture,as well as nose was lavaged using 0.9% saline and the nasal lavage fluid(NLF) was collected.The level of cytokines was examined using ELISA kits.Results: In the peripheral blood,the levels of IL-1β,IL-5,IL-9,IL-13,IL-18,IL-33 and TGF-β1 from 2 h to 8 h; TNF-α and OVA-specific IgE from 2 h to 4 h; and IL-22 from 4 h to 8 h were significantly decreased in the 0.1% anti-IL-1β and TNF-α IgY treatment group compared with the allergic rhinitis model group(P<0.05) .In the NLF,the levels of IL-1β,IL-5,IL-9,IL-13,IL-22,IL-33,TNF-α,TGF-β1 and OVA-specific IgE from 2 h to 8 h; and IL-18 at 2 h were significantly decreased in the 0.1% anti-IL-1β and TNF-α IgY treatment group compared with the allergic rhinitis model group(P<0.05) .Conclusion: Anti-IL-1β and TNF-α IgY intranasal treatment can significantly reduce inflammation cytokine levels in allergic rhinitis guinea pigs.
[Key words]Allergic rhinitis; Guinea pigs; Ovalbuamin; TNF-α; IL-1β; Cytokines
在过敏性鼻炎(Allergic rhinitis,AR),当机体再次暴露于抗原2 h至24 h后即出现晚期反应[1,2]。卵清白蛋白(Ovalbumin,OVA)诱导的过敏性鼻炎豚鼠和小鼠,及过敏性鼻炎患者其血清和鼻灌洗液中IgE、IL-1β、IL-4、IL-5、IL-6、IL-8、IL-9、IL-13、IL-18、IL-22、IL-33、TNF-α和嗜酸性阳离子蛋白-1水平显著升高[1,3-8]。我们前期研究证明,抗TNF-α和IL-1β IgY显著减少和减轻过敏性鼻炎豚鼠鼻黏膜嗜酸性粒细胞浸润和炎症病理反应,减少NLF中嗜酸性粒细胞、淋巴细胞、中性粒细胞,降低鼻黏膜IL-1β、TNF-α、IL-5和IL-33的表达[9]。本文观察抗IL-1β和TNF-α IgY滴鼻被动免疫治疗过敏性鼻炎豚鼠,探讨其对炎症因子和Th2细胞因子的影响,以期为过敏性鼻炎的临床治疗寻找新的有效途径。
1 材料与方法
1.1材料Hartley豚鼠,雄性,7周龄,体重(200± 50) g,购自上海啮齿类动物研究中心,许可证号: SXCK(沪) 2012-0008。抗TNF-α和IL-1β IgY(纯度85%,效价1∶3 200/mg蛋白) ;丙酸氟替卡松(浓度0.05%,英国Glaxsmithk公司) ;卵清白蛋白(Sigma公司) ;氢氧化铝凝胶(美国Thermo scientific公司) ; IL-1β、IL-5、IL-9、IL-13、IL-18、IL-22、IL-33、TNF-α、TGF-β1、OVA特异性IgE ELISA试剂盒(中国上海西塘生物技术有限公司)。
1.2方法
1.2.1豚鼠过敏性鼻炎模型建立133只豚鼠根据体重随机分成正常对照组(C组,17只)和过敏性鼻炎模型建立组(116只)。建立豚鼠过敏性鼻炎模型方法见文献[10]。简言之,正常对照组(C组)基础免疫和加强免疫(激发)均采用每侧鼻孔滴注0.1 ml生理盐水。建立过敏性鼻炎模型(116只)基础致敏时腹腔注射1 ml的0.03% OVA + 3.0%氢氧化铝,隔日1次,共7次;然后采用OVA皮内注射法鉴定豚鼠致敏是否成功;致敏成功的豚鼠休息7 d后,采用2.0%OVA滴鼻激发3次(0.1 ml /每侧鼻孔,每天1次),然后根据豚鼠(剩余69只)过敏症状评分结果随机分成模型组(M组,n = 27),0.1 ml生理盐水滴鼻后再滴鼻2.0%OVA激发; 0.1%抗IL-1β和TNF-α IgY治疗组(Z1组,n = 21),0.1 ml 0.1%抗TNF-α和IL-1β IgY滴鼻后再滴鼻2.0% OVA激发;丙酸氟替卡松治疗组(Z2组,n = 21),0.1 ml丙酸氟替卡松滴鼻后再滴鼻2.0%OVA激发;每天1次,共7次。OVA攻击10次后M组死亡6只(剩21只),Z1组死亡2只(剩19只),Z2组死亡5只(剩16只)。
1.2.2鼻灌洗及鼻灌洗液收集治疗结束后每组豚鼠分别在2 h、4 h或8 h时间点各取数只豚鼠进行鼻灌洗及收集鼻灌洗液。鼻灌洗及鼻灌洗液收集操作参照Bahekar等人[10]方法。操作简述如下: 10%水合氯醛溶液腹腔注射麻醉豚鼠,豚鼠仰头向上并固定,小塑料管插入一个鼻孔,使用5.0 ml注射器吸取2 ml生理盐水慢慢推注(0.1 ml/min)冲洗鼻腔,从另一个鼻孔用微量取样器吸出鼻灌洗液(NLF),然后离心2 500 r/min,10 min,取上清液即为NLF,储存于-80℃。
1.2.3心脏采血治疗结束后在2 h、4 h或8 h时间点各取数只豚鼠在鼻灌洗及收集鼻灌洗液之后,开胸暴露出心脏,使用5.0 ml注射器心脏穿刺抽血置EDTA抗凝管,离心2 500 r/min,10 min,取血浆至-80℃保存。
1.2.4细胞因子测定血浆和鼻灌洗液中IL-1β、IL-5、IL-9、IL-13、IL-18、IL-22、IL-33、TNF-α、TGF-β1 和OVA特异性IgE水平采用双抗夹心ELISA法测定,操作步骤严格按试剂盒操作说明书进行,通过试剂盒标准品所做的标准曲线计算出细胞因子浓度。
1.3统计学分析实验结果采用SPSS19.0软件包进行统计分析,数据采用x ±s表示,各组样本均数间比较采用One-way ANOVA分析,若方差齐性,采用LSD法比较两组之间差异;若方差不齐性,采用多重秩和检验,多重比较采用Mann-Whiteney法,以P<0.05表示差异有显著性。
2 结果
2.1外周血细胞因子浓度变化在外周血,0.1% 抗IL-1β和TNF-α IgY治疗组(Z1组) 2~8 h时IL-1β、IL-5、IL-9、IL-13、L-18、IL-33、TGF-β等细胞因子,2~4 h时TNF-α和OVA特异性IgE,4~8 h时IL-22等细胞因子含量显著低于过敏性鼻炎豚鼠模型组(M组) (P<0.05) (表1) ; 0.1%抗IL-1β和TNF-α IgY治疗组(Z1组)与丙酸氟替卡松治疗组(Z2组)比较无显著性差异(P>0.05) (表1) ; 0.1% 抗IL-1β和TNF-α IgY治疗组(Z1组) 2~8 h时TNF-α、IL-18,2~4 h时TGF-β,4~8 h时OVA特异性IgE,2 h和8 h时IL-13,此外2 h时IL-5、4 h时IL-22、8 h时IL-9等细胞因子含量与正常对照组(C 组)无显著差异(P>0.05) (表1)。
2.2鼻灌洗液细胞因子浓度变化在鼻灌洗液中,0.1%抗IL-1β和TNF-α IgY治疗组(Z1组) 2~8 h时IL-1β、TNF-α、IL-5、IL-9、IL-13、IL-22、IL-33、TGF-β、OVA特异性IgE,2 h时IL-18等细胞因子含量显著低于过敏性鼻炎豚鼠模型组(M组) (P<0.05) (表2) ; 0.1%抗IL-1β和TNF-α IgY治疗组(Z1组)与丙酸氟替卡松治疗组(Z2组)比较无显著性差异(P>0.05)(表2) ; 0.1%抗IL-1β和TNF-α IgY治疗组(Z1组) 2~8 h时TNF-α、IL-5、OVA-特异性IgE,2~4 h时IL-9、IL-33,2 h和8 h时IL-22,4~8 h时IL-1β,4 h时IL-13,8 h时TGF-β等细胞因子含量与正常对照组(C 组)无显著差异(P>0.05) (表2)。
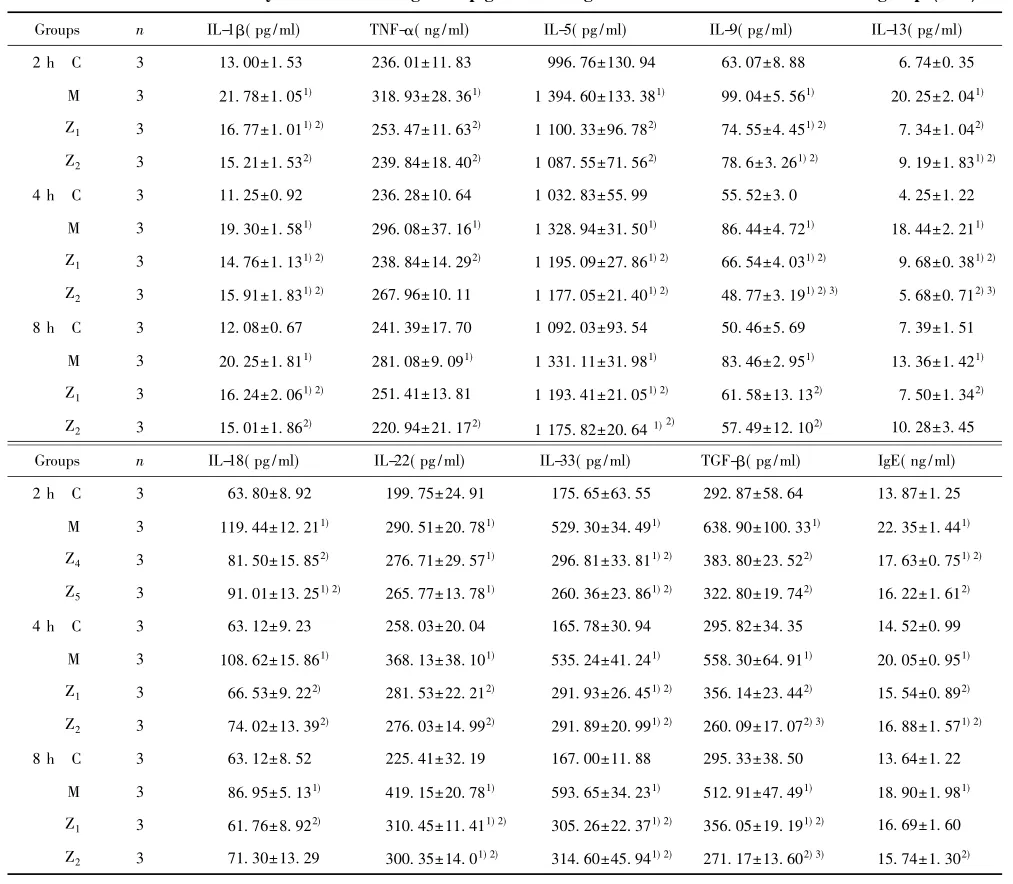
表1 各组过敏性鼻炎豚鼠外周血炎症细胞因子水平(x±s)Tab.1 Levels of inflammation cytokines in PB in guinea pigs with allergic rhinitis after different treatment groups(x±s)

表2 各组过敏性鼻炎豚鼠鼻灌洗液炎症细胞因子水平(x ±s)Tab.2 Levels of inflammation cytokines in NLF in guinea pigs with allergic rhinitis after different treatment groups(x±s)
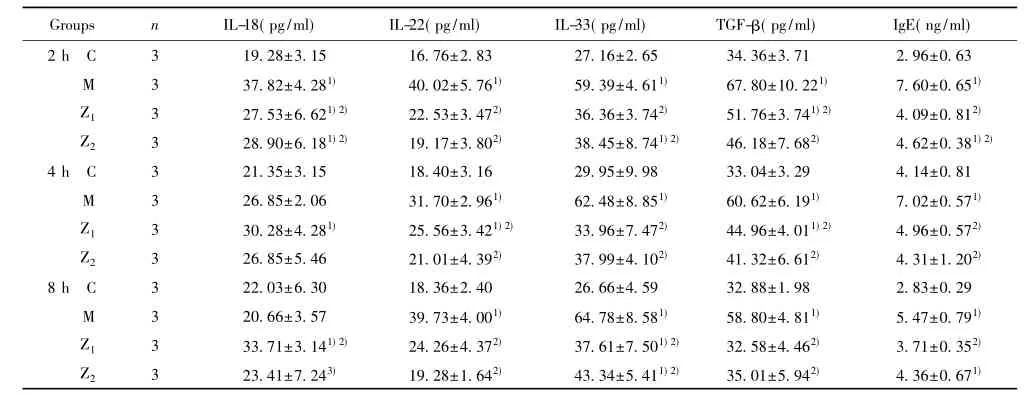
(续表2)
3 讨论
OVA诱导的豚鼠和小鼠,以及人类过敏性鼻炎患者血清中总IgE和OVA特异性IgE、TNF-α、IL-9、IL-18、IL-22、IL-33含量显著增加;鼻灌洗液中OVA特异性IgE、IL-5、IL-13、IL-33、IL-18、TGF-β含量显著增加。本文也证明,OVA诱导的过敏性鼻炎豚鼠IL-1β、TNF-α、IL-18、IL-22、IL-33、TGF-β等前炎症因子和炎症因子,IL-5、IL-9、IL-13等Th2细胞因子,以及OVA特异性IgE含量在外周血和鼻灌洗液中显著增加(表1、2)。然而滴鼻给予过敏性鼻炎模型豚鼠抗IL-1β和TNF-α IgY治疗后,外周血OVA特异性IgE、TNF-α、IL-1β、IL-5、IL-9、IL-13、IL-18、IL-22、L-33、TGF-β含量显著降低(P<0.05) (表1)。Iwasaki等[11]也证明OVA诱导的过敏性鼻炎TNF-α (-/-)小鼠血清OVA特异性IgE含量减少。抗IL-33抗体治疗OVA诱导的过敏性鼻炎小鼠也减少了血清总IgE和OVA特异性IgE含量[12,13]。本文滴鼻给予过敏性鼻炎模型豚鼠抗IL-1β和TNF-α IgY治疗后,鼻灌洗液中OVA特异性IgE、TNF-α、IL-1β、IL-5、IL-9、IL-13、IL-22、IL-33、TGF-β含量显著降低(P<0.05) (表2)。本文研究还提示,抗IL-1β和TNF-α IgY降低炎症因子及Th2细胞因子的疗效与丙酸氟替卡松(糖皮质激素)无显著性差异(P<0.05) (表1、2)。值得注意的是鼻灌洗液中IL-18含量仅仅是在治疗后2 h下降,而4~8 h则高于模型组豚鼠。Salagianni等[14]发现IL-18起着抑制IgE产生的作用。在体外IL-18与IL-12辅助促进Th1/ Tc1发展,抑制向Th2/Tc2分化。IL-18(-/-)小鼠与野生型正常小鼠比较,经OVA免疫后IL-18(-/-)小鼠表现出高IgE和IgG1水平。这个结果提示,经抗IL-1β和TNF-α IgY治疗后IL-18升高可能是有利于疾病的恢复,因为其可能抑制Th2细胞因子产生。
TNF-α、IL-1β、IL-5、IL-9、IL-13、IL-22、IL-33、TGF-β等细胞因子参与了过敏性炎症病理反应的发生和发展,并且这些细胞因子相互作用刺激其进一步增加,从而加重炎症病理反应。例如: IL-9刺激人气道平滑肌细胞释放Th2相关的趋化因子(eotaxin1/CCL11)[15]。哮喘患者IL-13刺激气道纤维母细胞产生TGF-β1导致气道重塑[16]。在过敏性鼻炎小鼠,IL-33刺激鼻黏膜分泌IL-4、IL-5、IL-13[17]。IL-33诱导IL-13产生的2型固有淋巴细胞(type 2 innate lymphoid cells)扩增[18]。OVA与IL-1β或IL-33一道作用于OVA致敏的小鼠气道使其产生IgE[19]。致敏的动物气道暴露于致敏原引起ATP和尿酸释放,激活NLRP3炎症体复合物,其裂解IL-1β原成为成熟的IL-1β[20]。人鼻黏膜纤维母细胞暴露于IL-1β或TNF-α增加了IL-33产生[21],而TNF-α刺激哮喘患者的气道平滑肌细胞上调IL-33表达[22]。Mo等[23]证明抗TNF-α处理过敏性鼻炎小鼠减轻了其过敏症状,降低了总的和OVA特异性IgE水平,以及减少了IL-4的产生。本研究的结果提示前炎症因子IL-1β和TNF-α在过敏性炎症病理反应细胞因子相互作用程序中先于IL-33,并且在过敏性炎症的炎症细胞因子反应网络中IL-1β和TNF-α处于细胞因子相互作用的起始端。因此,采用抗IL-1β和TNF-α IgY局部阻断IL-1β和TNF-α能更有效地抑制过敏性炎症病理反应,且避免糖皮质激素带来的不良反应,其可能是一种潜在而有效的生物学治疗新手段。
参考文献:
[1]Thakare VN,Osama MM,Naik SR.Therapeutic potential of curcumin in experimentally induced allergic rhinitis in guinea pigs[J].Int Immunopharmacol,2013,17(1) : 18-25.
[2]Galli SJ,Tsai M,Piliponsky AM.The development of allergic inflammation[J].Nature,2008,454(7293) : 445-454.
[3]Daoud A,Xie Z,Ma Y,et al.Changes of T-helper type 1/2 cell balance by anticholinergic treatment in allergic mice[J].Ann Allergy Asthma Immunol,2014,112(3) : 249-255.
[4]Boghdadi G,Marei A,Ali A,et al.Immunological markers in allergic rhinitis patients treated with date palm immunotherapy[J].Inflamm Res,2012,61(7) : 719-724.
[5]Kamekura R,Kojima T,Takano K,et al.The role of IL-33 and its receptor ST2 in human nasal epithelium with allergic rhinitis[J].Clin Exp Allergy,2012,42(2) : 218-228.
[6]Verhaeghe B,Gevaert P,Holtappels G,et al.Up-regulation of IL-18 in allergic rhinitis[J].Allergy,2002,57(9) : 825-830.
[7]Asaka D,Yoshikawa M,Nakayama T,et al.Elevated levels of interleukin-33 in the nasal secretions of patients with allergic rhinitis [J].Int Arch Allergy Immunol,2012,158(Suppl 1) : 47-50.
[8]Farfariello V,Amantini C,Nabissi M,et al.IL-22 mRNA in peripheral blood mononuclear cells from allergic rhinitic and asthmatic pediatric patients[J].Pediatr Allergy Immunol,2011,22 (4) : 419-423.
[9]朱喜玲,胡微煦,吴梨华,等.抗TNF-α和IL-1β IgY抗体治疗
豚鼠过敏性鼻炎机理研究[J].中国免疫学杂志,2014,30 (10) : 1353-1359.
[10]Baheka PC,Shah jh,Ayer UB,et al.Validation of guinea pig model of allergic rhinitis by oral and topical drugs[J].Immunopharmacol,2008,8(11) : 1540-1551.
[11]Iwasaki M,Saito K,Takemura M,et al.TNF-alpha contributes to the development of allergic rhinitis in mice[J].J Allergy Clin Immunol,2003,112(1) : 134-140.
[12]Kim YH,Yang TY,Park CS,et al.Anti-IL-33 antibody has a therapeutic effect in a murine model of allergic rhinitis[J].Allergy,2012,67(2) : 183-190.
[13]Liu X,Li M,Wu Y,et al.Anti-IL-33 antibody treatment inhibits airway inflammation in a murine model of allergic asthma[J].Biochem Biophys Res Commun,2009,386(1) : 181-185.
[14]Salagianni M,Wong KL,Thomas MJ,et al.An essential role for IL-18 in CD8 T cell-mediated suppression of IgE responses[J].J Immunol,2007,178(8) : 4771-4778.
[15]Gounni AS,Hamid Q,Rahman SM,et al.IL-9-mediated induction of eotaxin1/CCL11 in human airway smooth muscle cells[J].J Immunol,2004,173(4) : 2771-2779.
[16]Firszt R,Francisco D,Church TD,et al.Interleukin-13 induces collagen type-1 expression through matrix metalloproteinase-2 and transforming growth factor-β1 in airway fibroblasts in asthma[J].Eur Respir J,2014,43(2) : 464-473.
[17]Lin L,Zhao X,Yan W,et al.Amelioration of Muc5b mucin hypersecretion is enhanced by IL-33 after 2-APB administration in a murine model of allergic rhinitis[J].Biotech Histochem,2014,89 (4) : 273-286.
[18]Barlow JL,Peel S,Fox J,et al.IL-33 is more potent than IL-25 in provoking IL-13-producing nuocytes (type 2 innate lymphoid cells) and airway contraction[J].J Allergy Clin Immunol,2013,132(4) : 933-941.
[19]Kobayashi T,Iijima K,Checkel JL,et al.IL-1 family cytokines drive Th2 and Th17 cells to innocuous airborne antigens[J].Am J Respir Cell Mol Biol,2013,49(6) : 989-998.
[20]Besnard AG,Togbe D,Couillin I,et al.Inflammasome-IL-1-Th17 response in allergic lung inflammation[J].J Mol Cell Biol,2012,4(1) : 3-10.
[21]Nomura K,Kojima T,Fuchimoto J,et al.Regulation of interleukin-33 and thymic stromal lymphopoietin in human nasal fibroblasts by proinflammatory cytokines[J].Laryngoscope,2012,122(6) : 1185-1192.
[22]Préfontaine D,Lajoie-Kadoch S,Foley S,et al.Increased expression of IL-33 in severe asthma: evidence of expression by airway smooth muscle cells[J].J Immunol.2009,183 (8) : 5094-5103.
[23]Mo JH,Kang EK,Quan SH,et al.Anti-tumor necrosis factor-alpha treatment reduces allergic responses in an allergic rhinitis mouse model[J].Allergy,2011,66(2) : 279-286.
[收稿2015-04-17修回2015-05-13]
(编辑张晓舟)
doi:10.3969/j.issn.1000-484X.2015.10.012
通讯作者及指导教师:胡国柱(1956年-),男,研究员,硕士生导师,主要从事免疫学研究,E-mail: hgz56@126.com。
作者简介:朱喜玲(1988年-),女,主要从事免疫治疗学研究。
文章编号1000-484X(2015) 10-1352-05
文献标志码A
中图分类号R392