宝乐果多糖的体内免疫活性研究①
黎 奔 廖康生 徐方方 陈伟英 焦 红刘 博(广州中医药大学第二附属医院/广东省中医药科学院,广州510006)
宝乐果多糖的体内免疫活性研究①
黎奔廖康生徐方方陈伟英焦红②刘博
(广州中医药大学第二附属医院/广东省中医药科学院,广州510006)
①本文受国家自然科学基金青年科学基金(81202398)、国家中医药管理局基地科研专项(JDZX2012010)、广州市科技攻关项目(201300000147)和广东省科技厅(2012B031800310)资助。
②广东出入境检验检疫局,广州510623。
Studies on immune-enhancing activity of polysaccharides from Borojoa sorbilis cuter
LI Ben,LIAO Kang-Sheng,XU Fang-Fang,CHEN Wei-Ying,JIAO Hong,LIU Bo.Guangdong Provincial Academy of Chinese Medical Sciences/The 2nd Affiliated Hospital of Chinese Medicine,Guangzhou 510006,China
[Abstract]Objective: Studies on the immune-enhancing activity of Polysaccharides from the fruits of Borojoa sorbilis cuter (polysaccharides BSCP) in vivo.Methods: 54 male BALB/c mice were randomly divided into six groups.The immune suppression mice in the three experimental groups,which were induced by cyclophosphamide (CY) at 80 mg/kg/d via intraperitoneal injection,were perfused with 100,200,400 mg/kg/d BSCP for 30 d.The effect of BSCP on cellular immune function,humoral immune function and mononuclear macrophage function were measured.Results: CY-treated mice showed a significant decrease in immune function(P<0.05),humoral immune function(P<0.01) and mononuclear macrophage function(P<0.01) .The administration of BSCP was able to overcome the CY-induced immunosuppression,treatment with BSCP-L,BSCP-M and BSCP-H groups significantly enhanced the cellular immune function(each was P<0.05) and mononuclear macrophage function(each was P<0.05),and treatment with BSCP-M and BSCP-H significantly enhanced humoral immune function(each was P<0.01) .Conclusion: BSCP could significantly increase immune responses and reduce the side effects of CY in immune system.Therefore,the BSCP could be an immunomodulatory agent.
[Key words]Borojoa sorbilis cuter polysaccharides; Immunological activities; Cyclophosphamide-induced; In vivo
天然药物中富含多糖类成分。多糖药理活性广泛,且具有一定的免疫调节活性,是一类非特异性的免疫调节剂。多糖不仅能激活T、B淋巴细胞、巨噬细胞(Mφ)、自然杀伤细胞(NK)、细胞毒T淋巴细胞(CTL)、淋巴因子激活的杀伤细胞(LAK)、树突状细胞(DC)等免疫细胞[1-4],还能促进细胞因子生成,激活补体系统,促进抗体产生,对免疫系统发挥多方面的调节作用[5-7]。
宝乐果(Borojoa sorbilis Cuter.)是茜草科林果属植物Borojoa Patinoi Cuatrec.和Borojoa sorbilis Cuatrec.的成熟果实,产于拉丁美洲厄瓜多尔的热带雨林。现代药理研究证实,宝乐果具有体外抗氧化作用,抗D-半乳糖所致小鼠衰老的作用,抗小鼠胚胎NIH/3T3细胞UVA损伤的作用[8-10]。本文开展对宝乐果多糖的体内免疫活性研究,能够为宝乐果的应用提供科学依据,对宝乐果的深层开发利用具有一定的现实意义。
1 材料与方法
1.1主要实验材料宝乐果:新鲜宝乐果由厄瓜多尔东方食品集团提供,经广东省中医院黄志海研究员鉴定为茜草科林果属植物B.sorbilis Cuatrec的成熟果实;其余试剂如无特殊说明均为国产分析纯。
Hanks缓冲液,杭州吉诺; 4 %鸡红细胞,绵羊红细胞(SRBC),豚鼠血清,广州蕊特生物科技有限公司; MTT,刀豆蛋白A,美国MP Biomedicals生物医药公司; Cyclophosphamide monohydrate,东京化成工业株式会社; Giemsa染液,南京建成生物工程研究有限公司; RPMI1640培养液,PBS缓冲液,美国Hyclone公司;胎牛血清,美国Gibco公司; SA缓冲液,美国Thermo公司;印度墨汁,广州杰特伟生物科技有限公司。实验动物: BALB/c小鼠,雄性,(20±2) g,由广东省实验动物中心提供,合格证号: No.44007200015109。
1.2主要仪器设备超净工作台;酶标仪(Vitorх5),美国PerkinElmer公司; Count star自动细胞计数仪(IC-100),上海睿钰生物科技有限公司;倒置荧光显微镜(DMI3000),德国Leica公司;二氧化碳培养箱(热电311型),美国Thermo Scientific公司;紫外双光分光光度计(U-2910),日本HITACHI公司;超纯水机(Elix5),美国MilliPore公司;电子天平(BS224S),北京赛多利斯仪器系统有限公司;高速台式冷冻离心机(5430R),德国Eppendorf公司等。
1.3宝乐果多糖的制备宝乐果多糖经超高压技术提取,宝乐果在60℃下干燥至恒重后,超微粉碎,过200目筛。准确称取一定量的宝乐果细粉,用95%乙醇浸泡过夜以除去脂溶性成分和部分色素,过滤,滤渣自然晾干后,与一定量的水充分混合后经超高压处理后,3 000 r/min离心10 min,取上清,用95%乙醇将其浓度调至80%,静置过夜,3 000 r/min离心10 min收集棕色沉淀,用无水乙醇充分洗涤,烘干得宝乐果粗多糖,用苯酚硫酸法测得其粗多糖中多糖的含量为76.92%,多糖的总得率为8.28%[12]。粗多糖以Sevage法和透析法去除蛋白质、小分子物质及色素等杂质而得到宝乐果多糖,紫外光谱检测其在260 nm和280 nm,证明其结构中不含核酸与蛋白质成分,苯酚硫酸法测得其多糖含量为88.05 %。
1.4实验动物54只雄性BALB/c小鼠(3~4周龄),饲养于温度(22±2)℃,相对湿度50%~60%的环境中,实验过程中自由饮食。动物适应环境3 d后,随机分为6组,每组9只。两组正常小鼠作为正常对照组和阳性对照组,正常对照组每天灌胃相应的生理盐水,阳性对照组每天按体重200 mg/kg灌胃宝乐果多糖水溶液。其他四组小鼠,第1、2、3、13 和23 d按体重经腹腔注射80 mg/kg环磷酰胺生理盐水溶液,阴性对照组每天灌胃相应的生理盐水,三组给药组每天分别按体重100 mg/kg(BSCP-L组),200 mg/kg(BSCP-M组),400 mg/kg(BSCP-H组)的剂量灌胃相应的宝乐果多糖水溶液。饲养30天,在最后一次灌胃给药后24 h,颈椎脱臼处死。
1.5细胞免疫功能测定MTT法测定脾淋巴细胞增殖反应无菌取脾,置于盛有适量无菌Hank's液平皿中,用镊子轻轻将脾磨碎,制成单个细胞悬液。经40 μm尼龙网过滤,用Hank's液洗两次,每次离心10 min(1 000 r/min)。然后将细胞悬浮于1 ml的完全培养液中,用台酚兰染色计数活细胞数(在95 %以上),调整细胞浓度为3×106个/ml。将每一份脾细胞悬液分两孔加入24孔培养板中,每孔1 ml,一孔加75 μl Con A液(相当于7.5 μg/ml),另一孔作为对照,置5 %CO2,37℃孵箱中培养72 h。培养结束前4 h,每孔轻轻吸去上清液0.7 ml,加入0.7 ml不含小牛血清的RPMI1640培养液,同时加入MTT(5 mg/ml) 50 μl/孔,继续培养4 h。培养结束后,每孔加入1 ml酸性异丙醇,吹打均匀,使紫色结晶完全溶解。然后分装到96孔培养板中,每个孔做3个平行孔,用酶标仪,以570 nm波长测定光密度值。
1.6体液免疫功能测定
1.6.1抗体生成细胞检测在小鼠灌胃第24天,腹腔注射0.2 ml的2 %压积SRBC生理盐水(v/v)细胞悬液免疫,将SRBC免疫7天后的小鼠颈椎脱臼处死,按1.5方法取脾制成单细胞悬液,将细胞浓度调整为5×106个/ml。将表层培养基加热溶解后,放45℃~50℃水浴保温,与等量pH=7.2~7.4、2倍浓度的Hank's液混合,分装小试管,每管0.5 ml,再向管内加50 μl 10% SRBC(v/v,用SA缓冲液配制),20 μl脾细胞悬液(5×106个/ml),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中孵育1 h,然后用SA缓冲液稀释的补体(1∶8)加入玻片架凹槽内,继续温育1 h后,计数溶血空斑数,用空斑数/106脾细胞来表示。
1.6.2血清溶血素的测定(血凝法)取SRBC免疫过的小鼠血清,用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝实验板内,每孔100 μl,再加入100 μl 0.5 %(v/v)的SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3 h,观察血球凝集程度。血清凝集程度一般分为5级(0-Ⅳ)记录,按下式计算抗体积数:
抗体积数=(S1+2S2+3S3……nSn)。式中1、2、3……n代表对倍稀释的指数,S代表凝集程度的级别,抗体积数越大,表示血清抗体越高。0级,红细胞全部下沉,集中在孔底部形成致密的圆点状,四周液体清晰。Ⅰ级,红细胞大部分沉集在孔底成圆点状,四周有少量凝集的红细胞。Ⅱ级,凝集的红细胞在孔底形成薄层,中心可以明显见到一个疏松的红点。Ⅲ级,凝集的红细胞均匀地铺散在孔底成一薄层,中心隐约可见一个小红点。Ⅳ级,凝集的红细胞均匀地铺散在孔底成一薄层,凝块有时成卷折状。
1.7单核-巨噬细胞功能测定
1.7.1小鼠碳廓清实验按体重从小鼠尾静脉注入稀释的印度墨汁(10 ml/kg),待墨汁注入,立即计时,注射墨汁后2 min(t1)、10 min(t2),分别从内眦静脉丛取血20 μl,并立即将其加到2 ml 0.1 % Na2CO3中。用分光光度计在600 nm波长处测光密度值(OD1),以Na2CO3溶液做空白对照(OD2)。将小鼠处死,取肝脏和脾脏,用滤纸吸干脏器表面血污,分别称重。以吞噬指数表示小鼠碳廓清的能力,按下式计算吞噬指数a。K=(lgOD1-lgOD2) /(t2-t1) ;吞噬指数a=[体重/(肝重+脾重)]×K1/3。
1.7.2小鼠腹腔巨噬细胞吞噬鸡红细胞实验(滴片法)小鼠巨噬细胞的激活:实验前4 d给每只小鼠腹腔注射2 %压积羊血细胞0.2 ml。用颈椎脱臼法处死小鼠,腹腔注射加小牛血清的Hank's液4 ml/只,轻轻按揉腹部20次,以充分洗出腹腔巨噬细胞,然后将腹壁剪开一个小口,用胶头吸管吸取腹腔洗液2 ml于试管内。用1 ml加样器吸取腹腔洗液0.5 ml 1 %鸡血红细胞悬液的试管内,混匀。用注射器吸取0.5 ml混合液,加入玻片的琼脂圈内。放置孵箱内37℃孵育15~20 min。用蒸馏水冲洗干净,晾干,用显微镜计数吞噬率和吞噬指数。吞噬率为每100个巨噬细胞中,吞噬鸡红细胞的巨噬细胞所占的百分率;吞噬指数为平均每个巨噬细胞吞噬鸡红细胞的个数。
1.8统计分析统计分析用SPSS13版本,采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值<F0.05,结论:各组均数间差异无显著性; F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计,对非正态或方差不齐的数据经Kruskal-Wallis H检验,χ2值<χ20.05,结论:各组均数间差异无显著性;χ2值≥χ2
0.05,P≤0.05,用秩变换技术实现多个实验组和一个对照组均数的两两比较进行比较[11]。
2 结果
2.1宝乐果多糖对细胞免疫功能的影响ConA诱导小鼠脾淋巴细胞转化实验,图1列出了宝乐果多糖对ConA诱导的小鼠脾淋巴细胞转化的影响。阴性对照组的脾淋巴细胞转化功能与正常对照组比较明显降低(P<0.05)。灌服低、中、高剂量的宝乐果多糖能显著提高脾淋巴细胞的转化功能,与阴性对照组相比(P<0.05),且呈剂效关系。阳性对照组的脾淋巴细胞的转化功能也明显高于正常对照组(P<0.05)。
2.2宝乐果多糖对体液免疫功能的影响
2.2.1宝乐果多糖对抗体生成细胞的影响,图2列出了宝乐果多糖对抗体生成细胞的影响。阴性对照组的溶血空斑数明显低于正常对照组(P<0.01)。给药组(BSCP-M与BSCP-H)的溶血空白数明显多于阴性对照组(P<0.01)。阳性对照组的溶血空斑数也明显多于正常对照组(P<0.01)。
2.2.2宝乐果多糖对血清溶血素的影响图3列出了宝乐果多糖血清溶血素的影响,宝乐果多糖能提高血清溶血素的功能(抗体积数),与阴性对照组相比(P<0.05),且呈剂效关系。阳性对照组的血清溶血素功能也明显高于正常对照组(P<0.01)。
2.3宝乐果多糖对单核-巨噬细胞功能的影响表1列出了不同剂量的宝乐果多糖对小鼠单核-巨噬细胞吞噬功能的影响情况。阴性对照组的单核-巨噬细胞功能明显低于正常对照组(P<0.01)。灌服不同剂量的宝乐果多糖能不同程度地增强单核-巨噬细胞的功能,与阴性对照组相比(P<0.05)。阳性对照组的单核-巨噬细胞的功能也明显强于正常对照组(P<0.01)。
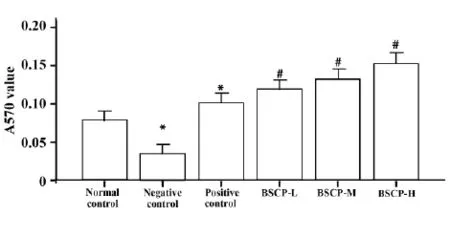
图1 宝乐果多糖对ConA诱导的小鼠淋巴细胞转化的影响(x ±s)Fig.1 Effect of BSCP on ConA-induced transfor-mation of lymphocyte(x±s)
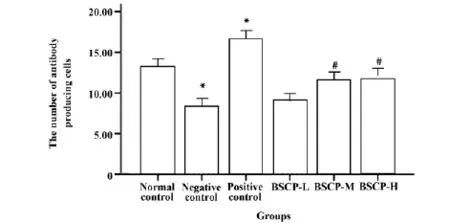
图2 宝乐果多糖对抗体生成细胞的影响(x ±s)Fig.2 Effect of BSCP on antibody-producing cell(x±s)
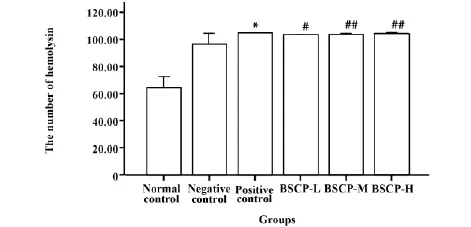
图3 宝乐果多糖对血清溶血素的影响(x±s) Fig.3 Effect of BSCP on hemolysin(x±s)

表1 宝乐果多糖对单核-巨噬细胞功能的影响(x ±s)Tab.1 Effect BSCP on mononuclear macrophages (x±s)
3 讨论
环磷酰胺是一种有效的癌症化疗药物,长期给药会导致免疫抑制反应,导致红细胞生成素的缺少而引起贫血症[12]。而在本实验中也证实了环磷酰胺能诱导免疫抑制反应。
T淋巴细胞受有丝分裂原Con A刺激后能发生增殖反应[13],活细胞特别是增殖细胞中的线粒体水解酶可将MTT分解为兰紫色结晶,其光密度值能反应细胞的增殖情况。本实验中,BSCP能显著地改善环磷酰胺所致的脾淋巴细胞功能低下(各为P<0.05),而且结果显示,BSCP刺激T细胞的增殖作用呈良好的量效关系,其作用机制可能是增强IFN、IL-2、IFN-γ等细胞因子的活性,这些细胞因子都能够促进T细胞增殖[14]。
正常小鼠在受动物红细胞免疫后,可以产生特异性抗体,称为溶血素,溶血素在有补体的情况下会裂解红细胞,红细胞的溶血与血清中的抗体水平有关,因此,血清里的溶血情况可反映抗体生成细胞数[15]。本实验中,BSCP能改善环磷酰胺所致的体液免疫功能低下,提高抗体生成细胞数,目前,关于中药多糖增强体液免疫功能的机制还不清楚,其机制有待进一步研究。
小鼠的碳廓清实验与腹腔巨噬细胞吞噬鸡红细胞实验都可反映小鼠体内单核巨噬细胞的吞噬功能,其功能在细胞免疫方面发挥着重要作用。绝大数中药多糖都能促进巨噬细胞的吞噬功能,本实验中,BSCP能改善环磷酰胺所致的单核巨噬细胞功能低下,其作用机制可能是BSCP能提高单核巨噬细胞的NO的分泌和先天炎性细胞因子的功能从而达到提高单核巨噬细胞的功能[16]。
综上所述,宝乐果多糖在小鼠体内呈现出明显的对抗环磷酰胺所致的免疫抑制反应,增强了细胞免疫、体液免疫和单核巨噬细胞功能,提示BSCP可作用于免疫系统的多个环节,改善机体的免疫功能。按照《保健食品检验与评价技术规范》(2003版)的1.2项,可判定宝乐果多糖具有增强免疫力的作用。因此,宝乐果多糖可以被视为潜在的免疫调节剂用于疾病的治疗与食品的开发。
参考文献:
[1]Zhou HB,Liu GQ,Huang FT,et al.Improved production,purification and bioactivity of a polysaccharide from submerged cultured Ganoderma lucidum[J].Arch Pharm Res,2014,37(12) : 1530-1537.
[2]Cho Chang-Won,Han Chun-Ji,Rhee Young Kyoung,et al.Cheonggukjang polysaccharides enhance immune activities and prevent cyclophosphamide-induced immunosuppression[J].Int J Biol Macromole,2015,72: 519-525.
[3]Wang N,Yang JY,Lu JG,et al.A polysaccharide from Salvia miltiorrhiza Bunge improves immune function in gastric cancer rats[J].Carbohydrate Polymers,2014,111: 47-55.
[4]Zhu XL,Lin ZB.Effects of Ganoderma lucidum polysaccharides on proliferation and cytotoxicity of cytokine-induced killer cells[J].Acta Pharmacologica Sinica,2005,26(9) : 1130-1137.
[5]Habijanic Jozica,Berovic Marin,Boh Bojana,et al.Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-alpha,IL-12,IFN-gamma,IL-2,IL-4,IL-10 and IL-17[J].New Biotechnol,2015,32(1) : 85-95.
[6]Flamm D,Blaschek W.A Sulfated cyanobacterial polysaccharide proven as a strong inhibitor of human complement activity in an in vitro assay[J].Planta Medica,2014,80(12) : 1009-1016.
[7]Wei JT,Wang SX,Liu G,et al.Polysaccharides from Enteromorpha prolifera enhance the immunity of normal mice[J].Int J Biol Macromol,2014,64: 1-5.
[8]鲁亦乐,徐方方,李金维,等.宝乐果体外抗氧化作用[J].国际药学研究杂志,2013,40(6) : 817-819.
[9]战静,焦红,王家骥,等.宝乐果(Borojo)水果浓缩粉对D-半乳糖致衰老小鼠的抗氧化作用[J].食品科学,2013,34(7) : 293-295.
[10]李宏,焦红,杨颖,等.宝乐果粉及其提取物降低小鼠胚胎NIH/ 3T3细胞UVA损伤作用研究[J].中国美容医学,2012,21(12) : 63-65.
[11]刘万里,薛茜,曹明芹,等.用SPSS实现完全随机设计多组比较秩和检验的多重比较[J].地方病通报,2007,22(2) : 27-29.
[12]Ren Z,He CH,Fan YH,et al.Immune-enhancing activity of polysaccharides from Cytromium macrophyllum[J].Int J Biol Macromol,2012,70: 590-595.
[13]牛晓晖,纪凤兰,张伟,等.云芝多糖对小鼠细胞因子的影响[J].中国免疫学杂志,2006; 22(12) : 1124-1127.
[14]Habijanic Jozica,Berovic Marin,Boh Bojana,et al.Submerged cultivation of Ganoderma lucidum and the effects of its polysaccharides on the production of human cytokines TNF-alpha,IL-12,IFN-gamma,IL-2,IL-4,IL-10 and IL-17[J].New Biotechnol,2015,32(1) : 85-95.
[15]陈晓东,周丽萍,余平安,等.肝病大鼠创伤弧菌攻击后肺损伤和血清细胞因子的监测[J].中国免疫学杂志,2007; 23 (11) : 968-974.
[16]Chen RZ,Li HP,Li SZ,et al.Extraction optimization,preliminary characterization and immunological activity of polysaccharides from figs[J].Int J Biol Macromol,2015,72: 185-194.
[收稿2015-05-04修回2015-07-07]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2015.10.010
通讯作者及指导教师:焦红(1956年-),女,研究员,硕士生导师,主要从事食品与化妆品功效研究与分析测试方面研究,E-mail: jhciq1228@ 163.com。刘博(1979年-),男,博士,研究员,博士生导师,主要从事药物化学与新药研发方面研究,E-mail: doctliu@ 263.net。
作者简介:黎奔(1962年-),女,主任药师,硕士生导师,主要从事临床药学研究。
中图分类号R285.5
文献标志码A
文章编号1000-484X(2015) 10-1342-05[摘要]目的:研究宝乐果多糖体内免疫活性。方法: 54只雄性BALB/c小鼠被随机分为6组,每组9只。以80 mg/ (kg·d)腹腔注射环磷酰胺诱导的免疫功能低下小鼠为实验对象,设100、200、400 mg/(kg·d)三个水平处理,饲养30 d后观察多糖对细胞免疫功能、体液免疫功能和单核巨噬细胞功能的影响。结果:腹腔注射环磷酰胺可以显著降低小鼠体内细胞免疫(P<0.05 ),体液免疫(P<0.01)和单核巨噬细胞(P<0.01)的功能。宝乐果多糖能改善环磷酰胺诱导的免疫力低下,灌服低、中、高剂量的多糖能显著改善小鼠体内细胞免疫功能(均为P<0.05)和单核巨噬细胞的功能(均为P<0.05)、而中、高剂量的多糖能显著提高体液免疫功能(P<0.01)。结论:宝乐果多糖能增强体内免疫力,并对环磷酰胺有一定的减毒作用。因此,宝乐果多糖可以作为一种免疫调节物质。[关键词]宝乐果多糖;免疫活性;环磷酰胺诱导;体内