绞股蓝染色体调控黄瓜次级代谢产物的研究
黄玉兰 (黑龙江八一农垦大学生命科学技术学院,黑龙江大庆163319)
黄瓜(Cucumis sativus L.)是葫芦科黄瓜属1年生蔓生草本植物,是我国主要的蔬菜作物之一。黄瓜播种面积和总产量在我国主要蔬菜中位居前列[1]。近年来,随着我国保护地黄瓜栽培面积的逐渐扩大,黄瓜病害、连作障碍和种性退化现象严重[2]。因此,“优质、高产、多抗、生态、高效”黄瓜新品种的选育迫在眉睫。农药作为补救性措施虽然得到了广泛的应用,同时也带来了农药残留和人体内毒性积累的问题。为适应不良环境,植物本身有多种反击有害生物侵害的方法,利用次级代谢产物驱虫,阻止病菌的侵染就是一种重要的化学防御措施,其中黄酮类和三萜类皂苷是植物抗病虫侵害的2类重要的次生代谢物质[3-5]。
绞股蓝(Gynostemma pentaphyllum)是多年生蔓生藤本,为葫芦科植物,有“南方人参”和“第二人参”的美誉,别名小苦药、公罗锅底、五叶藤、遍地生根、甘茶蔓等[6-7]。有研究表明,绞股蓝黄酮类和三萜类化合物的含量较高,绞股蓝中仅8种黄酮含量就高达2.4 mg/g,仅18种三萜类皂苷含量高达89.9 mg/g[8]。林毅等研究表明,中草药绞股蓝具有广谱的抗植物病毒活性和抵抗多种植物病原真菌以及农业害虫的活性,为培育抗病虫作物新品种提供了新资源[9]。如果将绞股蓝黄酮和三萜类化合物高效的合成能力及抗病虫能力转移到黄瓜上,黄瓜的抗病虫防卫能力将有可能增强。为此,笔者通过植物外源遗传物质动态导入法[9],选取绞股蓝染色体作为供体,黄瓜原生质体作为受体,采用电击法将绞股蓝染色体转至黄瓜原生质体细胞中,研究了其调控黄瓜次生代谢产物的作用,以期为黄瓜育种工作提供参考。
1 材料与方法
1.1 材料
1.1.1 供试植物。绞股蓝种子购自安康平利县百草堂科技有限公司绞股蓝种质资源圃基地;黄瓜品种“津研4号”由黑龙江八一农垦大学植物科学技术学院提供。
1.1.2 试剂。甘露醇(天津市福晨化学试剂厂)、纤维素酶(Onozuka R-10,日本 Yakult公司)、果胶酶(Macerozyme R-10,日本 Yakult公司)。
1.1.3 仪器。HZS-H水浴振荡器;UV-2100型紫外可见分光光度计;GL-20G-Ⅱ高速冷冻离心机;TGL-16G台式离心机;恒压、恒流DF-D电泳仪;UV-ⅥA型紫外透射反射仪;Shimadzu LC2010HT高效液相色谱仪、LCsolution色谱工作站(日本岛津公司);多功能细胞电穿孔仪。
1.2 方法
1.2.1 绞股蓝悬浮细胞培养及茎段染色体片段的分离制备[10-11]。取绞股蓝无菌苗的叶片和茎段为外植体,切成0.5 cm小段培养在1.0 mg/L 6-BA+1.0 mg/L NAA组合的MS培养基上进行愈伤组织常规诱导,选择最佳的激素配比进行愈伤组织的增殖培养,调控6-BA和NAA的浓度将增殖培养的愈伤组织继代培养成胚性愈伤组织。将胚性愈伤组织接种液体培养基中进行悬浮培养,获得绞股蓝悬浮细胞。
取相对饱满的悬浮细胞用质量百分比为0.1%的秋水仙素处理16 h,用MS培养基洗涤后称10 g放入100 ml裂解液中,解离绞股蓝悬浮细胞的细胞壁和细胞质膜10 h;采用蔗糖密度梯度离心对悬浮细胞细胞核纯化,过滤,1 500×g离心浓缩细胞核,低温保存;将收集到的细胞核用75 mmol/L氯化钾4℃低渗10 min,1 000 r/min离心10 min,沉淀悬于0.75 mol/L 1,6-己二醇的CPW缓冲溶液上37℃水浴10 min,再用7号针头10 ml注射器推挤。将染色体溶液置于25%蔗糖溶液中,500×g离心60 min,大量染色体都集中在25%蔗糖界面上。
1.2.2 黄瓜原生质的制备与纯化。选取植株顶端未充分展开的幼嫩子叶,用清水冲洗干净,75%乙醇浸泡数秒,再用0.1%HgCl2溶液消毒7 min,然后用无菌水清洗4~5次,撕下叶片下表皮,并将去掉下表皮一面置于盛有酶液培养皿中,在黑暗条件下25℃恒温摇床上50 r/min振荡,以分离原生质体。
1.2.3 绞股蓝染色体片段转染黄瓜原生质体。受体:黄瓜原生质体。DNA供体:分离纯化的染色体。采用多功能细胞电穿孔仪器。使用参数:脉冲电压100~500 V,脉冲时间20~100 μs,脉冲宽度20 ~60 μs,脉冲次数1 ~5。电转染缓冲液:0.5 mol/L 蔗糖、10 mmol/L CaCl2,10 mmol/L NaH2PO4-Na2HPO4(pH 6.0)和0.03% 葡聚糖硫酸钾。用转染缓冲液调整原生质体或细胞核浓度至1×107~5×107个/ml,取0.8 ml于每个 Eppendorf管中,加入10~50 μg供体染色体,混匀,置冰上10 min。然后将原生质体-染色体悬液转入电击小室,迅速放入电融合仪进行脉冲电击,将转染后收集原生质体进行看护培养。
1.2.4 转染子的培养与再生愈伤组织的诱导。以平皿固体培养基上生长旺盛的黄瓜愈伤细胞为看护者,其上覆盖2张中速滤纸,将转染子与融合子置于其上培养。经过筛选培养条件:黑暗,(25±1)℃,空气相对湿度为60% ~70%。培养基为KM8P添加0.5 mol/L甘露醇、30 g/L葡萄糖、0.03%葡聚糖硫酸钾、0.5 mg/L 2,4-D 和 1.0 mg/L 6-BA。培养 15 ~30 d后,2,4-D减半,甘露醇减半,调控不同的激素浓度诱导出再生愈伤组织。
1.2.5 再生愈伤组织中总黄酮和人参皂苷Rb1检测。采用分光光度法,以芦丁对照品配制标准溶液,于510 nm波长下比色定量测定再生愈伤组织中总黄酮吸光度,以吸光度为纵坐标,浓度为横坐标,得芦丁浓度(Y)与吸光度(A)的关系曲线的回归方程:Y=0.101 7A-0.001 6。相关系数 r=0.998 2,芦丁浓度与吸光度有良好的相关性。
采用HPLC法,以流动相为乙腈(a)-水(b)梯度洗脱(0~10 min,15%a→20%a;10 ~40 min,20%a→40%a;40 ~60 min,40%a~15%a),流速为1 ml/min,检测波长为203 nm,柱温30℃的条件对标品和各样品进行梯度洗脱,测其再生愈伤组织人参皂苷Rb1的含量。
2 结果与分析
2.1 绞股蓝悬浮细胞培养及染色体的分离 在优化的培养基上对绞股蓝愈伤组织进行细胞的悬浮培养,悬浮细胞可不断增殖,状态良好。其胚性愈伤组织培养的悬浮细胞见图1。将绞股蓝悬浮细胞预处理和酶解去除细胞壁细胞膜,经抽滤、自然沉降、离心等方法得到绞股蓝染色体(图2)。
2.2 黄瓜原生质体的制备分离与纯化 图3是由悬浮培养的“津研4号”黄瓜胚性细胞经酶解制备的原生质体,原生质体的产率和完整率都较高,获得了高质量的原生质体,建立了黄瓜原生质体的制备和培养等方法。

图1 绞股蓝悬浮细胞
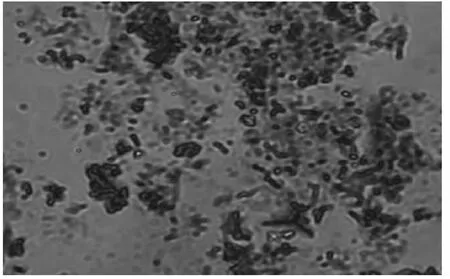
图2 绞股蓝染色体
2.3 转染子的培养与再生愈伤组织的诱导 转染后的原生质体培养采用的是固体薄层培养法,将3~4 ml的原生质体按照一定细胞密度(1×104~1×105个/L)与等体积的处于45℃的琼脂培养基混合,在培养皿中制成薄层固体平板,在含0.5 mg/L 2,4-D、1.0 mg/L 6-BA 的MS 固体培养基上长成结构致密的带绿点大块愈伤组织(图4)。
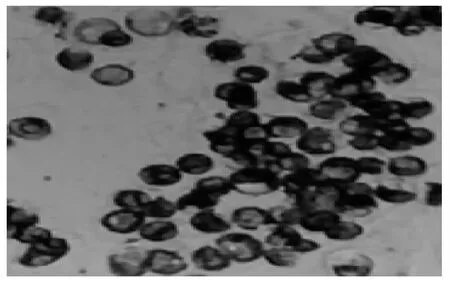
图3 纯化的原生质体
2.4 愈伤组织中黄酮化合物含量的测定 由表1可知,侵染绞股蓝DNA的再生黄瓜愈伤组织中总黄酮含量高于对照组,其再生愈伤组织总黄酮含量高达1.248%,比对照组高出4.38%,也明显高于蔡健等测得的含量[12]。
2.5 再生愈伤组织人参皂苷Rb1含量的测定 测定结果表明,侵染绞股蓝黄瓜愈伤组织中含有绞股蓝人参皂苷Rb1达(0.92 ±0.07)mg/g,虽然含量很低,但可以说明绞股蓝中某些成分对黄瓜的次级代谢产物起了一定的作用,具体如何调控还有待于进一步研究。
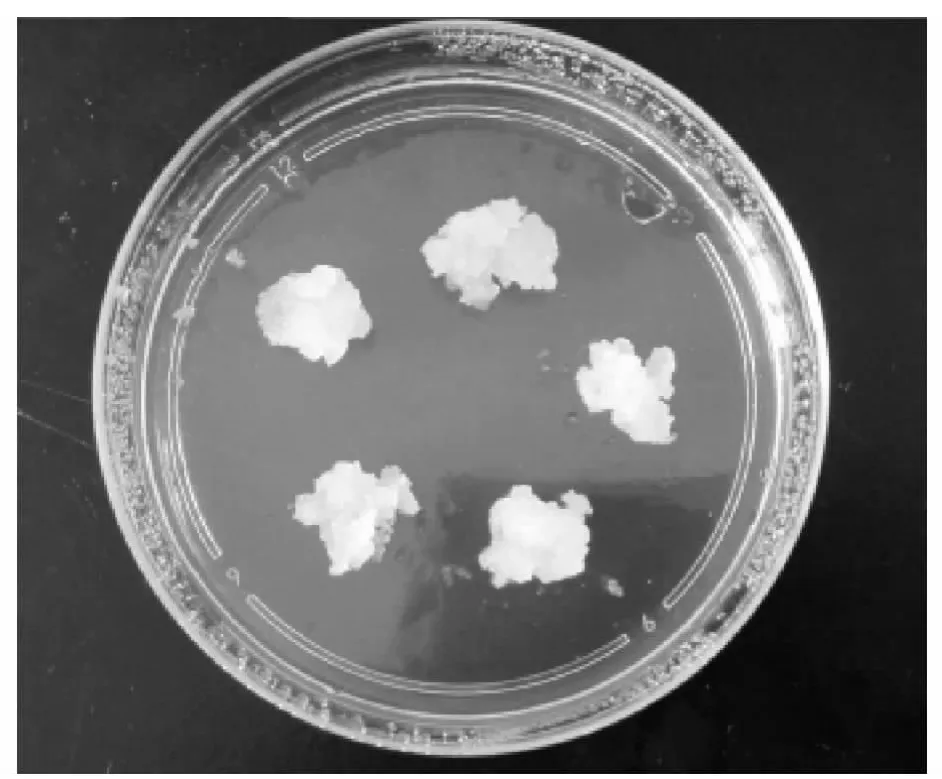
图4 再生愈伤组织

表1 愈伤组织中黄酮化合物含量的比较
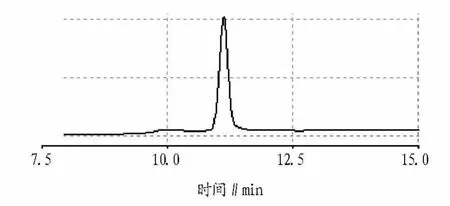
图5 绞股蓝皂苷Rb1标品色谱
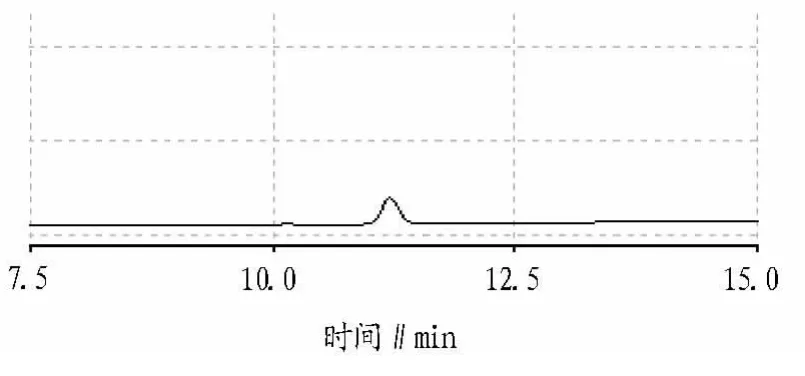
图6 转染组愈伤组织样品色谱
转染组愈伤组织样品液相色谱分离情况按“1.2.5”色谱条件测定,比较人参皂苷Rb1标准品及转染组色谱(图5、6),可以看出在该试验条件下色谱峰分离良好。在保留时间为11.198 min时出现人参皂苷Rb1的峰值,是否存在其他皂苷还有待于进一步研究。
2.5.1 线性关系的考察。分别取绞股蓝皂苷Rb1标准品5、10、15、20 和 25 μl进样,在相同条件下测定,以峰面积(y)为纵坐标,进样量(x)为横坐标做标准曲线,计算回归曲线性方程:y=324 161x-244 034,r=0.999 8,表明进样量在 0.5 ~2.5 μg 范围内线性关系良好。
2.5.2 精密度试验。量取对照溶液,按“1.2.5”色谱条件连续进样5次,测定峰面积的相对标准偏差(RSD)为1.02%。
2.5.3 重现性试验。取供试品1份,按供试品溶液制备方法平行制备5份并测定。测定含量的RSD为2.18%,表明重现性较好。
2.5.4 回收率试验。取同一样品6份,分别加入人参皂苷Rb1对照品2 mg,按照供试品溶液制备方法,进样10 μl,测定含量,计算平均回收率为98.20%,RSD为2.20%。
2.5.5 含量测定。结果表明,转染组愈伤组织人参皂苷Rb1含量为 1.04 mg/g。
3 讨论
外源DNA导入一些物种可以达到基因转移的目的,其可靠性和可行性已经在水稻、野生大豆外源DNA导入研究中得到验证[13-15]。而绞股蓝和黄瓜同属葫芦科植物,在次生代谢的调节上有很多共同之处,它们的甲羟戊酸途径是比较活跃的,能够较好地合成距离人参皂苷非常近的前体物2,3-氧化鲨烯[16]。然而绞股蓝在黄酮和皂苷上的代谢上要远比黄瓜活跃。
该研究将绞股蓝悬浮细胞预处理和酶解去除细胞壁细胞膜,经抽滤、自然沉降、离心等方法得到绞股蓝染色体,为绞股蓝染色体转染黄瓜原生质体提供了较好的受体。试验结果表明,黄酮含量高于对照组,转染组愈伤组织中黄酮含量比对照组高出4.38%。而且在转染组还含有人参皂苷Rb1,虽然含量较低,但可以说明绞股蓝种皂苷成分可能对黄瓜的次级代谢产物的调控起了一定的作用,可能就是甲羟戊酸途径中距离人参皂苷非常近的前体物——2,3-氧化鲨烯所调控,具体的调控机制还有待于进一步研究。
该研究采用电转染试图将绞股蓝染色体转染至黄瓜原生质体,并经过经看护培养诱导出再生愈伤组织,经分光光度检测转染组黄酮含量比对照组高,尤其是再生黄瓜愈伤组织中检测到绞股蓝人参皂苷Rb1。利用该项技术实现作物科间遗传物质的转移在一定条件下是可能的,同时为黄瓜的种质资源创新及育种提供了理论与技术依据。
[1]吴雪霞,查丁石,杨少军.我国黄瓜育种研究进展[J].江西农业学报,2010(9):53-55.
[2]武涛,秦智伟,周秀艳,等.转基因技术在黄瓜性状改良中的应用及战.略思考[J].中国蔬菜,2010(20):1-8.
[3]AUGUSTIIN J M,KUZINA V,ANDERSEN S B,et al.Molecular activities,biosynthesis and evolution of triterpenoid saponins[J].Phytochemistry,2011,72(6):435 -457.
[4]MAKOI J H J R,CHIMPHANGO S B M,DAKORA F D.Seed flavonoids and anthocyanins as markers of enhanced plant defence in nodulated cowpea(Vigna unguiculata L.Walp.)[J].Field Crops Research,2010,118(1):21 -27.
[5]TI X,ZHANG Q.Advances in research of induced resistance to insects in cotton[J].Frontiers of Biology in China.2009,4(3):289 -297.
[6]何显忠,邱江沁.绞股蓝化学成分和药理作用研究进展[J].中国中医药信息杂,2008,5(S1):84.
[7]李金青,杨洪军.绞股蓝的药理作用研究进展[J].中国现代药物应用,2009,3(7):189.
[8]KAO T H,HUANG S C,INBARAJ B S.Determination of flavonoids and saponins in Gynostemma pentaphyllum(Thunb.)Makino by liquid chromatography-mass spectrometry[J].Analytica Chimica Acta,2008,626(2):200-211.
[9]朱培坤.高等植物染色体杂交[M].济南:山东科学技术出版社,2011.
[10]叶金山,温强,江香梅,等.壳斗科5属植物基因组DNA提取方法研究[J].江西林业科技,2008(6):10 -12.
[11]巩艳红.刘军.张健,等.毛豹皮樟的叶片DNA提取及其RAPD引物筛选[J].西北林学院学报,2004,19(4):35 -37.
[12]蔡健,王薇.黄瓜叶中总黄酮含量的研究[J].食品科学,2005,26(8):194-497.
[13]罗忠训,万树青,夏桂先,等.未传粉子房显微注射向水稻转移外源基因的研究[J].科学通报,1987,32(11):863 -865.
[14]CHRISTOU P.Production of transgene rice plant from agrinomically important inlica and japonica via electric discharge partical acceleration of exogenous DNA into immature zygoyic embryos[J].Bio/Technology,1991,9:91 -96.
[15]雷勃钧,尹光初,卢翠华,等.外源DNA直接导入大豆的研究[J].大豆科学,1991,10(10):58 -63.
[16]郜玉钢,王亚星,臧埔,等.人参皂苷生物合成途径的初步研究[J].时珍国医国药,2011(10):2422-2423.

