原花青素对大鼠脊髓损伤后神经胶质酸性蛋白和脑源性神经营养因子表达的影响
陈春梅
原花青素对大鼠脊髓损伤后神经胶质酸性蛋白和脑源性神经营养因子表达的影响
陈春梅
目的 观察原花青素对脊髓损伤后大鼠胶质纤维酸性蛋白(GFAP)、脑源性神经营养因子(BDNF)表达变化的影响。方法 48只健康成年Sprague-Daw ley大鼠分为原花青素组(A组)和对照组(B组)。采用Allen法复制大鼠T9急性脊髓损伤模型,于术后1 d、3 d和7 d对各组大鼠行后肢运动功能BBB评分和斜板试验;测定血清丙二醛(MDA)和超氧化物歧化酶(SOD);以及免疫组织化学染色检测脊髓GFAP和BDNP的表达。结果 术后3 d、7 d,A组大鼠BBB评分和斜板试验成绩均优于B组(P<0.05)。术后1 d、3 d及7 d,A组大鼠血清SOD活性和MDA含量优于B组(P<0.05)。术后各时间点,A组GFAP表达均明显低于B组(P<0.01);A 组BDNF表达均显著高于B组(P<0.001)。结论 原花青素可有效抑制脂质过氧化反应,抑制脊髓损伤后大鼠脊髓组织GFAP的表达,促进内源性BDNF的合成,从而促进脊髓损伤大鼠功能恢复。
脊髓损伤;原花青素;神经胶质酸性蛋白;神经生长因子;大鼠
[本文著录格式] 陈春梅.原花青素对大鼠脊髓损伤后神经胶质酸性蛋白和脑源性神经营养因子表达的影响[J].中国康复理论与实践,2015,21(8):883-888.
CITED AS:Chen CM.Effectof proanthocyanidin on expression of glial fibrillary acidic protein and brain-derived neurotrophic factor in ratsafter spinal cord injury[J].Zhongguo Kangfu Lilun Yu Shijian,2015,21(8):883-888.
脊髓损伤(spinal cord injury,SCI)是一种主要由异常外力(交通事故、运动、塌方、高空坠落摔伤、高空坠物砸伤以及地震等自然灾害引起的外力)作用脊柱而导致的创伤性疾病,其发病率高,往往造成不同程度的四肢瘫或截瘫。
脊髓损伤可以分为原发性损伤和继发性损伤两类。原发性损伤是指损伤即刻的机械性暴力引起的椎管连续性破坏,骨折或脱位压迫脊髓等形式的损伤,这种损伤往往是不可逆转的;继发性损伤是在原发性损伤的基础上,由于继发性水肿,炎症反应,局部缺血,细胞因子、生长因子及过氧化基团异常变化等对脊髓产生的毒害作用,这种继发性损害可能更严重并可造成永久性功能障碍[1]。
目前临床上对脊髓损伤的治疗除及时、有效地稳定脊柱,解除脊髓压迫,脊髓减压等治疗外,也不能忽视早期及时地应用有效的药物治疗以减少继发性损伤,促进损伤脊髓的功能恢复[2-3]。
花青素是一种来源广泛的存在于植物中的水溶性色素。花青素除了作为植物色素外,同时也是一类具有药理功能的活性成分,具有很强的抗氧化功能,可以清除体内的自由基、降低氧化酶的活性,抑制炎症等[4-5]。同西药相比,花青素具有天然、低毒、安全的优势,是一种理想的药物选择。
目前,国内外对花青素在脊髓损伤方面的研究较少。本实验以胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)为观察指标,制备脊髓损伤模型,探讨经原花青素对大鼠脊髓损伤后GFAP、BDNF表达的影响,进而探究原花青素对脊髓损伤后早期中枢神经功能恢复的影响。
1 材料与方法
1.1 实验动物及分组
清洁级健康成年Sprague-Daw ley大鼠48只,雌雄不拘,体质量(240±20)g,由重庆医科大学实验动物中心提供。按照随机数字表随机分为原花青素组(A 组)和对照组(B组),每组24只。每组再分为1 d、3 d、7 d 3个亚组,每个亚组8只。
1.2 模型制备
大鼠术前常规行行为学测试,确认其运动功能正常后,用1.5%戊巴比妥钠30mg/kg腹腔注射麻醉。大鼠俯卧固定于手术台上,背部去毛,碘伏常规消毒。沿正中线切开大鼠背部皮肤,显露椎板及棘突。明确T9位置后,沿紧靠棘突的两边切开背部肌肉,去除椎板,暴露脊髓,用自制数字式脊髓损伤动物模型制备仪打击制备脊髓损伤模型(A llen法),打击强度为10 g×25mm。打击后即刻见大鼠双后肢发生不同程度抽搐,尾部甩动,随后完全松弛,标志模型制备成功。逐层缝合切口。立即腹腔注射0.9%氯化钠注射液9 m l/kg补液。术后每天腹腔注射8×104U青霉素钠3 d以防感染。待动物清醒后放回饲养笼中单笼饲养。术后大鼠自由进食、饮水,定时清洁笼具,保持适宜室温;每天挤压膀胱排尿3次,直至大鼠能自主排尿。
1.3 治疗方法
A组:造模成功后30m in,腹腔注射原花青素40 mg/kg,此后每天注射1次;B组:造模成功后腹腔注射等体积生理盐水。
1.4 运动功能评定
于造模后1 d、3 d、7 d,各组选取8只大鼠,进行以下测试。
1.4.1 BBB评分[6]
大鼠置于宽大活动场地,采用双人盲法观察其后肢运动情况,联合考察大鼠后肢的运动,躯干的位置及稳定性、步态、协调性、爪的置放、足趾间隙及尾的位置。取左右两侧评分的平均值作为最后评分。
1.4.2 斜板试验[7]
大鼠置自制斜板上,垫一个橡胶垫,将大鼠身体纵轴与斜板纵轴平行,大鼠头朝斜板抬高侧,斜板倾斜角度从0°开始缓慢上升。记录大鼠停留在斜板上维持至少5 s时的最大角度,每次测试3遍,取平均值。采用双人盲法。
1.5 血清中丙二醛和超氧化物歧化酶
测定行为学测试完成后,大鼠经右心室取血3 m l,3000 r/m in离心15m in,取上清液,-20℃冰箱保存。用丙二醛(methane dicarboxylic aldehyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒测定,按试剂盒说明操作。
1.6 组织取材与切片制备
每组各取8只大鼠,于运动功能评测后,1.5%戊巴比妥钠30mg/kg腹腔注射麻醉。打开胸腔,充分暴露心脏和主动脉根部。从左心室插管到主动脉根部,剪开右心耳,经左心室快速灌注肝素生理盐水约200 m l,至肝脏及巩膜苍白。4%多聚甲醛150~200m l灌注40m in。以损伤处为中心切取脊髓组织约1 cm,4%多聚甲醛固定24 h。常规脱水、透明、浸蜡、包埋,连续横切,厚5μm,用于免疫组织化学染色。
1.7 免疫组织化学染色
非生物素二步法进行GFAP和BDNF免疫组化染色。将各组切片置于二甲苯中脱蜡,梯度酒精水化,行高压热抗原修复,用3%H2O2封闭内源性过氧化物酶,正常山羊血清封闭非特异性抗原。分别滴加GFAP抗体(效价1∶500)或BDNF抗体(效价1∶20),4℃冰箱过夜。次日用兔抗鼠二抗37℃恒温孵育60 m in,在切片上加入DAB-H2O2显色液,室温下反应,显色充分,及时用0.01 mol/L PBS漂洗;苏木素复染,梯度酒精逐级脱水,二甲苯透明,树胶封片。每张切片在显微镜400倍下随机拍摄5个无重复的视野,采用Image-ProPlus6.0病理图像分析软件测定每个视野中累积光密度和其分布面积,计算平均积分光密度值(IOD)。
1.8 统计学分析
2 结果
2.1 运动功能评定
术前各组大鼠BBB评分运动功能正常,评分均为21分。术后1 d,两组评分无显著性差异(P>0.05)。术后3 d、7 d,A组评分高于B组(P<0.05)。见表1。

表1 两组大鼠BBB评分比较
术后1 d,A组与B组斜板试验角度无显著性差异(P>0.05)。术后3 d、7 d,A组角度大于B组(P<0.05)。见表2。

表2 两组大鼠斜板试验比较(°)
2.2 SOD与MDA
术后1 d、3 d、7d,A组SOD活性高于B组(P<0.05);A组MDA含量低于B组(P<0.05)。见表3、表4。
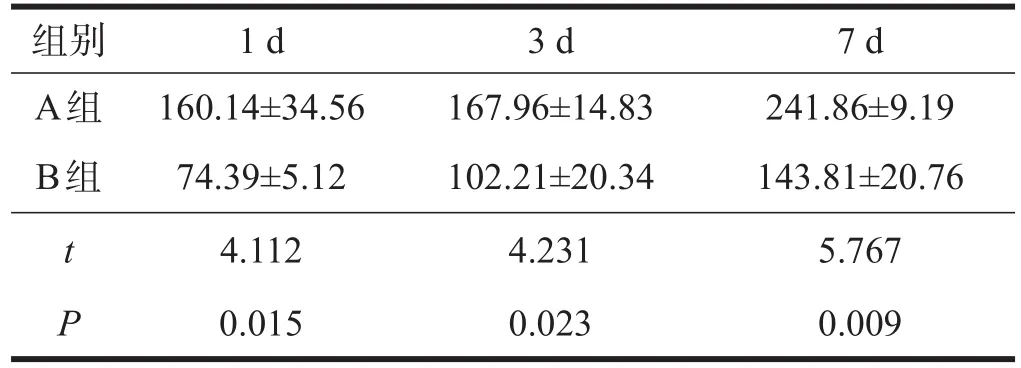
表3 两组血清SOD活性比较(U/m l)

表4 两组血清MDA含量比较(nmol/m l)
2.3 免疫组化结果
2.3.1 GFAP
GFAP主要标记星形胶质细胞。免疫组织化学GFAP染色发现损伤处星形胶质细胞呈局灶性增生,胞质丰富且染色加深,体积增大,细胞形态不一,突起增多,随着损伤后时间延长,细胞数目增多。脊髓损伤区GFAP的表达在A组比较少,分布比较均匀;在B组大部分为空洞,空洞周围有强的GFAP表达,分布相对不均匀。脊髓损伤1 d后星形胶质细胞内的GFAP表达明显增高,1~7 d内呈现进行性增高趋势。A组脊髓损伤后1 d、3 d、7 d内损伤处GFAP表达明显少于B组(P<0.01),尤其是7 d A组减少最明显。见表5、图1。

表5 两组大鼠脊髓组织GFAP比较(IOD)
2.3.2 BDNF
术后1 d、3 d、7 d,两组胞浆呈黄色染色,但染色强度不一。术后1 d两组脊髓组织中有BDNF的微弱表达,1~7 d内呈现进行性增高趋势。A组在术后1 d、3 d、7 d BDNF表达显著高于B组(P<0.001)。见表6、图2。

表6 两组大鼠脊髓组织BDNF比较(IOD)

图1 两组大鼠脊髓组织GFAP的表达(免疫组织化学染色,400×)

图2 两组大鼠脊髓组织BDNF的表达(免疫组织化学染色,400×)
3 讨论
脊髓损伤是一种严重的致残性疾病,常引起多种并发症,严重影响患者的身心健康和生存质量,甚至危及生命。脊髓损伤后运动功能的缺失及恢复程度不仅与脊髓组织遭受机械性外力所致的原发损伤有关,还与原发性损伤引起的一系列病理生理反应所致的继发性损伤有关。后者常是进行性、自毁性的破坏过程,对组织的破坏程度远远超过原发性损伤。故临床治疗的关键是尽量预防和治疗继发性损伤,从而降低病死率和神经功能的丧失,促进功能恢复。
原花青素是一类在植物界中广泛存在的多酚化合物,它主要存在于植物的果实、种子、花和皮中,具有极强的抗氧化、消除自由基的作用,可有效消除超氧阴离子自由基和羟基自由基,也参与磷酸、花生四烯酸的代谢和蛋白质磷酸化,保护脂质不发生过氧化损伤[8-10]。国内研究发现,原花青素能有效抑制脊髓损伤后脂质过氧化和清除体内过多的自由基[11],抑制NF-кB、IL-6、TNF-α的表达[12-13],有效控制脊髓损伤后的炎症反应,进而促进大鼠运动功能的恢复。国外有文献报道,花青素可以增强神经系统的稳定性,减少缺血-再灌注所造成的脑损伤[14],对局灶性脑缺血大鼠大脑皮质抑凋亡基因蛋白Bcl-2和促凋亡基因蛋白Bax的表达有十分重要的影响[15]。
本研究发现,脊髓损伤术后1~7 d A组和B组的运动功能均表现出一致的增长趋势。与B组相比,术后3 d、7 d,A组大鼠BBB评分和斜板试验成绩均优于B组(P<0.05);术后1 d、3 d及7 d,A组大鼠血清SOD活性和MDA含量优于B组(P<0.05)。说明原花青素可有效抑制脊髓损伤后脂质过氧化反应,清除自由基,促进神经运动功能的恢复。
GFAP是星型胶质细胞的一种标志蛋白,为其主要细胞骨架成分,相对分子质量为50~52 kDa,存在于正常星形胶质细胞和反应性星形胶质细胞中,它在神经元内环境的维持和血脑屏障中起重要作用,其表达的高低可反映星形胶质细胞的功能状态,如星型胶质细胞增殖和肥大的程度[16]。当神经系统受到损伤时,星形胶质细胞发生反应性增生,出现GFAP表达上调。
脊髓损伤后胶质细胞反应性增生具有双重作用[17-18]。损伤早期,胶质细胞分泌的层粘蛋白、神经生长因子(nerve grow th factor,NGF)和BDNF等可以诱导神经纤维的生长,有利于神经元的再生[19];但是在损伤后期,由于层粘蛋白聚集成基板,释放一系列的细胞因子作用于星形胶质细胞使其多度增生形成胶质瘢痕[20],阻碍轴突的再生,也阻碍神经元的修复,成为脊髓功能恢复的关键问题之一[21]。所以抑制星形胶质细胞过度反应性增生,从而抑制胶质瘢痕的形成,将为神经元轴突再生和功能的修复提供较好的微环境。
本实验结果也提示,脊髓损伤后1~7 d内GFAP表达呈进行性增高趋势,且各时间点A组与B组有显著性差异(P<0.05),提示原花青素能抑制GFAP的表达,抑制星形胶质细胞过度反应性增生,从而可能创造有利于神经再生的微环境,减少胶质瘢痕的形成。
BDNF是神经营养因子家族中的一个重要因子,在中枢和周围神经系统中均具有广泛作用[22],它参与中枢神经系统发育过程中神经细胞的生存、分化与生长,同时还能够维持神经细胞的正常生理功能。在成年大鼠脊髓腹角运动神经元中亦含有BDNF,产物表达主要定位于胞浆中,细胞核不着色。有研究发现,BDNF可减轻损伤脊髓的炎症,保护损伤的神经细胞,减少细胞的凋亡数量,促进轴突大量再生[23-24]。BDNF除具有诱导神经突起定向生长、决定感觉和交感神经纤维生长方向等神经营养因子所具有的效应外,还具有运动神经营养活性,能保护脊髓运动神经元在脊髓损伤后免于死亡[25]。本实验发现,BDNF表达在脊髓损伤后1~7 d逐渐持续增加,各时间点两组均有显著性差异(P<0.05),表明在急性脊髓损伤后早期,原花青素的应用可以促进BDNF表达,减轻神经细胞病理变化,发挥神经保护作用。
综上所述,原花青素在脊髓损伤修复中既能在脊髓损伤后抑制GFAP的表达,又能明显促进损伤区BDNF的表达,从而减少受伤脊髓中神经胶质细胞的增生和胶质瘢痕的形成,促进轴突再生,促进脊髓损伤后运动功能的恢复。本实验为原花青素在脊髓损伤修复中的临床应用提供理论依据。
[1]DumontRJ,Okonkwo DO,Verma S,etal.Acute spinal cord injury,part1:pathophysiologicmechanisms[J].Clin Neuropharmaeology,2001,24(5):254-264.
[2]Asha Devi S,Sagar Chandrasekar BK,Manjula KR,et al. Grape seed proanthocyanidin lowers brain oxidative stress in adult and m iddle-aged rats[J].Exp Gerontol,2011,46(11): 958-964.
[3]Mansouri E,Panahi M,Ghaffari MA,et al.Effects of grapeseed proanthocyanidin extract on oxidative stress induced by diabetes in ratkidney[J].Iran Biomed J,2011,15(3):100-106.
[4]Markandaya M,Stein DM,Menaker J.Acute treatmentoptions for spinal cord injury[J].Curr TreatOptionsNeurol,2012,1:3.
[5]Ahn SH,Kim HJ,Jeong I,et al.Grape seed proanthocyanidin extract inhibits glutamate-induced cell death through inhibition of calcium signals and nitric oxide formation in cultured rat hippocampalneurons[J].BMCNeurosci,2011,12:78.
[6]Basso DM,Beattie MS,Bresnahan JC,et al.MASCIS evaluation of open field locomotor scores:effects of experience and teamwork on reliability.Multicenter Animal Spinal Cord Injury Study[J].JNeurotrauma,1996,13(7):343-359.
[7]Rivlin AS,Tator CH.Objective clinical assessment of motor function after experimental spinal cord injury in rat[J].JNeurosurg,1977,47(4):577-581.
[8]Bagchi D,Garg A,Krohn RL,et al.Oxygen free radical scavenging abilitiesof vitam ins C and E,and a grape seed proanthocyanidin extract in vitro[J].Res Commun Mol Pathol Pharmacol,1997,95(2):179-189.
[9]Bagchi D,BagchiM,Stohs SJ,et al.Free radicals and grape seed proanthocyanidin extract:importance in human health and disease prevention[J].Toxicology,2000,148(2-3):187-197.
[10]Pataki T,Bak I,Kovacs P,et al.Grape seed proanthocyanidins improved cardiac recovery during reperfusion after ischem ia in isolated rat hearts[J].Am JClin Nutr,2002,75(5): 894-899.
[11]谢少华,杨拯,龚都,等.原花青素对脊髓损伤大鼠运动功能的影响[J].中国康复理论与实践,2012,18(9):831-833.
[12]马延仃,谢少华,杨拯,等.原花青素对急性脊髓损伤大鼠核因子-кB和白细胞介素-6表达的影响[J].中国康复理论与实践,2014,20(8):713-717.
[13]宋佳,齐慧慧,贾连顺.原花青素对大鼠急性脊髓损伤的保护作用及机制研究[J].中国矫形外科杂志,2013,21(8): 794-798.
[14]Sato M,BagchiD,TosakiA,etal.Grape seed proanthocyanidin reduces cardiomyocyteapoptosisby inhibiting ischemia/reperfusion-induced activation of JNK-1 and c-Jun[J].Free Radic BiolMed,2001,31(6):729-737.
[15]Gujral JS,Bucci TJ,Farhood A,et al.Mechanism of cell death during warm hepatic ischem ia-reperfusion in rats:apoptosisorornecrosis?[J].Hepatology,2001,33(2):397-405.
[16]Bigini P,Bastone A,Mennini T.Glutamate transporters in the spinal cord if the wobblermouse[J].JNeuroreport,2001,12 (9):1815-1825.
[17]Silver J,M iller JH.Regeneration beyond the glial scar[J]. NatRev Neurosci,2004,5(2):146-156.
[18]Yiu G,He Z.Glial inhibition of CNS axon regeneration[J]. NatRev Neurosci,2006,7(8):617-627.
[19]Ozawa H,Wu ZJ,Tanaka Y,etal.Morphologic changeand astrocyte response to unilateral spinal cord compression in rabbits[J].JNeurotrauma,2004,21(7):944-955.
[20]Sofroniew MV.Molecular dissection of reactive astrogliosis and glial scar formation[J].Trends Neurosci,2009,32(12): 638-647.
[21]Pan HC,Cheng FC,Lai SZ,et al.Enhanced regeneration in spinal cord injury by concomitant treatment with granulocyte colony-stimulating factor and neuronal stem cells[J].JClin-Neurosci,2008,15(6):656-664.
[22]Srivastava DP,Woolfrey KM,Evans PD.Mechanisms underlying the interactions between rapid estrogenic and BDNF control of synaptic connectivity[J].Neuroscience,2013,239: 17-33.
[23]Lu P,Jones LL,Tuszynski MH.BDNF-expressing marrow stromal cells supportextensive axonal grow th at sites of spinal cord injury[J].Exp Neurol,2005,191(2):344-360.
[24]岳峰,蔡艳华,叶超群.神经营养因子与脊髓损伤[J].中国康复医学杂志,2010,25(9):917-920.
[25]Kim DH,Jahng TA.Continuous brain-derived neurotrophic factor(BDNF)infusion after methylprednisolone treatment in severe spinal cord injury[J].Korean Medsci,2004,19(1): 113-122.
Effect of Proanthocyanidin on Expression of Glial Fibrillary Acidic Protein and Brain-derived Neurotrophic Factor in Ratsafter SpinalCord Injury
CHENChun-mei
Chongqing Three GorgesMedicalCollege,Chongqing 404120,China
Objective To observe the effect of proanthocyanidin on the expression of brain-derived neurotrophic factor(GFAP)and brain-derived neurotrophic factor(BDNF)in ratswith spinal cord injury(SCI).Methods 48 healthy adult Sprague-Daw ley ratswere random ly divided into proanthocyanidin treatmentgroup(group A,n=24)and controlgroup(group B,n=24).A llen'smethod was used to establish themodel of acute spinal cord injury in T9.1,3 and 7 days after operation,8 rats in each subgroup were assessed with Basso-Beattie-Bresnahan(BBB)scale and Slanting Board Test,the serum malondialdehyde(MDA)and superoxide dismutase(SOD)were detected, and the expression of GFAPand BDNF of the spinal cord were detected with immunohistochem istry.Results The results of BBB scale and Slanting Board Testwere better in group A than in group B 3 and 7 days after SCI(P<0.05).The levels of SOD and MDA were better in group A than in group B 1,3 and 7 days after SCI(P<0.05).The expression of GFAPwas lower,and the expression of BDNFwas higher in group A than in group B all the time points after SCI(P<0.01).Conclusion Proanthocyanidin can inhibit the lipid peroxidation and the expression of GFAPin spinal cord after SCI,stimulate the synthesisof endogenous BDNF,and improve themotor function in ratsafter SCI.
spinalcord injury;proanthocyanidin;glial fibrillary acidic protein;nerve grow th factor;rats
10.3969/j.issn.1006-9771.2015.08.003
R651.2
A
1006-9771(2015)08-0883-06
2015-06-03
2015-07-07)
重庆三峡医药高等专科学校,重庆市404120。作者简介:陈春梅(1976-),女,汉族,四川岳池县人,讲师,主要从事中医治疗方面研究。

