MassARRAY质谱分析肺癌多基因突变方法的建立与应用*
田红霞 张绪超 王震 陈剑光 陈世良 郭伟浜 杨素清 吴一龙
·临床研究与应用·
MassARRAY质谱分析肺癌多基因突变方法的建立与应用*
田红霞 张绪超 王震 陈剑光 陈世良 郭伟浜 杨素清 吴一龙
目的:以MassARRAY质谱iPLEX分析技术为平台建立适合中国肺癌人群多基因同步检测的方法。方法:通过文献检索并结合国内外研究进展,确定与中国肺癌人群发病、耐药以及转移等密切相关的13个靶基因或相关传导通路基因(EGFR、KRAS、ALK、FGFR1、FGFR2、FGFR3、PIK3CA、BRAF、PTEN、MET、ERBB2、AKT1、STK11)。对目的基因突变进行筛选并确定99个热点突变。按MassARRAY突变位点标示方法和引物设计固定格式,引物设计软件在线设计297条引物(正、反向扩增引物和延伸引物各99条)。以8个肺癌细胞系以及6例肿瘤组织样本建立检测方法,与LungCarta试剂盒对比验证。扩大检测100例肺癌组织样本,与EGFR和KRAS直接测序法比较敏感度与特异度。结果:使用本方法检测肺癌细胞系的基因突变,其中1例肺癌组织新检测到FGFR2基因突变,其他结果与LungCarta试剂盒一致。与直接测序法相比较灵敏度为100%,特异度为96.3%。结论:成功建立MassARRAY质谱分析肺癌多基因突变检测方法,适合中国肺癌人群且具有临床应用前景。
肺癌 驱动基因 突变 多基因检测 MassARRAY
肺癌是我国恶性肿瘤死亡原因之首,发病率持续上升,基于基因变异的“精准治疗”是继传统放化疗后肿瘤领域的新突破。非小细胞肺癌(no-small cell lung cancer,NSCLC)样本中基因靶点变异可从相应的靶向药物治疗中获益,针对EGFR和ALK基因突变的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)吉非替尼/厄洛替尼和克唑替尼等靶向治疗可延长患者的生存期[1-2]。随着研究深入,不断有新的突变被报道,而且大部分患者接受TKI治疗后会因继发突变而导致耐药,肿瘤靶点分子分型的复杂性决定了开展同步多基因检测的必要性。
基于MassARRAY平台的iPLEX技术利用单碱基延伸技术和基质辅助激光解吸附电离飞行时间质谱技术,可以实现多重扩增反应基因型检测。主要特点为进行单管多重PCR,在PCR扩增产物中加入序列特异延伸引物,延伸引物设计位于突变位点前一个碱基,在突变位点处可延伸一个碱基。飞行时间质谱检测经激光解离的离子,可区分延伸碱基的分子量,从而判断目的基因是否突变。该技术分型结果准确,实验设计灵活,是多基因平行检测的理想平台。目前LungCarta试剂盒[3-4]可检测26个癌症相关基因的214个突变位点,但技术信息保密,价格昂贵,且未完全包括前沿分子靶点,也未考虑东亚和欧美地区驱动基因谱的差异性[5],因此建立适合中国人群的多基因检测方法具有重要意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 2014年1月至2014年12月106份肺癌患者肿瘤组织样本来源于广东省人民医院肺癌研究所,样本收集已获得患者知情同意,并获广东省人民医院伦理委员会审查批准(粤医科伦理2013185H号)。均为手术切除肿瘤组织或肺穿刺标本,手术切除后液氮速冻,然后-80℃冰箱保存,经病理评估含有50%以上的肿瘤细胞;8个肺癌细胞系H460、PC9、H1650、H1975、A549、GLC82、L78、HCC827购买于中国科学院上海细胞库。
1.1.2 主要试剂与仪器 QIAsymphony DNA Mini Kit(德国Qiagen公司);LungCarta kit、PCR辅助set、iPLEX Pro Reagent Kit(美国Agena公司);去离子水(美国Sigma公司)。QIAsymphony SP高通量全自动核酸提取纯化仪(德国Qiagen公司);质谱分析仪和点样仪(美国Agena公司);3730测序仪和PCR仪(美国ABI公司)。
1.2 方法
1.2.1 多基因检测引物试剂盒的制备 1)确定肺癌相关驱动基因或靶向耐药基因。通过检索Pubmed数据库,结合国内外研究进展和中国人群肺癌基因谱特点,统计与中国人群肺癌发病机理、化放疗、靶向耐药以及转移等相关的靶基因或其相关传导通路基因,确定13个基因纳入分析:EGFR、KRAS、ALK、FG⁃FR1、FGFR2、FGFR3、PIK3CA、BRAF、PTEN、MET、ERBB2、AKT1和STK11。2)筛选目的基因的热点突变位点。在Cosmic数据库中确定上述13个基因的Cosmic基因号分别为EGFR(ENST00000275493)、KRAS(ENST00000256078)、ALK(ENST00000389048)、FGFR1(ENST00000447712)、FGFR2(ENST0000035 8487)、FGFR3(ENST00000440486)、PIK3CA(ENST0 0000263967)、BRAF(ENST00000288602)、PTEN(ENST 00000371953)、MET(ENST00000318493)、ERBB2(ENS T00000269571)、AKT1(ENST00000349310)、STK11(E NST00000326873)。查询上述基因在肺癌中的变异情况,确定99个与肺癌驱动及耐药相关的热点突变位点(表1)。3)引物设计文档编辑和软件设计。GenBank确定基因组序列,基因序列号分别为EGFR(NG_ 007726.3)、KRAS(NG_007524.2)、ALK(NG_009445.1)、FGFR1(NG_007729)、FGFR2(NG_012449.1)、FGFR3(NG_012632.1)、PIK3C(NG_012113.2)、BRAF(NG_ 007873.3)、PTEN(NG_007466.2)、MET(NG_008996.1)、ERBB2(NG_007503.1)、AKT1(NG_012188.1)、STK11(NG_007460.2)。根据Cosmic数据库中突变位点在编码序列的位置,在基因组序列中标记突变位点,将侧翼约200个碱基按Agena公司突变位点标示和固定格式编辑引物设计文档。通过公司网站引物设计软件运行上述含突变位点序列的文档,调整相关参数将13个基因99个位点全部纳入设计试剂盒,正、反向扩增引物各99条和延伸引物99条,共设计297条引物。扩增目的条带,延伸引物设计位于突变位点前一个碱基,与扩增产物互补进行单碱基延伸反应。设定每孔最多检测十个突变位点,软件根据引物设计原则(避免形成二聚体/错配等)随机将99个位点的检测分布在12孔(专利申请号:201510311868.8)。4)多重引物的合成与配置。上海生工生物工程有限公司合成引物。引物配置如下:①扩增引物先稀释成10 μM,然后工作液以每条引物浓度为0.5 μM进行混合,共12管(每管包括正、反向引物)。引物名称末尾为P1-F和P1-R分为第1组,引物名称末尾为P2-F和P2-R分为第2组,类推,分为12组(P1~P12);②延伸引物先稀释成500 μM,然后在Agena公司延伸引物配置表格中输入每一条延伸引物的分子量,再根据表格计算的体积混合引物,共12管。引物名称末尾为E1为第1组,引物名称末尾为E2为第2组,类推,分为12组(E1~E12)。12管扩增引物分别对应12管延伸引物,P1对应E1,以此类推。
1.2.2 建立引物试剂盒应用方法 1)选用已知突变位点的H460、PC9、H1650、H1975、A549、GLC82、HCC827、H1299的8个肺癌细胞系和6例肺癌患者组织样本建立检测方法。以正常人基因组DNA(正常人包皮组织,已获知情同意)做为阴性对照,水为空白对照。每个样本检测需要DNA 120 ng,即10 ng/孔× 12孔。2)操作方法按照MassARRAY系统平台进行。其中LungCarta试剂盒按其说明书操作。本研发引物试剂盒的操作具体如下:①使用PCR Accessory Set进行核酸扩增。按QIAsymphony DNA Mini Kit试剂盒操作指南在QIAsymphony SP高通量全自动核酸提取纯化仪提取NSCLC标本的DNA,并进行核酸浓度定量。PCR扩增体系为:PCR缓冲液(10×)0.5 μL、MgCl2(25 mM)0.4 μL、dNTPs(25 mM)0.1 μL、PCR热启动酶(5 U/μL)0.2 μL、扩增引物(P1~P12)混合液1 μL、基因组DNA(10 ng/μL)1 μL,水补足至5 μL。反应条件为:94℃2min;94℃30s、56℃30s、72℃1min,45个循环;72℃5 min。②虾碱性磷酸酶(shrimp alka⁃line phosphatase,SAP)去除PCR产物中dNTP。在步骤①PCR产物中加入SAP(1.7 U/μL)0.3 μL、SAP缓冲液(10×)0.17 μL、水补足至7 μL。反应条件为:37℃40 min,85℃5 min。3)使用iPLEX Pro Reagent Kit进行延伸反应。在步骤②得到的产物中加入Type⁃plex缓冲液(10×)0.2 μL、Typeplex termination混合液(10×)0.2 μL、Typeplex thermosequenase酶(33 U/μL) 0.041 μL、延伸引物(E1~E12)混合液0.804 μL、水补足至9 μL。反应条件为:94℃30 s;[94℃5 s、(52℃5 s、80℃5 s)5个循环]35个循环;72℃3 min。4)在步骤③产物中加入水41 μL,清洁树脂15 mg(96孔板),旋转板30~60 min进行脱盐去离子防干扰处理;3 200×g离心5 min。5)MassARRAY系统点样仪对步骤④上清的延伸产物进行芯片点样,利用分析仪扫描芯片;扫描结果以Typer4.0软件分析。根据突变位点处碱基分子量不同,时间飞行质谱扫描区分各目的基因的突变状况,在质谱峰突变碱基处出现峰,则判断为突变。
1.2.3 敏感度与特异度比较 选取100例肺癌组织样本,用本肺癌研究所已经建立的直接测序法检测EGFR、KRAS基因的本研究方法包含的突变位点,与本研究方法检测结果比较敏感度与特异度,直接测序法按ABI 3730测序仪标准操作流程进行[6]。
2 结果
2.1 多基因引物试剂盒包含的突变位点
与肺癌驱动发生以及靶向治疗耐药等相关的13个基因的99个碱基突变位点纳入到多基因检测试剂盒进行引物设计,具体分析基因的蛋白突变位点见表1。
2.2 在肺癌细胞系中进行验证
建立方法检测8例肺癌细胞系的突变位点,验证结果显示与已报道的突变情况(美国标准菌种收藏所细胞系)一致,具体基因的突变蛋白与碱基位点结果见表2。阴性对照以及空白对照均没有检测到基因突变。

表1 发明试剂盒包含的13个基因的蛋白变异位点Table 1 Protein mutation locus of 13 genes in the proposed kit

表2 在肺癌细胞系验证检测结果Table 2 Validation of the established method by using cell lines
2.3 在肺癌患者组织样本中与LungCarta法比较检测结果
建立方法检测6例肺癌组织样本,与LungCarta试剂盒检测结果比较如表3。使用本法在1例肺癌患者组织样本(K1747T)中检测到FGFR2基因突变,而使用LungCarta试剂盒检测未发现该位点突变(图1)。在其他组织样本中与LungCarta试剂盒检测结果完全一致(图2)。
2.4 与直接测序法比较灵敏度与特异度
按新建立方法检测100例肺癌患者的肿瘤样本,同时直接测序法检测本研究方法包含的EGFR、KRAS基因的突变位点,本方法的灵敏度为100%,特异度为96.3%,阳性预测值为95.8%,阴性预测值为100%。具体的对比结果见表4。

表3 在肺癌组织样本中比较新建立方法与LungCarta试剂盒的检测结果Table 3 Validation of the proposed method by comparing with a Lung⁃Carta kit with lung cancer tissue samples
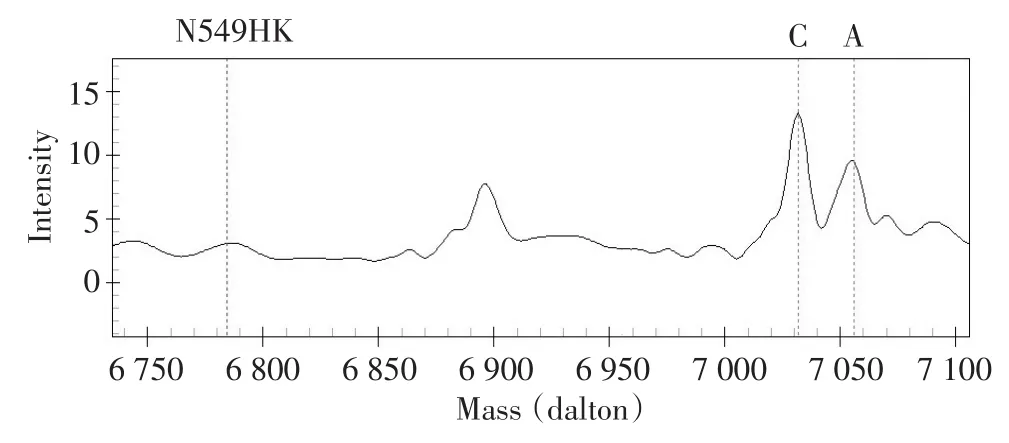
图1 新建立方法在K1747T肺癌组织样本中检测到FGFR2基因突变Figure 1 FGFR2 gene mutation was detected in the K1747T lung cancer tissue sample by using the proposed method
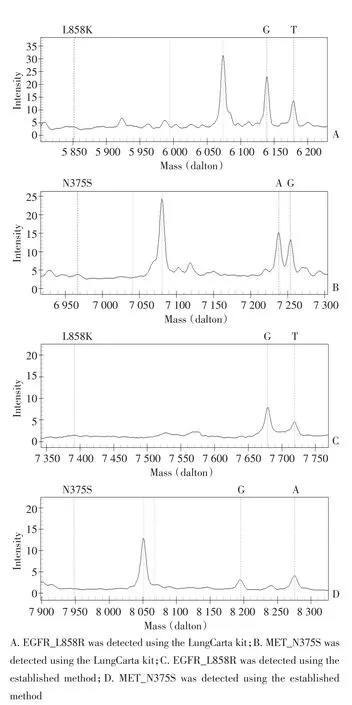
图2 新建立方法和LungCarta均在K1736T肺癌组织样本检测到共存EGFR_L858R、MET_N375S突变Figure 2 Coexistence of EGFR_L858R and MET_N375S in the K1736T lung cancer tissue sample was detected by using the proposed method and the LungCarta kit
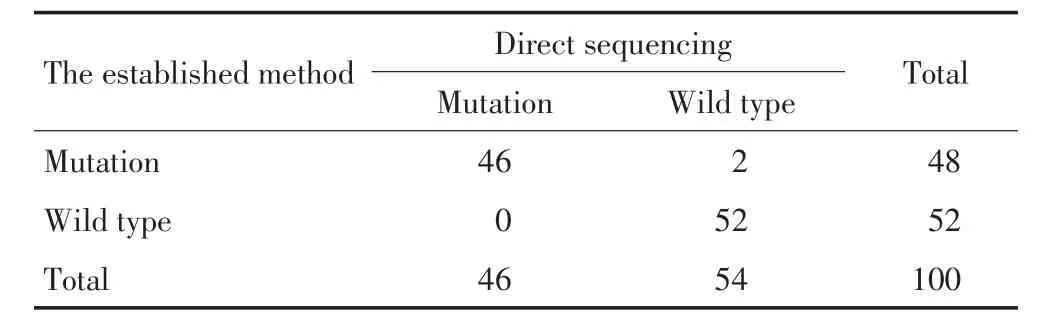
表4 新建立方法的灵敏度与特异度分析Table 4 Sensitivity and specificity analyses of the proposed method
3 讨论
在肺癌的分子分型方面,目前临床单基因检测方法主要有定量聚合酶链反应(quantitative poly⁃merase chain reaction,qPCR)、直接测序、荧光原位杂交(fluorescence in situ hybridization,FISH)、免疫组织化学(immunohistochemistry,IHC)等。除了EGFR、ALK、KRAS等主要基因的检测技术在临床相对成熟之外,ROS1、RET、MET、HER2、NRTK、NRG等基因临床检测主要限制因素有:多个单基因分次检测的复杂性和临床来源标本总量不够。临床上肺癌早期患者接受手术(大手术或小手术活检)具有充足的组织,晚期患者通常通过经皮肺穿刺、支气管镜活检、支气管内超声穿刺活检等获得少量标本。这些标本满足现有的临床病理诊断和个别基因的分子检测后,很难有剩余材料进一步用于其他重要分子分型、药物耐药机制等分析。可见肿瘤样本少、低通量、耗时性及价格昂贵等是制约临床多次单个基因检测开展的瓶颈。肿瘤发生发展、靶向耐药、复发转移的复杂性,以及肺癌多靶点突变分别检测的局限性,决定了在临床转化医学研究中开展多基因检测的发展趋势。
基于二代测序平台的高通量测序是目前生命科学领域最重要的“精准治疗”依托技术之一,NSCLC个体化分型的CAPP-CA(CAner personalized profiling by deep sequencing)、Snapshot等多基因检测技术亦已研发建立[7-8]。MassARRAY技术通过扩增延伸反应与质谱相结合实现基因的分型检测。本平台操作程序简单,可基于96/384孔板开展多基因检测,改变传统单基因检测价格昂贵,耗时长,操作繁琐等劣势。本平台PCR反应产物片段短,不仅可检测新鲜组织样本,还可检测石蜡组织、胸水、穿刺等样本[3-4]。LungCarta试剂盒检测肺癌基因突变虽然已经商品化应用[9],但技术信息保密,价格昂贵,且未完全包括前沿分子靶点,并且东亚和欧美地区驱动基因谱具有差异性。本方法根据国内外研究进展,纳入ALK、MET、FGFR等13个中国人群肺癌相关基因的99个热点突变,如原发MET基因突变与EGFR TKI的靶向治疗耐药相关[10-11]、ALK基因的多个位点突变与Crizontinb靶向治疗耐药相关[12]。目前研究发现多种肿瘤中存在FGFR信号通路的异常激活[13-14],本研究在1例肺癌患者组织样本中检测到FGFR2基因存在突变,表明多基因平行检测方法具有前沿优势,可为临床患者提供更准确的基因变异信息。同时由于质谱分析准确性与敏感性高,较直接测序法具有无可比拟的优势[15]。本研究中基于质谱平台建立的多基因检测方法与直接测序法比较,特异度为96.3%,可能与质谱的高敏感性相关,可弥补直接测序法低敏感度导致的假阴性。
建立的肺癌多基因检测方法具有如下独特优势:1)考虑了欧美人群与亚洲人群肺癌基因谱的差异性,检测基因更前沿,并纳入了多个与肺癌靶向治疗相关的耐药位点,检测结果将为优化“精准治疗”分子分型,筛查技术方案以及靶向治疗后耐药研究提供依据。2)本引物试剂盒自主研发,在价格上存在优势,降低了患者的临床检测费用,可转化研究应用于临床,产生经济效益和优化临床资源配置。3)本检测方法以96或384孔板多重反应分析为基础,具有高通量性,在12孔同步检测13个基因的99个位点,可实现“单个小样本多基因的检测”,使小样本最大化使用、获得最大信息量。本检测方法的成功建立可使肺癌生物标志物检测的医疗成本合理化,具有广阔的临床应用前景。
[1] Mok TS,Wu YL,Thongprasert S,et al.Gefitinib or carboplatinpaclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009, 361(10):947-957.
[2] Soda M,Choi YL,Enomoto M,et al.Identification of the trans⁃forming EML4-ALK fusion gene in non-small-cell lung cancer [J].Nature,2007,448(7153):561-566.
[3] Okamoto I,Sakai K,Morita S,et al.Multiplex genomic profiling of non-small cell lung cancers from the LETS phaseⅢtrial of first-line S-1/carboplatin versus paclitaxel/carboplatin:results of a West Japan Oncology Group study[J].Oncotarget,2014,5(8): 2293-2304.
[4] Quinn AM,Hickson N,Adaway M,et al.Diagnostic mutation profiling and validation of non small cell lung cancer small biopsy samples using a high throughput platform[J].J Thorac Oncol, 2015,10(5):784-792.
[5] Wu YL,Zhong WZ,Li LY,et al.Epidermal growth factor recep⁃tor mutations and their correlation with gefitinib therapy in pa⁃tients with non-small cell lung cancer:a meta-analysis based on updated individual patient data from six medical centers in main⁃land China[J].J Thorac Oncol,2007,2(5):430-439.
[6] Zhou Q,Zhang XC,Chen ZH,et al.Relative Abundance of EG⁃FR Mutations Predicts Benefit From Gefitinib Treatment for Ad⁃vanced Non-Small-Cell Lung Cancer[J].J Clin Oncol,2011,29 (24):3316-3321.
[7] Newman AM,Bratman SV,To J,et al.An ultrasensitive methodfor quantitating circulating tumor DNA with broad patient cover⁃age[J].Nat Med,2014,20(5):548-554.
[8] Su J,Zhang XC,An SJ,et al.Detecting the spectrum of multi⁃gene mutations in non-small cell lung cancer by Snapshot assay [J].Chin J Cancer,2014,33(7):346-350.
[9] Wen YS,Cai L,Zhang XW,et al.Concurrent oncogene muta⁃tion profile in Chinese patients with stage Ib lung adenocarcinoma [J].Medicine(Baltimore),2014,93(29):e296.
[10]Krishnaswamy S,Kanteti R,Duke-Cohan JS,et al.Ethnic differ⁃ences and functional analysis of MET mutations in lung cancer [J].Clin Cancer Res,2009,15(18):5714-5723.
[11]Shieh JM,Tang YA,Yang TH,et al.Lack of association of CMet-N375S sequence variant with lung cancer susceptibility and prognosis[J].Int J Med Sci,2013,10(8):988-994.
[12]Choi YL,Soda M,Yamashita Y,et al.EML4-ALK mutations in lung cancer that confer resistance to ALK inhibitors[J].N Engl J Med,2010,363(18):1734-1739.
[13]Tchaicha JH,Akbay EA,Altabef A,et al.Kinase domain activa⁃tion of FGFR2 yields high-grade lung adenocarcinoma sensitive to a Pan-FGFR inhibitor in a mouse model of NSCLC[J].Can⁃cer Res,2014,74(17):4676-4684.
[14]Liao RG,Jung J,Tchaicha J,et al.Inhibitor-sensitive FGFR2 and FGFR3 mutations in lung squamous cell carcinoma[J].Can⁃cer Res,2013,73(16):5195-5205.
[15]Ulivi P,Delmonte A,Chiadini E,et al.Gene mutation analysis in EGFR wild type NSCLC responsive to erlotinib:are there features to guide patient selection[J]?Int J Mol Sci,2014,16(1):747-757.
(2015-07-27收稿)
(2015-08-19修回)
(编辑:杨红欣)

田红霞 专业方向为肿瘤生物标志物检测。
E-mail:gghtianer@163.com
肝癌规范化诊疗国际高峰论坛会议通知
由《中国肿瘤临床》编辑部、天津医科大学肿瘤医院共同主办的“肝癌规范化诊疗国际高峰论坛”将于2015年12月19日在天津举行。会议将邀请著名肝胆外科专家复旦大学附属中山医院樊嘉教授、清华大学长庚医院董家鸿教授、天津医科大学第二医院李强教授,以及台湾高雄长庚医院陈肇隆教授、日本东京大学国土典宏教授、韩国盆唐医院韩虎生教授、香港大学潘冬平教授、国立台湾大学黄凯文教授等肝胆外科领域的顶级专家学者就肝癌规范化诊疗、高难度外科手术以及微创外科做专题报告。此次会议期间将开设手术视频,展示操作技术。
本次会议将报道肝癌规范化诊疗的最新进展,展示肝胆外科领域的高超手术技术,力争为国内外同行搭建学术交流的平台,提高我国肝癌规范化诊疗水平,欢迎各位同道拨冗参加。
会务组联系人及联系方式:
张 伟:18622025401 zhangweitjch@163.com
宋天强:022-23340123-3093 周晓颖:022-23527053-800
——本刊编辑部
Establishment and application of a MassARRAY platform-based method to detect multiplex genetic mutations in lung cancer
Hongxia TIAN,Xuchao ZHANG,Zhen WANG,Jianguang CHEN,Shiliang CHEN,Weibang GUO,Suqing YANG,Yilong WU
Medical Research Center,Guangdong Lung Cancer Institute,Guangdong People's Hospital,Guangdong Academy of Medical Science,Guangzhou 510080,China.
This work was supported by the Special Funds for the Scientific Research of Public Welfare from the National Health and Family Planning Commission of China(Grant No.201402031),the Key Lab Construction Project from Guangdong Provincial Department of Science and Technology(Grant No.2012A061400006),and the Special Program for Clinical Research from Guangdong Provincial People's Hospital(Grant No.2014zh006).
Objective:To establish a method based on the iPLEX analysis of MassARRAY mass spectrometry platform to detect multiplex genetic mutations among Chinese lung cancer patients.Methods:We reviewed the related literature and data of lung cancer treatments.We also determined 99 mutation hot spots in 13 target genes,namely,EGFR,KRAS,ALK,FGFR1,FGFR2,FGFR3,PIK3CA, BRAF,PTEN,MET,ERBB2,AKT1,and STK11,which are closely related to the pathogenesis,drug resistance,and metastasis of lung cancer and are associated with relevant transduction pathways.Atotal of 297 primers comprising 99 paired forward and reverse amplification primers and 99 matched extension primers were designed by usingAssay Design in accordance with the mutation label and format requirements of the MassARRAY platform.The detection method was established by analyzing eight cell lines and six lung cancer specimens;the proposed method was then validated through comparisons with a LungCarta kit.The sensitivity and specificity of the proposed method were evaluated by directly sequencing EGFR and KRAS genes in 100 lung cancer cases.Results:The proposed method could detect multiplex genetic mutations in the lung cancer cell lines,and this finding is consistent with that observed using previously reported methods.The proposed method could also detect such mutations in clinical lung cancer specimens;this result is also consistent with that observed by using the LungCarta kit.However,an FGFR2 mutation was detected only by using the proposed method.The measured sensitivity and specificity were 100%and 96.3%,respectively.Conclusion:The proposed MassARRAY technology-based method could detect multiplex genetic mutations among Chinese lung cancer patients.Indeed,the proposed method can be potentially applied to detect mutations in cancer cells.
lung cancer,driver gene,mutation,multi-gene testing,MassARRAY
10.3969/j.issn.1000-8179.2015.17.797
广东省人民医院(广东省医学科学院)肺癌研究所医学研究中心(广州市510080)
*本文课题受国家卫计委公益性行业科研专项项目(编号:201402031)、广东省科技厅重点实验室建设项目(编号:2012A061400006)和广东省人民医院临床研究专项项目(编号:2014zh006)资助
吴一龙 syylwu@live.cn

