GC-O-MS法分析野生刺梨汁游离态和O-糖苷键合态香气活性物质
周 志,马 琼,朱玉昌,程 超,潘思轶
(1.湖北民族学院生物科学与技术学院,生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
GC-O-MS法分析野生刺梨汁游离态和O-糖苷键合态香气活性物质
周 志1,马 琼1,朱玉昌1,程 超1,潘思轶2
(1.湖北民族学院生物科学与技术学院,生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
采用顶空-固相微萃取法提取刺梨汁中游离态挥发性物质和酶法释放刺梨汁中O-糖苷键合态挥发性物质,结合气相色谱-嗅觉探测-质谱技术,对野生种刺梨汁中游离态和O-糖苷键合态香气活性物质进行分析。结果表明,刺梨汁中游离态和O-糖苷键合态香气活性物质分别有23 种和17 种。构成刺梨汁游离态香气活性物质主要有丁酸乙酯(青草)、正己醇(酒香)、正辛醇(甜香)、异戊酸乙酯(菠萝香)、叶醇(茶香)、苯乙烯(果香)、月桂烯(甜香脂)和芳樟醇(柠檬香)等。而构成刺梨汁O-糖苷键合态香气活性物质有3-羟基己酸乙酯(水果香)、2-庚醇(柠檬香)、3-羟基丁酸乙酯(果香)、叶醇(茶香)、正辛醇(甜香)、苯乙醇(玫瑰香)和2’-羟基-4’,5’-二甲基苯乙酮(花香、甜香)等。叶醇、正辛醇和辛酸为刺梨汁中以游离态和O-糖苷键合态共存的香气活性成分。刺梨中游离态和O-糖苷键合态香气活性物质均以果香/甜香味为主,但O-糖苷键合态香气活性物质的香气总强度较游离态的弱。
刺梨;气相色谱-嗅觉探测-质谱;香气活性物质;游离态;O-糖苷键合态
一般地,香味分析的内容包括总体香味的评价和有贡献的香味活性成分的鉴定。现在食品中香气物质主要采用气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪进行分析。但GC-MS的检测限为10-12,而人鼻对香味的检测下限可达10-19[1]。GC-MS无法确定复杂的挥发性物质中哪些物质对食品香气品质起主要贡献作用,且有些香气物质含量很低,GC-MS无法检测出来,但这些含量很低的香气物质对食品的香气品质有可能起很大的贡献作用。气相色谱-嗅闻(GC-olfactory,GC-O)技术是分析和鉴定有贡献的关键香味成分的有效手段之一,最早是由Fuller等学者于1964年提出的[2]。GC-O技术是利用人的鼻子嗅闻经GC柱分离后的各个馏分,以检测供试样品气味组成的方法。目前利用GC-O技术判断单一气味组分感官贡献的方法主要有3 种[3],即时间-强度法、检测频率法和稀释法。
刺梨(Rosa roxburghii Tratt)属蔷薇科落叶植物,别名山刺梨、野石榴(陕西)、赛哇(西藏)、蜂糖果(鄂西)等[4-5],富含VC[6]、β-谷甾醇[7]、超氧化物歧化酶[8]等生理活性物质及38 种游离态香气物质和38 种键合态香气物质[9]。这些香气物质具有抗氧化活性[10]和增香的作用[11]。通过GC-MS检出的挥发性物质中仅有一小部分具有香气活性[1]。GC-O-MS技术是将质谱的分离能力和人鼻敏感的嗅觉相结合,通过对香气活性物质的气味和强度描述,来鉴定香味活性物质的一种最有效手段[12]。Guillot等[13]采用GC-O-MS分析法中的时间-强度分析法分析和评价了6 种杏子的香气成分,认为GC-MS检测出的23 种化合物中,仅有柠檬烯、乙酸己酯、乙酸乙酯等10 种物质是有香气活性的。Arena等[14]利用GC-O-MS分析法中的频率检测法分析和评价了4 种橙汁的香气活性物质,认为这4 种橙汁中的香气活性物质由果香、草香、花香、辛香和橘香这5 类香气组成。Hayata等[15]采用GCO-MS法中的稀释分析法对香瓜的风味物质进行分析和评价,认为香瓜中含有草味或黄瓜味、青味、甜味和果香味等香气活性物质。
本实验采用顶空-固相微萃取(head-space solid phase micro-extraction,HS-SPME)法提取刺梨汁中游离态挥发性物质和酶法释放刺梨汁中O-糖苷键合态挥发性物质,结合GC-O-MS技术,对野生种刺梨汁中游离态和O-糖苷键合态香气活性物质进行分析,确定野生刺梨汁中游离态和O-糖苷键合态特征香气活性物质,旨为刺梨果的精深加工和品质控制提供参考。
1 材料与方法
1.1 材料与试剂
刺梨,产于湖北省恩施土家族苗族自治州宣恩县珠山镇海拔600 m左右处野生种,采收时间为10月上旬。选择果实完整,生理成熟度一致的新鲜果实为供试材料。
C8~C22正构烷烃、β-D-葡萄糖苷酶(色谱纯)美国Sigma公司;环己酮(色谱纯) 美国Fluka公司;AmberliteXAD-2树脂 美国Supelco公司;磷酸氢二钠、甲醇、乙酸乙酯、正戊烷、氯化钠、柠檬酸(分析纯) 国药集团化学试剂有限公司;无水Na2SO4(分析纯) 天津科密欧化学试剂有限公司;乙醚(分析纯) 上海马陆制药厂。
1.2 仪器与设备
6890N/5975MSD GC-MS联用仪 美国Agilent公司;ODP2嗅闻装置 德国Gerstel公司;SPME装置(50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/ CAR/PDMS)萃取头、手动SPME进样器、20 mL顶空钳口瓶) 美国Supelco公司;R-210型旋转蒸发器 瑞士Büchi公司;SL280A型榨汁机 苏泊尔炊具有限公司;TDL-5-A型离心机 上海安亭科学仪器厂;DF-101S恒温加热磁力搅拌器 长城科工贸有限公司。
1.3 方法
1.3.1 刺梨汁中游离态挥发性物质的提取
新鲜刺梨果经挑选、洗净、切碎、榨汁,汁液过200 目滤布。称取3.6 g NaCl放于20 mL顶空瓶中(以促进挥发性物质的挥发),然后取10 mL刺梨汁液置于瓶中,再加入50 μL环己酮内标物,用聚四氟乙烯/硅橡胶隔垫立即密封,使用DVB/CAR/PDMS 50/30 μm复合萃取头萃取,在磁力搅拌器上40 ℃条件下平衡15 min,然后插入已活化好的SPME萃取头(270 ℃活化30 min)进行恒温顶空吸附30 min,缩回纤维头,随即插入GC进样口解吸5 min,进行GC-O-MS分析。
1.3.2 刺梨汁中O-糖苷键合态挥发性物质的分离释放[16]
称取50 g Amberlite XAD-2树脂,置于索氏提取器中,用甲醇、乙酸乙酯和戊烷依次回流处理10 h后浸渍于甲醇中,以甲醇为溶剂进行湿法装柱,然后用500 mL蒸馏水以10 mL/min流速洗柱。将新鲜刺梨果原汁以3 mL/min的流速流经洗涤过的Amberlite XAD-2树脂柱(Φ 2.2 cm×50 cm),然后用300 mL的去离子水洗柱去除水溶性的酸、糖等物质。接着用300 mL乙醚-戊烷(1∶1,V/V)溶液洗柱去除游离态挥发性物质后,将吸附在树脂上的糖苷类物质用300 mL甲醇溶液洗脱,收集甲醇洗脱液,用旋转蒸发器在水浴温度32 ℃条件下浓缩至干,再用30 mL 0.06 mol/L柠檬酸-Na2HPO4缓冲液(pH 5.0)转溶后,用80 mL乙醚-戊烷溶液分3 次萃取除去可能残留的游离态挥发性物质,收集的水相液置于50 mL顶空瓶中,加入Almonds β-D-葡萄糖苷酶(2.18 U/mg)138 mg[9]后立即用聚四氟乙烯/硅橡胶隔垫密封,在40 ℃酶解48 h,启开后用80 mL乙醚-戊烷混合液分3 次萃取酶解液,有机相用无水硫酸钠干燥,N2吹扫浓缩至0.5 mL,取1 μL供GC-O-MS分析。
1.3.3 GC-MS联用仪分析条件[5]
GC条件:HP-5毛细管柱(30 m×320 μm,0.25 μm);载气为氦气;进样口温度250 ℃;升温程序:起始温度40 ℃,保持3 min,以4 ℃/min升温至220 ℃,再以10 ℃/min升温至250 ℃,保持5 min。用微量进样器进样,进样量分流比为1∶20,溶剂延迟时间为6 min。
MS条件:接口温度280 ℃;四极杆温度150 ℃;离子源温度230 ℃;离子化方式:电子电离;电子能量70 eV;质量扫描范围45~550 u。
1.3.4 挥发性成分的定性分析
挥发性成分在相同的色谱条件下分离分析后,通过标准化合物的质谱,线性保留指数(retention index,RI)和气味特征来鉴定;无标准化合物时,借助质谱检索,结合文献报道的RI[14,17-19]和气味特征来鉴定。
1.3.5 刺梨汁香气活性物质的GC-O分析[20]
正式嗅觉分析前,选择2 名女性和1 名男性进行单体嗅闻训练,以增强和丰富嗅闻员的嗅闻经验。色谱柱香气物质以1∶2的分流比分别进入MS检测器和ODP2嗅闻装置,ODP2装置的加热温度为180 ℃,尾吹气流量为60 mL/min。嗅闻时应打开加湿器以对尾吹气加湿,避免干燥气体对鼻黏膜的伤害。
本实验采用GC-O分析法中的时间-强度分析法,强度设置采用4 分计分法,即最强强度为4 分,中等强度为3 分,较弱强度为2 分,很弱强度为1 分。每位嗅闻员通过ODP2嗅闻装置配套的可控制手柄记录香气的强度和嗅闻时间,并描述气味。对同一样品作3 次平行测定,共9 份数据用于统计分析,每位嗅闻员的3 次数据中有2 次重复时才被记录有效。
2 结果与分析
2.1 刺梨汁中游离态和键合态香气活性成分分析
刺梨汁采用HS-SPME法萃取游离态挥发性组分,并通过Amberlite XAD-2型树脂吸附,β-葡萄糖苷酶酶解释放O-糖苷键合态挥发性组分,结合GC-MS联用仪和GC-O技术分离分析,所检出的游离态和O-糖苷键合态香气活性成分及其气味强度见表1,检出的刺梨汁中游离态和O-糖苷键合态香气活性成分数量统计见表2。

表1 刺梨汁中游离态和O-糖苷键合态香气活性物质Table1 Free an d O-glycosidically bound aroma active compounds in R. roxburghii juice
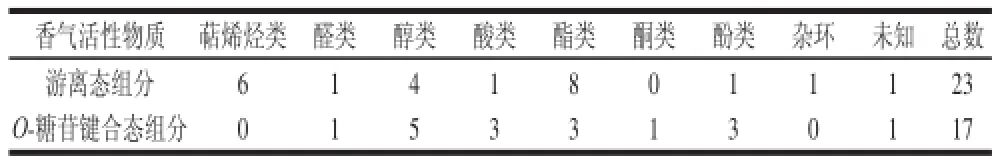
表2 刺梨汁中游离态和O-糖苷键合态香气活性成分数量Table2 Numbers of free andO-glycosidically bound aroma active components frroomm R. roxburgghhiiii juuiiccee
由表1和表2可知,检测到刺梨汁中游离态香气活性物质为23 种,包括8 种酯类物质、4 种醇类物质、6 种萜烯烃类物质、1 种酚类物质等。其中,香气强度最强的香气活性物质有丁酸乙酯(青草)、正己醇(酒香)、(+)-柠檬烯(柠檬香)和正辛醇(甜香);其次是异戊酸乙酯(菠萝味)、叶醇(茶香)、苯乙烯(果香)、月桂烯(甜香脂)、松油烯(青草、茄香)、芳樟醇(柠檬香)、3,7-二甲基-1-辛醇(玫瑰香)等;再次是正辛醛(茉莉香)、辛酸乙酯(白兰地酒香)、甲基丁香酚(茴香)、B-苯基环氧丁酸乙酯(草莓)、苯甲酸苄酯(杏仁)、四氢-4-甲基-2-(2-甲基-1-丙烯基)-2H-吡喃(甜香)和具有果香味的罗勒烯、丁酸-3-己烯酯、辛酸和未知物(序号1);香气强度较弱的香气活性物质有石竹烯(丁香味)。
Ulrich等[21]研究认为蔷薇科水果成熟草莓果实中特征香气成分含有4-甲氧基-2,5-二甲基-3(2H)-呋喃酮,而刺梨汁中游离态香气活性物质组成中不含有酮类物质,导致水果中特征香气成分差异的主要原因可能与品种、成熟度及产区因素等有关[22]。辛酸乙酯、2-甲基丁酸乙酯和正己酸乙酯等酯类物质是草莓、苹果和桃类等蔷薇科水果中重要的特征香气物质[23],而检出的刺梨汁游离态香气活性酯类物质有辛酸乙酯、丁酸乙酯、异戊酸乙酯等,这些物质常以脂肪酸为前体,通过亚油酸、亚麻酸和β-氧化途径在生物体内合成[24]。
检测到刺梨汁中O-糖苷键合态香气活性物质有17 种,在数量上约占刺梨汁中38 种O-糖苷键合态香气物质[9]的一半,包括醇类5 种、酸类、羟基酯类和酚类各3 种、羟基醛、羟基酮和未知物各1 种。其中,香气强度最强的是4-乙烯基-2-甲氧基苯酚(熟花生香)和3-羟基己酸乙酯(水果香);其次是2-庚醇(柠檬香)、3-羟基丁酸乙酯(果香)、叶醇(茶香)、正辛醇(甜香)、苯乙醇(玫瑰香)、2’-羟基-4’,5’-二甲基苯乙酮(花香、甜香)和未知物(RI=1 122);再次是苯甲醇(清香)、辛酸(果香)、橙花醇(玫瑰香)和具有甜香的丁香酚、3-羟基-4-甲氧基苯甲醛等;香气强度较弱的香气活性物质有3-甲基戊酸(草药香)和苯酚(浆糊香)。刺梨汁游离态和O-糖苷键合态香气组分中都检测到的香气活性成分有3 种,包括叶醇、正辛醇和辛酸。
2.2 刺梨汁中游离态和O-糖苷键合态香气活性物质的气味轮廓分析
将通过GC-O技术嗅闻出的各种气味分别归属为7 类,即花香、果香/甜香、脂肪/橡胶、梨香、松油、木头/树叶和药草/青味。计算归属这7 大类的香气化合物的香气总强度,得到刺梨汁中游离态和O-糖苷键合态香气活性物质的气味轮廓图(图1)。
由图1可看出,刺梨汁中游离态和O-糖苷键合态香气活性物质有气味差异。其游离态香气活性物质以果香/甜香为主,各香型的相对强度依次为果香/甜香>梨香>花香味>药草/青味>木头/树叶>松油味>脂肪/橡胶味。其O-糖苷键合态香气活性物质虽然也以果香/甜香味为主,花香次之,但是其整体香气活性物质的强度较游离态的弱,这说明刺梨汁在酶解过程中所释放的O-糖苷键合态的香气活性物质能增强刺梨汁的整体香气,但它不能代表刺梨原汁的典型风味。这与孙爱东[25]、范刚[26]等的研究结果一致。
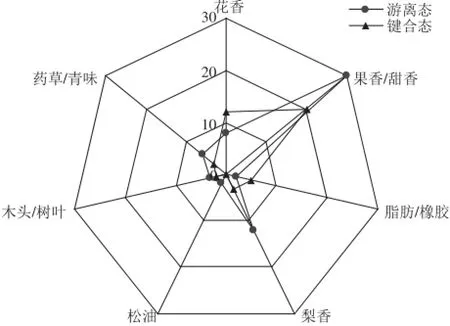
图1 刺梨汁游离态和O-糖苷键合态的气味轮廓图Fig.1 Odor profi le of free and O-glycosidically bound aroma active compounds from R. roxburghii juice
3 结 论
通过HS-SPME萃取游离态香气物质和β-葡萄糖苷酶酶解释放O-糖苷键合态香气物质,并结合GC-O-MS检测方法分析发现,刺梨汁中游离态和O-糖苷键合态香气活性物质分别有23 种和17 种。丁酸乙酯(青草)、正己醇(酒香)、正辛醇(甜香)、异戊酸乙酯(菠萝味)、叶醇(茶香)、苯乙烯(果香)、月桂烯(甜香脂)、松油烯(青草、茄香)、芳樟醇(柠檬香)、3,7-二甲基-1-辛醇(玫瑰香)、正辛醛(茉莉香)、辛酸乙酯(白兰地酒香)、甲基丁香酚(茴香)、B-苯基环氧丁酸乙酯(草莓)、苯甲酸苄酯(杏仁)、四氢-4-甲基-2-(2-甲基-1-丙烯基)-2H-吡喃(甜香)、罗勒烯、丁酸-3-己烯酯、辛酸、石竹烯(丁香味)和未知物(序号1,果香)等23 种香气物质构成了刺梨汁游离态香气的特征香气。
构成刺梨汁O-糖苷键合态香气的特征香气物质主要有4-乙烯基-2-甲氧基苯酚(熟花生香)、3-羟基己酸乙酯(水果香)、2-庚醇(柠檬香)、3-羟基丁酸乙酯(果香)、叶醇(茶香)、正辛醇(甜香)、苯乙醇(玫瑰香)、2’-羟基-4’,5’-二甲基苯乙酮(花香、甜香)、苯甲醇(清香)、辛酸(果香)、橙花醇(玫瑰香)、丁香酚(甜香)、3-羟基-4-甲氧基苯甲醛(甜香)和未知物(RI=1 122)等17 种。
气味轮廓分析发现刺梨汁游离态和O-糖苷键合态香气均以果香/甜香味为主,酶解能增强刺梨原汁的风味,但其释放出的键合态香气物质不能代表刺梨原汁的典型风味。
[1] 谢建春. 现代香味分析技术及应用[M]. 北京: 中国标准出版社, 2008: 223-225.
[2] van RUTH S M. Methods for gas chromatography-olfactory: a review[J]. Biomolecular Engineering, 2001, 17(4/5): 121-128.
[3] PLUTOWSKA B, WARDENCKI W. Application of gas chromatography-olfactory (GC-O) in analysis and quality assessment of alcoholic beverages: a review[J]. Food Chemistry, 2008, 107(1): 449-463.
[4] 刘孟军. 中国野生果树[M]. 北京: 中国农业出版社, 1998: 217-222.
[5] 周志, 徐永霞, 胡昊, 等. 顶空固相微萃取和同时蒸馏萃取应用于GC-MS分析野生刺梨汁挥发性成分的比较研究[J]. 食品科学, 2011, 32(16): 279-282.
[6] 周春明, 杨坚, 龚正礼. 刺梨果酒的研制[J]. 酿酒, 2001, 28(6): 105-106.
[7] LIANG G Y, ALEXANDER I, PETER G. Pentacyclic taiterpenes from the fruit of Rosa sterilis[J]. Journal of Natural Products, 1989, 52(1): 162.
[8] 史肖白, 顾姻, 庄一义, 等. 刺梨超氧化物歧化酶含量分析[J]. 中国野生植物资源, 1998, 17(4): 49-52.
[9] 周志, 汪兴平, 罗祖友, 等. 野生刺梨汁中游离态和O-糖苷键合态挥发性物质的检测[J]. 食品科学, 2012, 33(14): 192-197.
[10] MILOS M, MASTELIC J, JERKOVIC I. Chemical composition and antioxidant effect of glycosidically bound volatile compounds from oregano (Origanum vulgare L. ssp. hirtum)[J]. Food Chemistry, 2000, 71(1): 79-83.
[11] 孙爱东, 葛毅强, 倪元颖, 等. 不同来源的增香酶酶解橙汁(皮)中键合态主要芳香物质的效果分析[J]. 食品与发酵工业, 2001, 27(11): 1-4.
[12] 林美丽, 许倩倩, 宋焕禄, 等. 酵母抽提物香气活性化合物的分离与鉴定[J]. 食品科学, 2013, 34(8): 259-262. doi: 10.7506/spkx1002-6630-201308056.
[13] GUILLOT S, PEVYTAVI L, BUREAU S, et al. Aroma characterization of various apricot varieties using headspace-solid phase microextraction combined with gas chromatography-mass spectrometry and gas chromatography-olfactory[J]. Food Chemisty, 2006, 96(1): 147-155.
[14] ARENA E, GUARRERA N, CAMPISI S, et al. Comparison of odour active compounds detected by gas-chromatography-olfactometry between hand-squeezed juices from different orange varieties[J]. Food Chemistry, 2006, 98(1): 59-63.
[15] HAYATA Y, SAKAMOTO T, MANEERAT C, et al. Evaluation of aroma compounds contributing to muskmelon flavor in Porapak Q extracts by aroma extract dilution analysis[J]. Journal of Agricultural and Food Chemistry, 2003, 5l(11): 3415-3418.
[16] FAN Gang, XU Yongxia, ZHANG Xiaoming, et al. Characteristics of immobilised β-glucosidase and its effect on bound volatile compounds in orange juice[J]. International Journal of Food Science and Technology, 2011, 46(11): 2312-2320.
[17] BAZEMORE R, GOODNER K, ROUSEFF R. Volatiles from unpasteurized and excessively heated orange juice analyzed with solid phase microextraction and GC-olfactometry[J]. Journal of Food Science, 1999, 64(5): 800-803.
[18] HAMM S, LESELLIER E, BLETON J, et al. Optimization of headspace solid phase microextraction for gas chromatography/ mass spectrometry analysis of widely different volatility and polarity terpenoids in olibanum[J]. Journal of Chromatograph A, 2003, 1018(1): 73-83.
[19] DHARMAWAN J, KASAPIS S, CURRAN P, et al. Characterization of volatile compounds in selected citrus fruits from Asia. PartⅠ: freshly-squeezed juice[J]. Flavour Fragrance, 2007, 22(3): 228-232.
[20] QIAO Yu, XIE Bijun, ZHANG Yan, et al. Characterization of aroma active compounds in fruit juice and peel oil of Jinchen sweet orange fruit (Citrus sinensis (L.) Osbeck) by GC/MS and GC/O[J]. Molecules, 2008, 13(6): 1333-1344.
[21] ULRICH D, HOBERG E, RAPP A, et al. Analysis of strawberry flavour discrimination of aroma types by quantification of volatile compounds[J]. European Food Research and Technology, 1997, 205(3): 218-223.
[22] 于立志, 马永昆, 张龙, 等. GC-O-MS法检测句容产区巨峰葡萄香气成分分析[J]. 食品科学, 2015, 36(8): 196-200.doi: 10.7506/ spkx1002-6630-201508036.
[23] 丁耐克. 食品风味化学[M]. 北京: 中国轻工业出版社, 1997: 197-203.
[24] 夏延斌, 迟玉杰, 朱旗. 食品风味化学[M]. 北京: 化学工业出版社, 2008: 110-117.
[25] 孙爱东, 葛毅强, 阎红, 等. 甜橙键合态芳香组分的酶(酸)解解离方法研究[J]. 食品与发酵工业, 2000, 27(3): 33-36.
[26] 范刚, 张弛, 柴倩, 等. 锦橙汁键合态香气物质酸解和酶解效果比较研究[J]. 食品科学, 2007, 28(12): 169-172.
Analysis of Free and O-Glycosidically Bound Aroma Active Compounds of Wild Rosa roxburghii Juice by GC-O-MS
ZHOU Zhi1, MA Qiong1, ZHU Yuchang1, CHENG Chao1, PAN Siyi2
(1. Key Laboratory of Biological Resources Protection and Utilization of Hubei Province, College of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China; 2. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
The free volatile compounds of wild Rosa roxburghii juice were extracted by head-space solid phase microextraction (HS-SPME) and the O-glycosidically bound volatile compounds were released by enzymatic hydrolysis for analysis by gas chromatography-olfactometry (GC-O) coupled with mass spectrometry (MS). The results showed that 23 free aroma active compounds and 17 O-glycosidically bound aroma active compounds were identified in R. roxburghii juice. The major free aroma active compounds were ethyl butyrate (grassy aroma), hexyl alcohol (winy aroma), capryl alcohol (sweet aroma), ethyl isovalerate (pineapple aroma), leaf alcohol (tea aroma), styrene (fruity aroma), β-myrcene (sweet balsam aroma), linalool (lemon aroma), etc. The major O-glycosidically bound aroma active compounds were ethyl 3-hydroxyhexanoate (fruity aroma), ethyl 3-hydroxybutyrate (fruity or grape aroma), 2-heptanol (lemon aroma), leaf alcohol (tea aroma), capryl alcohol (sweet aroma), phenylethyl alcohol (rose aroma) and 2’-hydroxy-4’,5’-dimethylacetophenone (fl ower or sweet aroma) etc. Leaf alcohol, capryl alcohol and octanoic acid were the active aroma compounds existing in both free and O-glycosidically- states in wild R. roxburghii juice. Both free volatile compounds and O-glycosidically bound volatile compounds were mainly responsible for fruity/sweet fragrance. But, the overall aroma strength of the latter was relatively weaker than that of the former.
Rosa roxburghii Tratt; gas chromatograph-olfactory-mass spectrometry (GC-O-MS); aroma active compounds; free state; O-glycosidically bound state
TS207.3
A
1002-6630(2015)22-0080-05
10.7506/spkx1002-6630-201522014
2015-06-29
国家自然科学基金地区科学基金项目(31460442);生物资源保护与利用湖北省重点实验室开放基金项目(PKLHB1307);湖北省教育厅自然科学重点项目(D20122902);湖北民族学院博士基金项目(MY2012B);湖北省林学省级重点(特色)学科项目
周志(1974—),男,教授,博士,研究方向为天然产物化学与特产资源开发。E-mail:zhouzhi77716@163.com

