响应面试验优化冻融软化-酶法制备山楂汁工艺
张春岭,刘 慧,陈大磊,刘杰超,黄纪念,焦中高*
(中国农业科学院郑州果树研究所,河南 郑州 450009)
响应面试验优化冻融软化-酶法制备山楂汁工艺
张春岭,刘 慧,陈大磊,刘杰超,黄纪念,焦中高*
(中国农业科学院郑州果树研究所,河南 郑州 450009)
为获得营养价值高、保健功能强的山楂汁,以山楂汁中的总黄酮含量为考察指标,将冻融软化与酶法浸提工艺相结合,在单因素试验的基础上,应用Box-Behnken试验设计和响应面分析法对山楂制汁工艺进行优化,并与传统山楂汁制备工艺进行比较。结果表明,冻融软化处理可显著改善山楂果实中黄酮类化合物的酶法浸提效果,有利于提高山楂果汁中黄酮类化合物的含量;各因素对冻融软化-酶法制备山楂汁中总黄酮含量的影响大小依次为酶解浸提时间、冻结时间、酶解浸提温度、加酶量,最佳工艺条件为冻结时间10 h、加酶量1.0 mL/kg、酶解浸提时间2.15 h、酶解浸提温度60 ℃,在此条件下,制备得到的山楂汁中的总黄酮含量可达到241.59 mg/100 g。
山楂;冻融;果汁;黄酮;优化;响应面
山楂是我国传统的药食两用果品之一,富含多种有机酸、黄酮类、三萜类化合物等生物活性成分,具有抗氧化、降血脂、降血压、降血糖、抗肿瘤、调节免疫等生物活性,对心脑血管疾病、癌症等的预防和治疗具有重要作用[1-4]。因此,以其为原料生产的功能性果汁、果酒、果醋、果片等产品深受消费者欢迎。孟宪军等[5]研究了不同浸汁条件对山楂原汁品质的影响,李硕等[6]研究了不同浸提方式对冻山楂果汁理化及感官品质的影响,代守鑫等[7]对山楂热浸提、酶法浸提取汁的工艺条件进行了优化,李继海等[8]研究了酶解冷榨法在山楂制汁上的应用效果,廖小军等[9]从山楂汁浸提工艺参数的优化着手对山楂浓缩汁加工工艺进行了研究,但这些有关山楂汁制备工艺的研究基本上都是以山楂汁的可溶性固形物、糖、酸含量以及感官指标为考察目标,而对于山楂果实中最重要的功能因子——黄酮类化合物却缺乏必要的研究,不能反映山楂汁的保健功能价值。
传统山楂汁浸提一般采用高温软化处理,再结合酶法、压榨等技术手段获得,对热敏性营养物质和黄酮类生物活性成分的影响较大[10-11]。冻融是一种新型制汁技术,主要是利用冻结-融化过程对组织细胞壁造成破坏[12-14],促进组织液释放和营养成分的溶出,作为一种前处理工艺已在胡萝卜汁[15]、猕猴桃汁[16]、桃金娘汁[17]、青梅汁[18]等的加工中得到了研究与应用,对于提高出汁率、保持果汁营养与保健功能成分、改善果汁感官品质等具有积极作用。本研究以山楂汁中的总黄酮含量为考察指标,将冻融软化与酶法浸提工艺相结合,在单因素试验的基础上,应用Box-Behnken试验设计和响应面分析法对山楂制汁工艺进行优化,得到一种全新的山楂冻融软化-酶法制汁工艺,以期为生产营养价值高、保健功能强的山楂加工产品提供理论依据。
1 材料与方法
1.1 材料与试剂
山楂由河南省登封市惠农山楂专业合作社提供,挑选果型大小一致、无病虫害及机械损伤、成熟度一致的果实,去核后切成5~7 mm的果片备用。经分析测定其水分含量为69.74%,总糖含量为9.13%,总酸含量为2.30%,淀粉含量为1.94%,果胶含量为2.33%,还原糖含量为7.61%。
果胶酶(55 ℃酶活力5 000 PGU/mL,适宜pH 3.0~6.0、温度30~55 ℃) 诺维信(中国)生物技术有限公司;芦丁标准品(纯度≥98%) 中国食品药品检定研究院;其他试剂均为国产分析纯。
1.2 仪器与设备
Specord 50紫外-可见分光光度计 德国Analytic Jena公司;BS214D电子天平 德国赛多利斯公司;SHA-C数显水浴恒温振荡器 江苏兴华分析仪器厂;L550台式低速大容量离心机 湖南湘仪实验室仪器开发有限公司。
1.3 方法
1.3.1 冻融软化-酶法制备山楂汁工艺单因素试验
1.3.1.1 冻结时间对山楂汁中总黄酮含量的影响
准确称取50 g新鲜山楂果片,置于-18 ℃冰箱中冷冻0、5、10、15 h,取出后置于室温条件下解冻30 min,使之完全解冻(呈淡黄色,下同),加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下酶解浸提2 h,4 000 r/min离心30 min取汁,测定山楂汁中的总黄酮含量,考察冻结时间对山楂汁中总黄酮含量的影响。
1.3.1.2 加酶量对山楂汁中总黄酮含量的影响
准确称取50 g新鲜山楂果片,置于-18 ℃冰箱中冷冻10 h,取出后置于室温条件下解冻30 min,加入150 mL蒸馏水,打浆,再分别加入0.12、0.16、0.20、0.24、0.28 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下酶解提取2 h,4 000 r/min离心30 min取汁,测定山楂汁中的总黄酮含量,考察加酶量对山楂汁中总黄酮含量的影响。
1.3.1.3 酶解浸提时间对山楂汁中总黄酮含量的影响
准确称取50 g新鲜山楂果片,置于-18 ℃冰箱中冷冻10 h,取出后置于室温条件下解冻30 min,加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下分别酶解浸提1.5、2.0、2.5、3.0 h,4 000 r/min离心30 min取汁,测定山楂汁中的总黄酮含量,考察酶解浸提时间对山楂汁中总黄酮含量的影响。
1.3.1.4 酶解浸提温度对山楂汁中总黄酮含量的影响
准确称取50 g新鲜山楂果片,置于-18 ℃冰箱中冷冻10 h,取出后置于室温条件下解冻30 min,加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,分别置于水浴恒温振荡器于45、50、55、60、65 ℃条件下酶解浸提2 h,4 000 r/min离心30 min取汁,测定山楂汁中的总黄酮含量,考察酶解浸提温度对山楂汁中总黄酮含量的影响。
1.3.2 冻融软化-酶法制备高黄酮山楂汁工艺优化
根据单因素试验结果,选择冻结时间、加酶量、酶解浸提时间、酶解浸提温度4 个因素,应用Design-Expert 8.0软件,根据Box-Behnken原理设计四因素三水平(共29 个试验点5 个中心点)的响应面试验,以制备得到山楂汁中的总黄酮含量为响应值,利用响应面分析法对冻融软化-酶法制备高黄酮山楂汁工艺进行优化[19]。试验因素与水平见表1。

表1 响应面试验因素与水平Table1 Variables and levels used in response surface design
1.3.3 不同山楂汁制备工艺比较
准确称取50 g新鲜山楂果片,分别按照以下方法制备山楂汁,测定山楂汁中的总黄酮含量,比较不同制汁工艺对山楂果汁中总黄酮含量的影响。
工艺Ⅰ:加入150 mL蒸馏水,打浆,煮沸30 min,冷却后4 000 r/min离心30 min取汁;工艺Ⅱ:加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下酶解浸提2 h,4 000 r/min离心30 min取汁;工艺Ⅲ:90 ℃水热烫3 min后取出,冷却后加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下酶解浸提2 h,4 000 r/min离心30 min取汁;工艺Ⅳ:置于-18 ℃冰箱中冷冻10 h,取出后置于室温条件下解冻30 min,加入150 mL蒸馏水,打浆,再加入0.2 mL果胶酶,置于水浴恒温振荡器于55 ℃条件下分别酶解浸提2 h,4 000 r/min离心30 min取汁;工艺Ⅴ:根据响应面优化结果,采用冻融软化-酶法制备山楂汁。
1.3.4 山楂汁中总黄酮含量的测定
参考陆永旺等[20]的方法略作改动。不同质量浓度的芦丁标准品或稀释后的样品溶液3.0 mL,依次加入5%的亚硝酸钠溶液0.5 mL、10%的硝酸铝溶液0.5 mL和4%的氢氧化钠溶液5.0 mL,显色15 m in后于510 nm波长处测定吸光度,通过芦丁标准曲线计算样品中总黄酮含量。
1.4 数据处理
每一实验重复3 次,数据用SPSS 19.0软件进行统计处理和差异显著性分析。
2 结果与分析
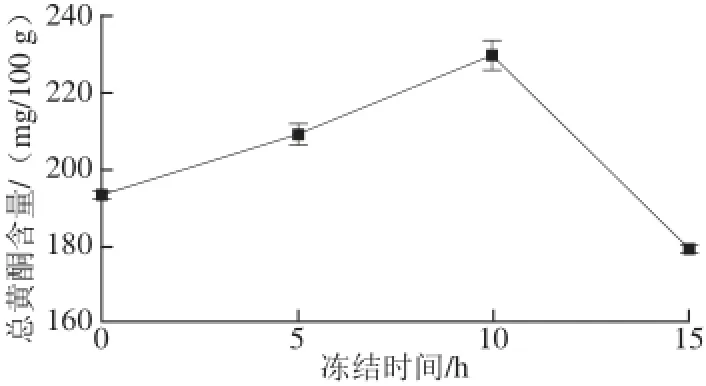
图1 冻结时间对山楂汁中总黄酮含量的影响Fig.1 Effect of freezing time on the content of fl avonoids in hawthorn fruit juice
2.1 冻融软化-酶法制备山楂汁工艺单因素试验结果2.1.1 冻结时间对山楂汁中总黄酮含量的影响由图1可见,适度冻结处理有利于山楂果实中黄酮类化合物的浸出。冻结时间过短,山楂细胞壁组织结构未得到有效破坏,影响后续的酶解浸提效果,但冻结时间过长,又会造成山楂汁中总黄酮含量的降低,可能是由于过度冻结造成了细胞膜的严重损伤[21],使山楂解冻及山楂汁浸提过程中黄酮类化合物氧化加剧,导致黄酮类化合物损失较大。在试验条件下,以山楂片在-18 ℃冻结10 h左右为宜。
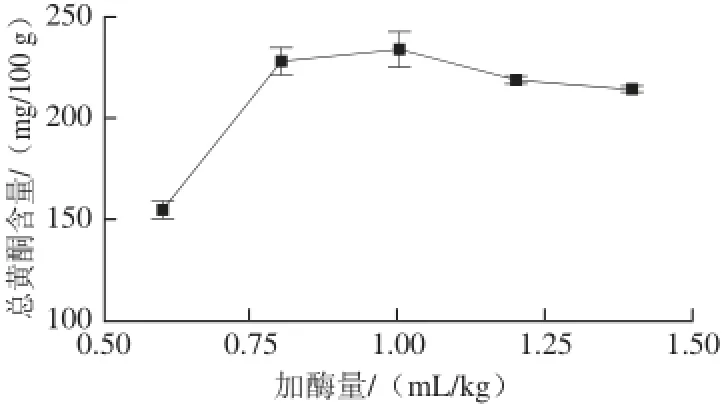
图2 加酶量对山楂汁中总黄酮含量的影响Fig.2 Effect of enzyme amount on the content of fl avonoids in hawthorn fruit juice
2.1.2 加酶量对山楂汁中总黄酮含量的影响由图2可以看出,果胶酶处理对于冻融山楂果实中黄酮类化合物的浸出具有明显的促进作用。这一方面是由于果胶酶分解细胞壁结构中的果胶物质,进一步破坏了山楂果实细胞壁结构,促进黄酮类化合物的释放与浸出[22-23],另一方面也可能是果胶酶分解了浸提液中的果胶物质,使浸提液黏度降低,从而加快黄酮类化合物的扩散和浸提。随着果胶酶用量的增加,制备得到的山楂汁中的总黄酮含量显著增加,在果胶酶添加量为0.8~1.0 mL/kg时达到最高,再进一步增加果胶酶的用量,则对山楂汁中总黄酮含量影响不明显。因此,在试验条件下,果胶酶的添加量以0.8~1.0 mL/kg为宜。
2.1.3 酶解浸提时间对山楂汁中总黄酮含量的影响
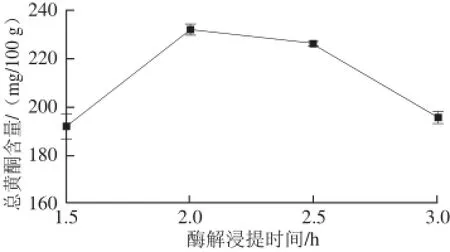
图3 酶解浸提时间对山楂汁中总黄酮含量的影响Fig.3 Effect of enzymatic extraction time on the content of fl avonoids in hawthorn fruit juice
由图3可以看出,酶解浸提时间在1.5 h,所得到的果汁中总黄酮含量较低,浸提效果较差。这一方面说明细胞壁果胶质降解可能不充分,影响黄酮类化合物的溶出[23],另一方面也可能是浸提时间不够、黄酮类化合物不能充分溶出所致。随着时间的延长,果胶质降解程度进一步加大,促进黄酮类化合物的快速溶出,同时随着浸提时间的延长,融入浸提液中的黄酮类化合物也逐渐增加,于2 h左右达到最大值,说明已基本达到了平衡,继续延长酶解浸提时间还可能增大黄酮类化合物的氧化损失[24-25],造成制备得到的山楂汁中总黄酮含量的降低。因此,在试验条件下,酶解浸提时间以2~2.5 h为宜。
2.1.4 酶解浸提温度对山楂汁中总黄酮含量的影响
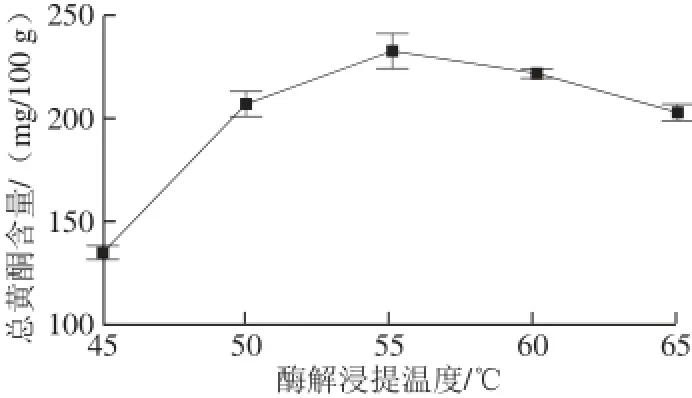
图4 酶解浸提温度对山楂汁中总黄酮含量的影响Fig.4 Effect of enzymatic extraction temperature on the content of fl avonoids in hawthorn fruit juice
由图4可以看出,在一定范围内,酶解浸提温度的升高可以促进冻融山楂果实中黄酮类化合物的溶出,制备得到的山楂果汁中总黄酮含量逐渐增加,并于酶解浸提温度为55 ℃时达到最高,进一步提高酶解浸提温度则造成山楂汁中黄酮类化合物的减少。其原因可能是温度过高不仅会加剧果胶酶的失活,同时还会对黄酮类化合物造成破坏,从而导致制备得到的山楂汁中总黄酮含量降低。
2.2 冻融软化-酶法制备山楂汁工艺的响应面试验结果
2.2.1 响应面多元回归模型的建立与分析
根据单因素试验结果,设计四因素三水平的响应面试验,试验设计方案与结果见表2。采用Design-Expert 8.0软件对试验数据进行多元回归拟合,得到山楂汁中总黄酮含量的二次回归方程为:Y=234.40+16.42A+8.80B+19.11C+15.95D+6.53AB-9.42AC-16.22AD+8.79BC-19.13BD-2.46CD-45.44A2-17.26B2-8.19C2-10.66D2。
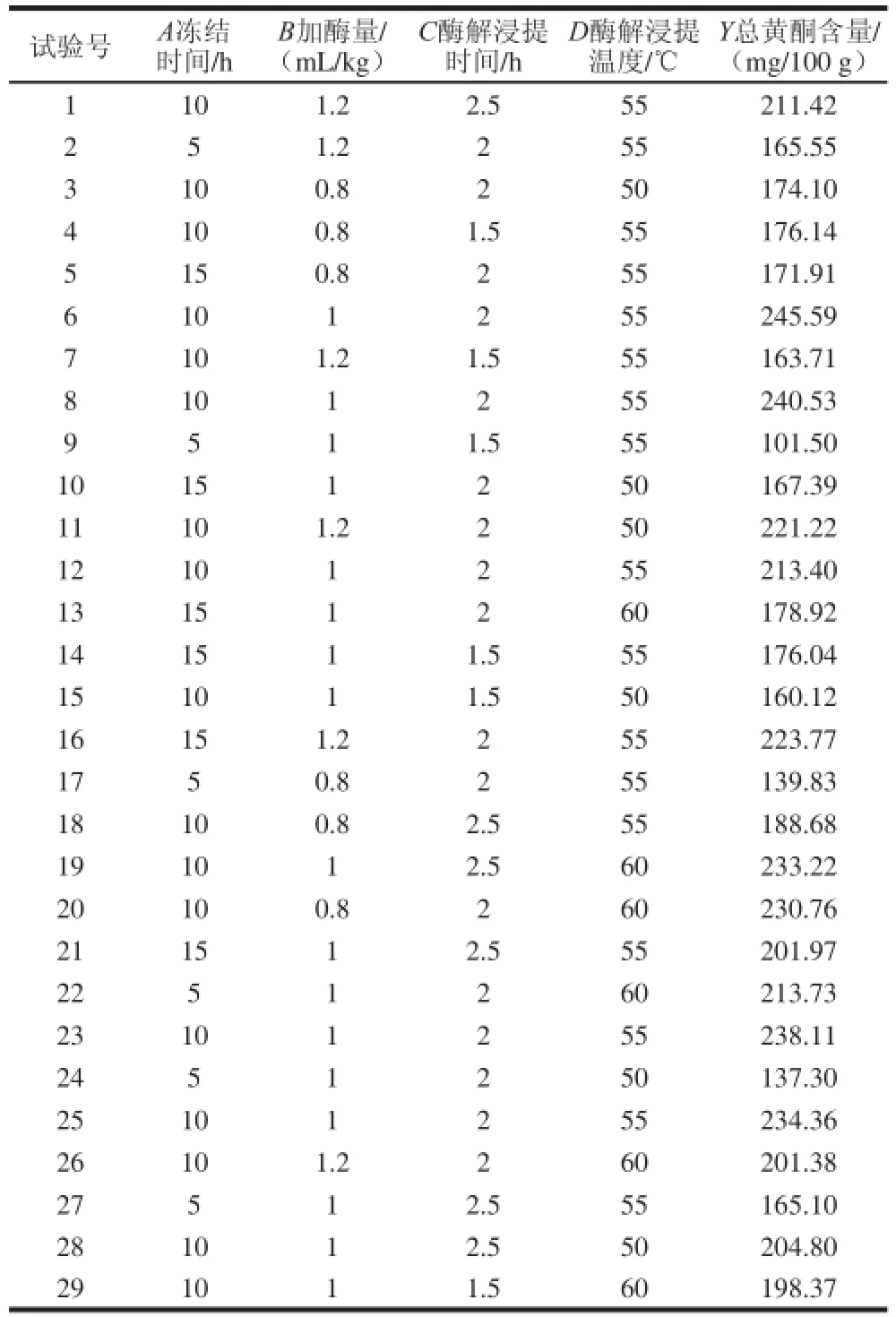
表2 响应面试验设计及结果Table2 Experimental design for response surface analysis with corresponding experimental data
由表3可知,回归模型P<0.001,达到极显著水平,而失拟项的P>0.05,不显著,说明该方程对试验拟合情况好、误差小,因此可用该回归方程代替试验真实点对试验结果进行分析和预测。冻结时间(A)、酶解浸提时间(C)、酶解浸提温度(D)的P值小于0.01,表明其对山楂汁中总黄酮含量的影响极显著,加酶量(B)的P值大于0.05,表明其对山楂汁中总黄酮含量的影响不显著。试验条件下,各因素对山楂汁中总黄酮含量的影响大小依次为:酶解浸提时间(C)>冻结时间(A)>酶解浸提温度(D)>加酶量(B)。
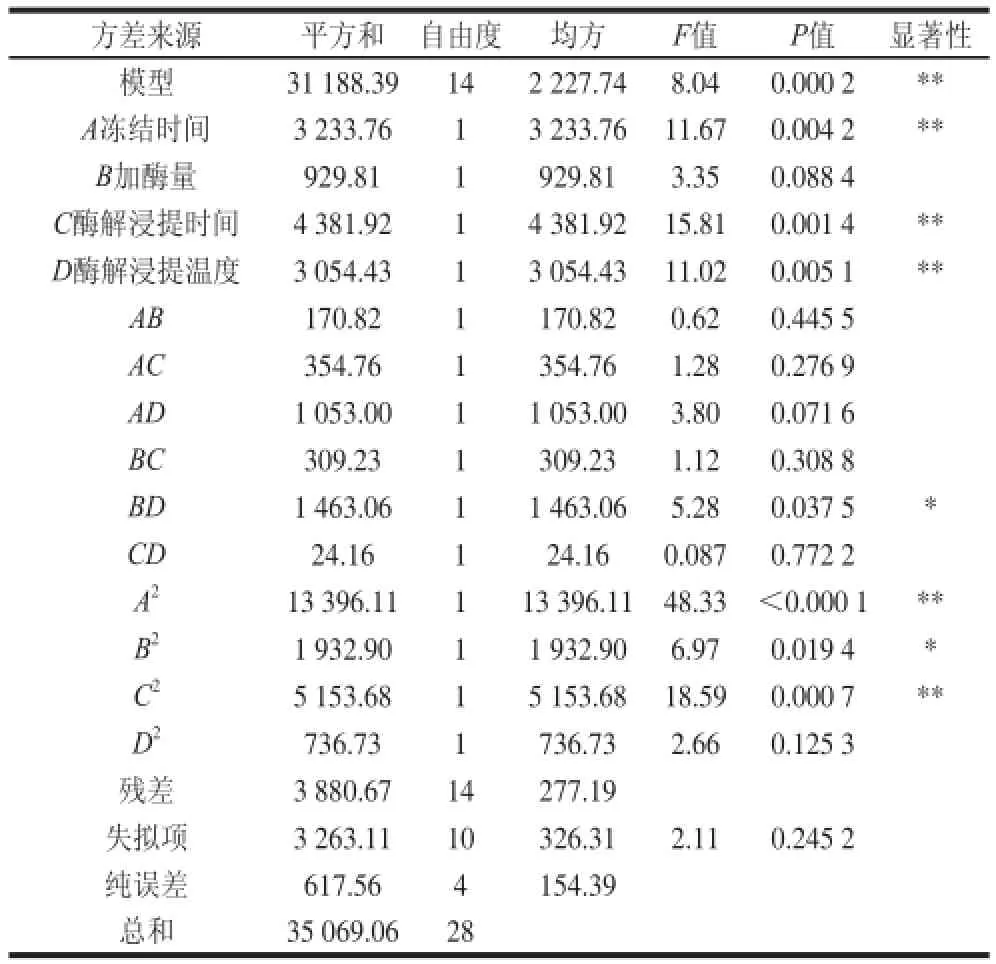
表3 回归方程系数显著性检验表Table3 Signifi cance test for regression equation coeffi cients
2.2.2 各因素间交互作用响应面分析
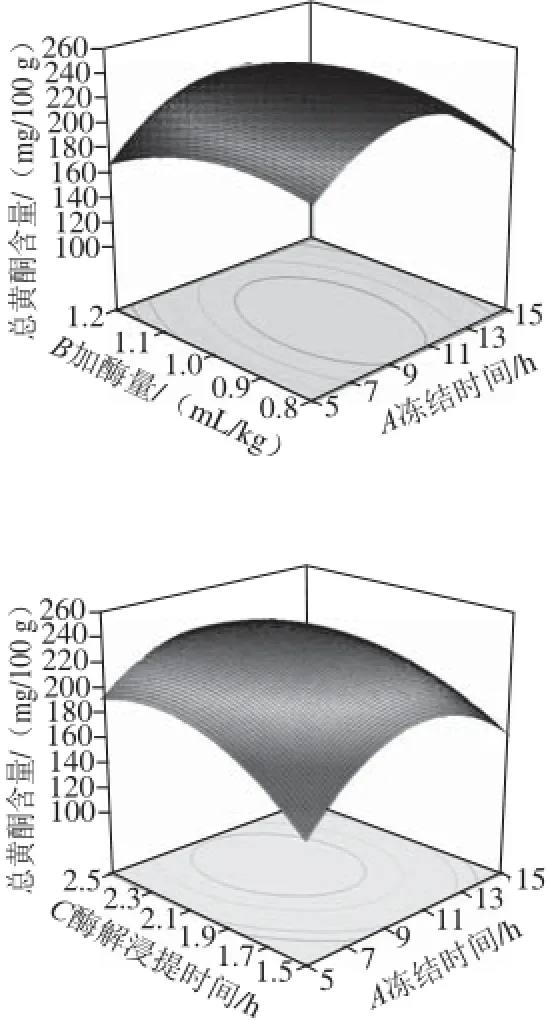
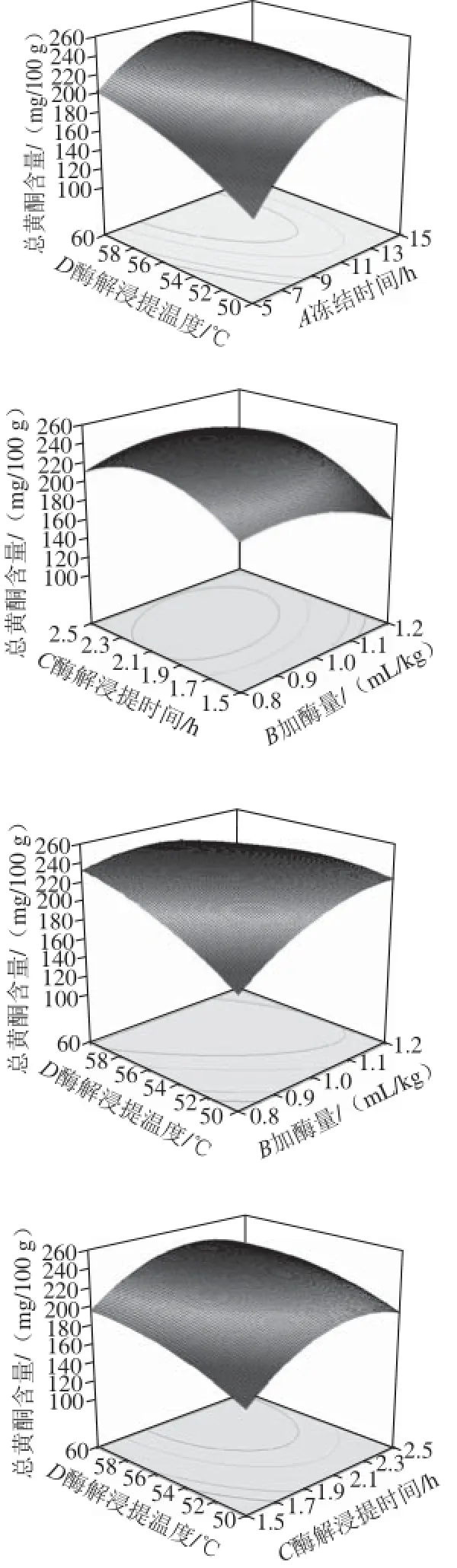
图5 各因素交互作用响应面图Fig.5 Response surfaces showing the pairwise interactive effects
由图5可以看出,加酶量(B)与酶解浸提温度(D)、冻结时间(A)与酶解浸提温度(D)交互作用对山楂汁中总黄酮含量影响较大,其他各因素间交互作用的影响较小。同时由表3方差分析结果也显示,加酶量(B)与酶解浸提温度(D)之间交互作用对山楂汁中总黄酮含量具有显著影响(P<0.05),而其他各因素间交互作用对山楂汁中总黄酮含量的影响不显著(P>0.05)。试验条件下,各因素间交互作用对山楂汁中总黄酮含量的影响大小依次为BD>AD>AC>BC>AB>CD。
2.2.3 最 佳工艺条件预测与验证实验结果
根据回归模型,预测得到冻融软化-酶法制备高黄酮山楂汁工艺的在稳定状态下的最佳工艺条件为:冻结时间9.93 h、加酶量0.97 mL/kg、酶解浸提时间2.14 h、酶解浸提温度59.36 ℃。在此条件下,制备得到的山楂汁中的总黄酮含量理论上可以达到243.18 mg/100 g。考虑到实际操作的可行性,将工艺条件在回归方程得到的理论值基础上修正为:冻结时间10 h、加酶量1.0 mL/kg、酶解浸提时间2.15 h、酶解浸提温度60 ℃。采用此工艺条件进行验证实验,实际测得的山楂汁中的总黄酮含量平均为241.59 mg/100 g,基本与预测值相符,说明优化结果可靠,具有实际应用价值。
2.3 不同山楂汁制备工艺比较
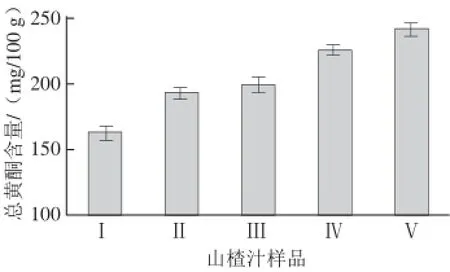
图6 不同工艺制备山楂汁中的总黄酮含量Fig.6 Total favonoid contents of hawthorn juices prepared with different methods
由图6可以看出,山楂经过冻融处理后再用酶法浸提得到的果汁中总黄酮含量显著高于其他制汁方式(P<0.05)。经优化后的冻融软化-酶法制备工艺(Ⅴ)所得到山楂汁中的总黄酮含量可较传统的热水浸提方式(Ⅰ)提高48.26%,并分别较鲜果直接酶法浸提(Ⅱ)及热烫后酶法浸提(Ⅲ)提高25.14%和20.92%,说明冻融软化处理可显著改善山楂果实中黄酮类化合物的酶法浸提效果,有利于提高山楂果汁中黄酮类化合物的含量,是生产高总黄酮含量的功能性山楂汁产品的较好方法。
3 结 论
黄酮类化合物是山楂中最重要的生物活性成分之一,具有抗氧化、降血脂、降血压、抑制血栓形成、抗肿瘤、抗过敏、抗菌、改善消化紊乱、降低血糖指标等生物活性,对多种疾病的预防和治疗具有重要作用[26-27]。因此,研究开发富含黄酮类化合物的山楂加工制品成为山楂功能化加工的重点。
本研究在单因素试验基础上,采用响应面分析法对冻融软化-酶法制备高黄酮山楂汁的工艺进行了优化,得出最优工艺条件为冻结时间10 h、加酶量1.0 mL/kg、酶解浸提时间2.15 h、酶解浸提温度60 ℃,在此条件下,山楂汁中的总黄酮含量可以达到241.59 mg/100 g,得到的回归模型对试验拟合较好。说明可以用于指导高总黄酮含量山楂果汁的生产。
山楂经过冻融处理后再用酶法浸提得到的果汁中总黄酮含量显著高于其他制汁方式。冻融软化处理可显著改善山楂果实中黄酮类化合物的酶法浸提效果,有利于提高山楂果汁中黄酮类化合物的含量,是生产高总黄酮含量的功能性山楂汁产品的较好方法。然而,由于冻融处理是一种非热处理方法,不具备热烫处理的灭酶功能,因此可能会造成酶促褐变的加剧[28],部分水果甚至还会造成风味的变化[29-30]。关于冻融软化制备山楂汁过程中褐变的控制以及冻融处理对山楂汁风味物质的影响,有待于进一步研究。
[1] 孟庆杰, 王光全, 张丽. 山楂功能因子及其保健食品的开发利用[J].食品科学, 2006, 27(12): 873-877.
[2] RIGELSKY J M, SWEET B V. Hawthorn: pharmacology and therapeutic uses[J]. American Journal of Health-System Pharmacy, 2002, 59(5): 417-422.
[3] EDWARDS J E, BROWN P N, TALENT N, et al. A review of the chemistry of the genus Crataegus[J]. Phytochemistry, 2012, 79(1): 5-26.
[4] WU Jiaqi, PENG Wei, QIN Rongxin, et al. Crataegus pinnatifida: chemical constituents, pharmacology, and potential applications[J]. Molecules, 2014, 19(2): 1685-1712.
[5] 孟宪军, 张立道, 马岩松. 不同浸汁条件对山楂原汁品质的影响[J].食品科学, 1993, 14(7): 18-22.
[6] 李硕, 郭成宇. 不同生产工艺过程对冻山楂果汁品质的影响研究[J].现代食品科技, 2013, 29(4): 835-840.
[7] 代守鑫, 周颖, 王成荣. 山楂汁不同提取工艺的优化研究[J]. 饮料工业, 2011, 14(6): 11-13.
[8] 李继海, 马月申, 丰宝田. 酶解冷榨法在山楂制汁上的应用效果[J].特产研究, 1993(1): 1-3.
[9] 廖小军, 胡小松, 刘一和, 等. 山楂浓缩汁工艺研究[J]. 食品科学, 1999, 20(1): 62-64.
[10] KALT W. Effects of production and processing factors on major fruit and vegetable antioxidants[J]. Journal of Food Science, 2005, 70(1): R11-R19.
[11] NAYAK B, LIU R H, TANG J. Effect of processing on phenolic antioxidants of fruits, vegetables, and grains: a review[J]. Critical Reviews in Food Science and Nutrition, 2015, 55(7): 887-918.
[12] DELGADO A E, RUBIOLO A C. Microstructural changes in strawberry after freezing and thawing processes[J]. LWT-Food Science and Technology, 2005, 38(2): 135-142.
[13] CHASSAGNE-BERCES S, POIRIER C, DEVAUX M F, et al. Changes in texture, cellular structure and cell wall composition in apple tissue as a result of freezing[J]. Food Research International, 2009, 42(7): 788-797.
[14] PHOTHISET S, CHAROENREIN S. Effects of freezing and thawing on texture, microstructure and cell wall composition changes in papaya tissues[J]. Journal of the Science of Food and Agriculture, 2014, 94(2): 189-196.
[15] NADULSKI R, GROCHOWICZ J, SOBCZAK P, et al. Application of freezing and thawing to carrot (Daucus carota L.) juice extraction[J]. Food and Bioprocess Technology, 2015, 8(1): 218-227.
[16] 吴树青, 董明, 王强, 等. 猕猴桃冷冻破壁离心取汁工艺[J]. 食品科学, 2010, 31(18): 55-58.
[17] 石小琼, 王在明, 林耀琦, 等. 冻融工艺在改善桃金娘果实榨汁效果上的应用研究[J]. 食品科学, 1996, 17(9): 27-30.
[18] CHUNG H S, KIM D S, KIM H S, et al. Effect of freezing pretreatment on the quality of juice extracted from Prunus mume fruit by osmosis with sucrose[J]. LWT-Food Science and Technology, 2013, 54(1): 30-34.
[19] 王海燕, 李睿, 曾秀, 等. 响应面优化超声波提取桑叶槲皮素工艺[J]. 食品科学, 2014, 35(22): 56-62. doi: 10.7506/spkx1002-6630-201422011.
[20] 陆永旺, 劳玲玲, 陈华妮, 等. 酸荔枝核黄酮体外抗氧化作用的研究[J].中国酿造, 2013, 32(7): 104-106.
[21] OHNIHISI S, FUJII T, MIYAWAKI O. Freezing injury and rheological properties of agricultural products[J]. Food Science and Technology Research, 2003, 9(4): 367-371.
[22] PURI M, SHARMA D, BARROW C J. Enzyme-assisted extraction of bioactives from plants[J]. Trends in Biotechnology, 2012, 30(1): 37-44.
[23] HONG Y H, JUNG E Y, PARK Y, et al. Enzymatic improvement in the polyphenol extractability and antioxidant activity of green tea extracts[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(1): 22-29.
[24] 王振宇, 夏祥慧, 李宏菊. 响应面分析法优化大果沙棘总黄酮提取工艺[J]. 东北林业大学学报, 2009, 37(6): 30-32.
[25] YANG Li, JIANG Jianguo, LIN Qingsheng, et al. Response surface optimization of ultrasound-assisted flavonoids extraction from the flower of Citrus aurantium L. var. amara Engl[J]. Journal of Separation Science, 2010, 33: 1349-1355.
[26] 沈燕琳, 董文轩, 李鲜, 等. 山楂酚类物质及其生物活性研究进展[J].园艺学报, 2013, 40(9): 1691-1700.
[27] JURIKOVA T, SOCHOR J, ROP O, et al. Polyphenolic profi le and biological activity of Chinese hawthorn (Crataegus pinnatifi da Bunge) fruits[J]. Molecules, 2012, 17(2): 14490-14509.
[28] MARTINEZ M V, WHITAKER J R. The biochemistry and control of enzymatic browning[J]. Trends in Food Science and Technology, 1995, 6(6): 195-200.
[29] MODISE D M. Does freezing and thawing affect the volatile profi le of strawberry fruit (Fragaria ananassa Duch.)?[J]. Postharvest Biology and Technology, 2008, 50: 25-30.
[30] KAEWTATHIP T, CHAROENREIN S. Changes in volatile aroma compounds of pineapple (Ananas comosus) during freezing and thawing[J]. International Journal of Food Science and Technology 2012, 47: 985-990.
Optimization of Freeze-Thawing Softening-Enzymatic Preparation of Flavonoids-Rich Hawthorn Fruit Juice by Response Surface Methodology
ZHANG Chunling, LIU Hui, CHEN Dalei, LIU Jiechao, HUANG Jinian, JIAO Zhonggao*
(Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences, Zhengzhou 450009, China)
To obtain hawthorn fruit ju ices with high nutritional value and powerful health benefi ts, freeze-thawing softening combined with enzymatic extraction was applied for the preparation of hawthorn fruit juices, and the optimum preparation conditions for the highest content of total fl avonoids was obtained by using Box-Behnken experimental design and response surface methodology. Results indicated that pretreatment with freeze-thawing improved the enzymatic extraction of flavonoids from hawthorn fruit, and thereby it was favorable for the preparation of flavanoids-rich hawthorn fruit juice. Among the factors which influence the content of flavonoids , the duration and temperature for enzymatic extraction as well as freezing time affected significantly the content of flavonoids in hawthorn fruit juices (P < 0.05), while the amount of enzyme had minor effect. The optimum preparation conditions were freezing for 10 h followed by enzymatic extraction for 2.15 h at 60 ℃ with addition of 1.0 mL/kg pectinase. Under these conditions, the content of flavonoids in hawthorn fruit juice was 241.59 mg/100 g as experimental value, which agreed well with the predicted value according to the regression model.
hawthorn; freeze-thawing; fruit juice; fl avonoids; optimization; response surface methodology
TS255.44
A
1002-6630(2015)22-0063-06
10.7506/spkx1002-6630-201522011
2015-05-05
郑州市现代农业科技创新工程项目(131PZDGC113);中国农业科学院科技创新工程专项(CAAS-ASTIP-2015-ZFRI)作者简介:张春岭(1983—),男,助理研究员,硕士,研究方向为果品营养与加工。E-mail:zhangchunling@caas.cn
*通信作者:焦中高(1972—),男,副研究员,博士,研究方向为果品营养与保鲜加工。E-mail:jiaozhonggao@caas.cn

