提高具有高起泡性大豆蛋白水解物得率的研究
邓辰辰 陈 洁 何志勇 秦 昉 曾茂茂
(江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
大豆蛋白氨基酸组成平衡、营养品质优良,同时具有良好的溶解性、乳化性、起泡性和凝胶性等加工性质,是食品工业中重要的蛋白质之一。天然大豆蛋白尽管有着不错的各种性质,然而其起泡性远不如蛋清蛋白、乳化性远不如酪蛋白、凝胶性也远不如肌纤维蛋白,总体而言,天然大豆蛋白尚不足以满足实际应用的需要[1]。通过对大豆蛋白进行物理、化学及酶法改性可以有效提高其功能性质[2,3],并使之具有作为功能性食品配料的应用潜力。其中酶法改性因其温和、自然和无害的特点,受到重点关注。
酶法改性是利用酶制剂对大豆蛋白进行有限水解,通过蛋白酶部分水解蛋白质,降低分子量、增加其带电基团并让更多的疏水基团暴露出来,从而达到改变蛋白质功能性质的目的,例如提高乳化性、起泡性、溶解性等[2]。但是,大豆蛋白经过酶解会产生大量沉淀,得到的大豆蛋白产物得率也较低[4,5]。有研究[6,7]表明,沉淀的聚集体可能是通过疏水相互作用和二硫键形成的。
前人研究[8]以及本实验室前期研究[9,10]显示,采用木瓜蛋白酶水解大豆蛋白,在水解度约为3%时,产物起泡性较好,但是得率低下(<45%)。本研究针对酶解大豆蛋白产物得率低的问题,以木瓜蛋白酶水解大豆分离蛋白(SPI)获得的高起泡性产物为研究对象,通过在酶解或灭酶时添加还原剂Na2SO3、表面活性剂吐温80、大豆卵磷脂,寻找缓解疏水作用和二硫键导致的聚集体和沉淀问题的途径。研究过程通过测定各自的酶水解进程曲线、产物得率、产物起泡性和稳定性以及上清液和沉淀氨基酸分析来判断聚集体形成的阻断效应。本研究旨在为寻找提高酶水解大豆蛋白得率的途径提供理论和技术依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
大豆:东北毛豆王,黑龙江尚志市庆美种业有限公司;
木瓜蛋白酶:250U/mg,上海如吉生物有限公司;
亚硫酸钠、吐温80:分析纯,国药集团化学试剂有限公司;
大豆卵磷脂:分析纯,美国Sigma公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
家用粉碎机:9FZ-15B型,台州余国电器有限公司;
高速冷冻离心机:Avanti J-26型,美国Beckman公司;
数显恒温水浴锅:HH-4型,江苏金坛市荣华仪器制造有限公司;
机械搅拌器:RW20D型,上海IKA仪器有限公司;
磁力搅拌器:C-MAG MS10型,广州仪科实验仪器有限公司;
循环水式多用真空泵:SHB-III型,郑州长城科工贸有限公司;
酸度计:DELTA 320型,梅特勒-托利多仪器(上海)有限公司;
高速乳化均质机:T18型,英国IKA公司。
1.2 方法
1.2.1 SPI的制备 采用碱提酸沉法[3]。大豆去皮碾碎成粉(60目),加入正己烷乙醇溶液(9︰1,V︰V)脱脂(料液比1︰3,m︰V),室温搅拌30min,浸提,抽滤后平铺于托盘中挥发过夜。脱脂豆粉与水(料液比1︰10,m︰V)混合后,用2mol/L的NaOH调pH到8.0,室温下搅拌2h,双层纱布过滤,滤液15 900×g离心25min。取上清液用2mol/L的HCl液调pH到4.5,3 300×g离心15min,得到沉淀;加水复溶并调到中性,微量凯氏定氮法测其浓度(m/V),加入0.03%叠氮化钠于4℃保藏。
1.2.2 木瓜蛋白酶水解大豆分离蛋白 高起泡性大豆蛋白水解物制备参考文献[11]。调节SPI溶液浓度至5%(m/V),取150mL加入酶反应器,调节pH 为7.0,温度55℃,搅拌30min,加入木瓜蛋白酶(酶与底物的比为1%)进行酶反应,反应过程中利用0.2mol/L的NaOH溶液滴定,保持pH恒定,并记录每分钟NaOH溶液的消耗量。通过pH-stat法计算水解度为3%时NaOH的消耗量,当水解度达到3%时,沸水浴加热10min终止反应,冷却后以4 360×g离心20min,收集上清液和沉淀。采用Lowry法测定上清液中蛋白质含量。起泡剂得率为上清液中蛋白质含量除以水解大豆分离蛋白量。样品S1为空白,S2为在酶解前加入0.1%Na2SO3,S3为在灭酶前加入0.1%Na2SO3,S4为在酶解前加入0.1%吐温80,S5为在灭酶前加入0.1%吐温80,S6为在酶解前加入0.1%大豆卵磷脂,S7为在灭酶前加入0.1%大豆卵磷脂,S8为在酶解前加入0.1%Na2SO3和大豆卵磷脂,S9为在灭酶前加入0.1%Na2SO3和大豆卵磷脂,S0为原始未酶解的SPI。
1.2.3 水解度的测定 根据文献[11],通过pH-stat法计算蛋白质的水解度。
1.2.4 起泡性和泡沫稳定性的测定 根据文献[10]。
1.2.5 氨基酸分析 根据文献[9]和[10]。
2 结果与讨论
2.1 SPI的酶解曲线

图1 木瓜蛋白酶水解大豆分离蛋白的酶解速率曲线Figuer 1 Digestion rate curve of hydrolysis of SPI by papain
采用pH-stat法测定木瓜蛋白酶水解SPI的进程曲线,结果见图1。其中S1、S3、S5、S7的酶解曲线相同,统一用S1代表。由图1可知,随着酶解时间的延长,蛋白质的水解度逐渐增大,尤其在最初的20min水解速率很大,之后逐渐平缓下来。添加还原剂Na2SO3的样品S2,其酶解速率明显快于空白样品S1;添加表面活性剂吐温80或大豆卵磷脂的样品S4和S6,其酶解速率在前10min略快于样品S1,而后速率明显下降,明显慢于样品S1;同时添加Na2SO3和大豆卵磷脂的样品S8,其酶解速率最快。通常而言,还原剂Na2 SO3可以还原二硫键,抑制二硫键引起的聚集,而表面活性剂则有可能破坏蛋白质中的疏水键、氢键和盐键[3]。上述结果暗示,还原剂Na2SO3和吐温80可以部分抑制SPI在水解过程中聚集,帮助蛋白质分子基团展开,从而促进底物和酶的结合并加快水解速率;然而水解后期表面活性剂则难以起到进一步抑制聚集促进水解的效应。
2.2 SPI酶解上清液的得率
样品S1~S9酶解上清液的得率见图2。样品S2和S3的得率比空白提高了10%,且酶解前后加入得率几乎无差别,该结果暗示酶解产物得率下降可能产生于加热灭酶阶段,二硫键的还原有助于该阶段聚集体成长和沉淀的缓解。
样品S4和S5的得率差别显著,酶解时加入表面活性剂吐温80可以有效提高得率,而酶解后加热前加入,尽管也能提升得率,但是效果远不如酶解时加入,该结果说明,酶解过程由于打开了SPI分子结构,促进了由于疏水相互作用产生的聚集体沉淀,而表面活性剂吐温80可以有效抑制这种聚集;而在加热灭酶前加入吐温80尽管可以部分抑制加热过程引发的疏水聚集,但是无法使水解阶段已经聚集的体系解离,因而S5的得率显著低于S4的。
由样品S6和S7的得率可以看出,具有还原性的两性离子型表面活性剂——大豆卵磷脂无法有效抑制疏水聚集,在酶解前的加入甚至还促进了沉淀的产生。
由于卵磷脂是目前制造大豆蛋白的常用分散剂,而吐温80有异常风味,很少在工业中使用,因此样品S8和S9叠加使用了还原剂Na2SO3和表面活性剂卵磷脂。从结果可以看出,同时添加还原剂的表面活性剂能够很好地抑制沉淀的产生,显著提升酶解产物得率。该结果暗示如果能够有效抑制酶解过程和加热灭酶阶段的疏水聚集、二硫键结合效应,酶解产物的得率是可以有效提升的。
2.3 SPI酶解上清液的起泡性和稳定性
为了考察各种聚集抑制剂对产物功能性的影响,试验同步测定了各种产物的起泡性和泡沫稳定性,样品S1~S9酶解上清液的起泡性和稳定性结果见图3。相比较而言,未酶解的样品S0,其起泡性和稳定性最差。还原剂Na2SO3的加入,可以部分提高产物起泡性,但对稳定性影响不显著;而表面活性剂吐温80的加入则使产物起泡性和泡沫稳定性均显著下降;卵磷脂的加入降低了产物起泡性,但不影响稳定性。还原剂Na2SO3和表面活性剂卵磷脂的叠加使用使产物的起泡性和稳定性均轻微下降。产物起泡性和泡沫稳定性的改变,可能是体系中还原剂和表面活性剂导致,也可能是还原剂和表面活性剂的加入不仅影响了聚集体的生成还影响了酶解过程产物的水解模式,从而导致产物性质改变。
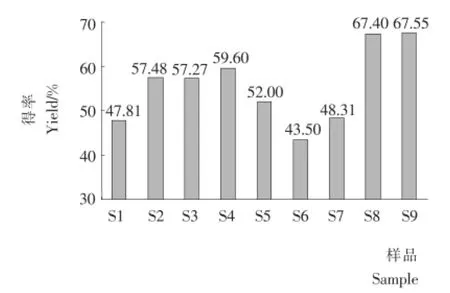
图2 大豆分离蛋白酶解上清液的得率Figuer 2 Yield of supernatant fluid of enzymatic hydrolysis of SPI
2.4 酶解上清液和沉淀的氨基酸组成
为了进一步了解酶解产物性质改变的原因,将各个条件下水解的样品(S1~S9)酶解后的上清液和沉淀进行了氨基酸分析,结果见表1、2。由于采用酸法测定,色氨酸无法测得。由表1可知,上清液中各个样品之间氨基酸组成差别不是非常显著;但沉淀中除了谷氨酸以外,各个样品之间其他氨基酸组成也差异不大,沉淀中S2、S3、S8和S9 4个样品中谷氨酸含量显著低于其他样品。值得注意的是,将表1和表2进行对照可以发现,上清中的谷氨酸和赖氨酸含量显著高于沉淀中的;而异亮氨酸、缬氨酸、亮氨酸、苯丙氨酸、酪氨酸等疏水性氨基酸含量均低于沉淀中的。该结果与Tomotake等[12]的研究结果基本一致。这些结果进一步说明了水解过程沉淀的产生与疏水相互作用有较大关联性。
3 结论
本研究主要针对酶解大豆蛋白产物得率低下的问题,在木瓜蛋白酶水解大豆蛋白的不同阶段加入还原剂Na2SO3、表面活性剂吐温80、大豆卵磷脂以及它们的组合,寻找缓解由于酶水解及随后的加热灭酶过程中由于疏水作用和二硫键导致的聚集体和沉淀问题的途径。结果显示,在木瓜蛋白酶水解大豆分离蛋白时,加入适量的还原剂Na2SO3和表面活性剂大豆卵磷脂,不仅能够显著加快水解进程,同时能够显著提高酶解产物得率,得率提高了50%以上;而酶解过程单独加入还原剂Na2SO3,则可以获得最好的产物性质,即产物起泡性和泡沫稳定性最佳。水解产物上清液和沉淀的氨基酸分析结果表明,沉淀中的疏水性氨基酸含量高于上清液,说明水解过程聚集和沉淀的产生与疏水相互作用有重要关联。本研究为更好地生产酶改性大豆蛋白产品提供了理论参考。

表1 大豆分离蛋白酶解上清液的氨基酸组成Table 1 Amino acid in supernatant fluid of enzymatic hydrolysis of SPI %
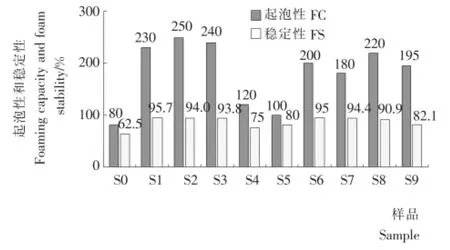
图3 大豆分离蛋白酶解上清液的起泡性和稳定性Figuer 3 Foaming capacity and stability of enzymatic hydrolysis of SPI
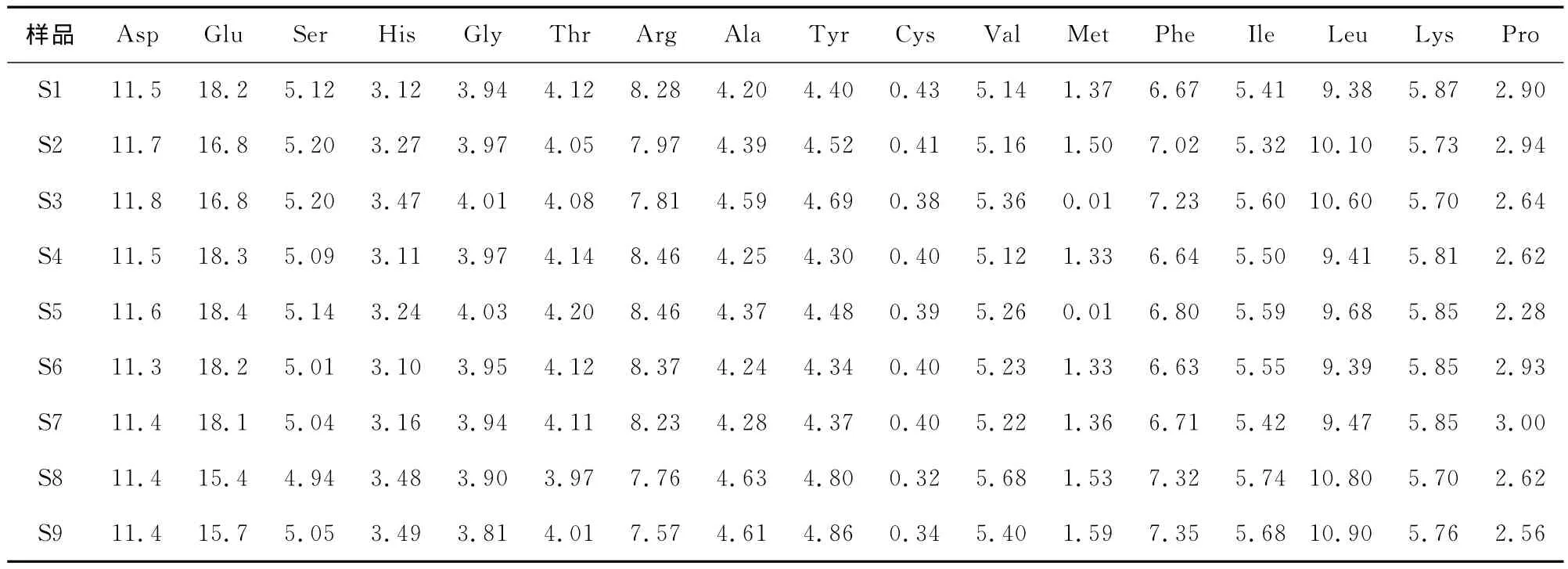
表2 大豆分离蛋白酶解沉淀的氨基酸组成Table 2 Amino acid in sediment of enzymatic hydrolysis of SPI %
1 黄友如,华欲飞.大豆分离蛋白的改性及其对功能性质的影响[J].中国油脂,2003,28(4):35~38.
2 Molina Ortiz S E,Wagner J R.Hydrolysates of native and modified soy protein isolates:structural characteristics,solubility and foaming properties[J].Food Research International,2002,35(6):511~518.
3 迟玉杰,朱秀清,李文滨,等.大豆蛋白质加工新技术[M].北京:科学出版社,2008.
4 Were L,Hettiarachchy N S,Kalapathy U.Modified soy proteins with improved foaming and water hydration properties[J].Journal of Food Science,1997,62(4):821~824.
5 徐红华,刘欣.复合酶法改善大豆分离蛋白起泡性的工艺优化[J].食品与发酵工业,2007,33(1):51~54.
6 于泓鹏,唐传核,曾庆孝,等.大豆分离蛋白水解多肽聚集物的组成及相互作用[J].华南理工大学学报,2006,34(8):105~109.
7 Creusot N,Gruppen H.Hydrolysis of whey protein isolate with bacillus licheniformis protease:aggregating capacities of peptide fractions[J].Journal of Agricultural and Food Chemistry,2008,56(21):10 332~10 339.
8 于鸿鹏.大豆蛋白水解多肽的聚集机理及其调控[D].广州:华南理工大学,2005.
9 李维瑶.高起泡性大豆分离蛋白的研究及其在蛋糕中的应用[D].无锡:江南大学,2010.
10 刘瑾.酶法改善大豆分离蛋白起泡性和乳化性的研究[D].无锡:江南大学,2008.
11 Adler-Nissen J.Determination of the degree of hydrolysis of food protein hydrolysates by rinitrobenzenesulfonic acid[J].Journal of Agricultural and Food Chemistry,1979,27(6):1 256~1 262.
12 Tomotake H,Shimaoka I,Kayashita J,et al.Physicochemical and functional properties of buck wheat protein product[J].Journal of Agricultural and Food Chemistry,2002,50(7):2 125~2 129.

